AbMole LPS(脂多糖)在免疫激活、動物造模等方面的應用及案例分享
脂多糖(Lipopolysaccharides, LPS)(M9524)是革蘭氏陰性細菌細胞壁的主要成分,它在免疫學、微生物學和炎癥研究領域有著重要的應用。AbMole提供高品質(zhì)抑制劑、細胞因子、人源單抗、靶點蛋白、天然產(chǎn)物、熒光染料、多肽、化合物庫、抗生素,全球大量文獻專利引用。
1. 免疫激活作用
LPS(Lipopolysaccharides,M9524)是經(jīng)典的病原相關分子模式(PAMP),通過結合免疫細胞表面的模式識別受體(如TLR4/MD2/CD14復合體),激活下游信號通路;
促炎細胞因子釋放:LPS可誘導巨噬細胞、樹突狀細胞等分泌TNF-α、IL-1β、IL-6、IL-8等炎癥因子;
趨化因子表達:LPS能促進單核細胞、中性粒細胞等向炎癥部位遷移;
共刺激分子上調(diào):LPS可增強抗原呈遞細胞(如樹突狀細胞)的MHC-II和CD80/CD86表達,促進T細胞活化。AbMole是ChemBridge中國區(qū)官方指定合作伙伴。
成功案例:來自AbMole的LPS(M9524)被科研人員用于誘導激活巨噬細胞,并通過體外共培養(yǎng)來研究EGFR突變的腫瘤細胞對巨噬細胞吞噬能力的影響(圖1)
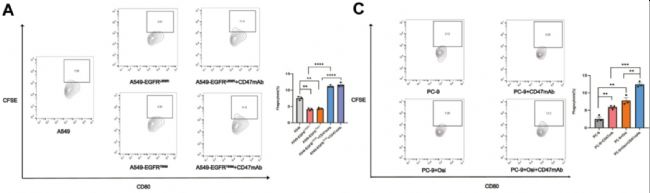
圖1. LPS(M9524)處理后的巨噬細胞的吞噬能力可被含有EGFR突變的腫瘤細胞阻斷[1]。
2. 炎癥反應機制研究
LPS(脂多糖,M9524)被廣泛用于研究各類炎癥信號相關的通路。
激活NF-κB通路:LPS可通過TLR4觸發(fā)MyD88依賴性信號,導致NF-κB核轉位,調(diào)控炎癥基因轉錄;
激活MAPK通路:LPS可誘導JNK、ERK、p38磷酸化,調(diào)控細胞增殖、凋亡或分化;
炎癥小體激活:高濃度LPS可激活NLRP3炎癥小體,促進IL-1β的成熟釋放;
成功案例:AbMole的LPS(脂多糖,Lipopolysaccharides,M9524)被科研人員用于激活NF-κB信號通路,以評估表兒茶素沒食子酸酯(EGCG)對NF-κB信號通路的影響。發(fā)現(xiàn)LPS可有效激活NF-κB信號通路,而EGCG對LPS誘導的NF-κB激活沒有顯著影響(圖2)。
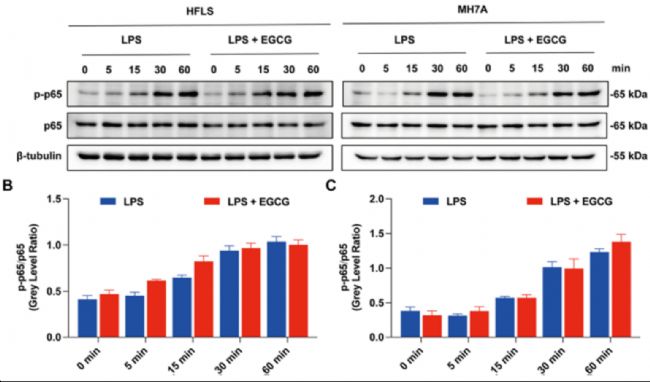
圖2. EGCG不能抑制HFLS和MH7A細胞中LPS(M9524)誘導的NF-κB活化[2]
3. 構建疾病模型
敗血癥模型:高劑量LPS(脂多糖,M9524)注射小鼠后可模擬膿毒癥中的“細胞因子風暴”,因此可用于構建敗血癥動物疾病模型;
腸炎模型:LPS可用于誘導腸道上皮細胞或免疫細胞炎癥,模擬炎癥性腸病(IBD);
神經(jīng)炎癥研究:LPS可刺激小膠質(zhì)細胞或星形膠質(zhì)細胞,常用于研究阿爾茨海默病、帕金森病等神經(jīng)退行性疾病中的炎癥機制;
肺損傷模型:LPS激活TLR4后,免疫細胞會釋放大量的促炎細胞因子并加劇炎癥反應,誘導肺部組織細胞的凋亡。因此LPS也常用作小鼠肺損傷模型的造模劑;
成功案例:由AbMole提供的LPS(Lipopolysaccharides,M9524)被用作一種刺激劑,用于模擬膿毒癥誘導的急性肺損傷(ALI)的炎癥反應。實驗人員發(fā)現(xiàn)LPS可引起支氣管上皮細胞BEAS-2B的凋亡。

圖3. 經(jīng)LPS(M9524)處理后,支氣管上皮細胞BEAS-2B中凋亡細胞數(shù)量顯著增加,而Tranilast預處理能夠顯著減少凋亡細胞的數(shù)量[3]。
4. 細胞應激與死亡研究
細胞凋亡:LPS(M9524)可通過激活caspase通路誘導某些細胞(如內(nèi)皮細胞)凋亡;
壞死性凋亡(Necroptosis):LPS可以通過激活TLR4和RIPK1/RIPK3/MLKL信號通路,導致細胞膜的通透性增加,引起細胞腫脹和破裂,最終引發(fā)細胞壞死性凋亡;
自噬調(diào)控:LPS可通過TLR4或炎癥因子間接調(diào)控自噬活性;
鐵死亡:LPS通過激活NF-κB,促進炎癥因子(IL-6、TNF-α)釋放等方式加劇氧化應激,進而可誘導細胞的鐵死亡,并且它還可上調(diào)鐵轉運蛋白,增加細胞內(nèi)游離鐵(Fe²⁺)的水平以促進Fenton反應,產(chǎn)生活性氧(ROS)以誘發(fā)鐵死亡。
成功案例:來自AbMole的LPS(脂多糖,Lipopolysaccharides,M9524)被實驗人員用于處理HK2細胞(人腎小管上皮細胞),發(fā)現(xiàn)LPS處理的HK2細胞中,脂質(zhì)過氧化水平和鐵離子(Fe2+)含量均顯著增加,說明LPS可引起HK2細胞的鐵死亡。

圖4. LPS(M9524)可引起HK2細胞的鐵死亡[4]。
5. 其他功能
內(nèi)毒素耐受研究:低劑量LPS(脂多糖,Lipopolysaccharides)預處理可誘導細胞對后續(xù)高劑量LPS的耐受性(耐受機制與表觀遺傳修飾相關);
屏障功能研究:破壞上皮或內(nèi)皮細胞緊密連接(如腸道或血腦屏障模型),研究通透性變化;
抑制劑篩選:LPS(M9524)可用于測試抗炎試劑(如TLR4抑制劑、細胞因子拮抗劑)的效果。
AbMole多年來持續(xù)聚焦跟進抑制劑的最新動態(tài),為全球科研客戶提供高純度、高生物活性的各類小分子抑制劑、激動劑和人源化單抗。
參考文獻及鳴謝
[1] HU L Y, ZHUANG W T, CHEN M J, et al. EGFR Oncogenic Mutations in NSCLC Impair Macrophage Phagocytosis and Mediate Innate Immune Evasion Through Up-Regulation of CD47 [J]. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer, 2024, 19(8): 1186-200.
[2] XU H, GAN C, XIANG Z, et al. Targeting the TNF-α-TNFR interaction with EGCG to block NF-κB signaling in human synovial fibroblasts [J]. Biomedicine & pharmacotherapy Biomedecine & pharmacotherapie, 2023, 161: 114575.
[3] LOU Y, HUANG Z, WU H, et al. Tranilast attenuates lipopolysaccharide‑induced lung injury via the CXCR4/JAK2/STAT3 signaling pathway [J]. Molecular medicine reports, 2022, 26(1).
[4] XU S, LUO J, WANG Y, et al. Fatty Acid Binding Protein-4 Silencing Inhibits Ferroptosis to Alleviate Lipopolysaccharide-induced Injury of Renal Tubular Epithelial Cells by Blocking Janus Kinase 2/Signal Transducer and Activator of Transcription 3 Signaling [J]. Journal of physiological investigation, 2024, 67(1): 47-56
- PCL-PVAc-PEG在活性物遞送和生物材料上的應用優(yōu)勢
- PROTAC連接子中作用機制及氮雜環(huán)的結構優(yōu)勢與功能特性
- OK432在腫瘤和免疫研究中的作用機制及應用優(yōu)勢
- 鐵調(diào)素Hepcidin-25作為鐵代謝和免疫反應關鍵調(diào)節(jié)因子的功能和作用
- 糖蛋白Fibronectin在細胞培養(yǎng)中的功能及作用
- TDP-43的結構與功能及在漸凍癥(ALS)等神經(jīng)退行性疾病中的作用機制
- DNP-BSA(2,4-二硝基苯偶聯(lián)牛血清白蛋白)在免疫學研究與檢測中的作用
- AbMole LPS(脂多糖)在免疫激活、動物造模等方面的應用及案例分享
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





