新型蛋白抑制劑SIC-19通過泛素化促進SIK2蛋白降解進而抑制卵巢癌
由蘇州大學第一附屬醫院婦產科的Fang Wang,Yi Zhang,Jinhua Zhou 團隊發表的名為“A novel SIK2 inhibitor SIC-19 exhibits synthetic lethality with PARP inhibitors in ovarian cancer”的論文中,研究人員從ChemBridge化合物庫中篩選出能夠與鹽誘導激酶2(SIK2)結合的全新抑制劑SIC-19,該抑制劑通過泛素化途徑促進SIK 2蛋白降解。SIC-19不僅在多種卵巢癌細胞系上體現較好的抑制活性,還在卵巢癌類器官和SKOV3異種移植體內模型中增強了PARP抑制劑Olaparib的抑癌效果。AbMole是ChemBridge在中國的官方指定合作伙伴。


SIK2是一種屬SNF1/AMP家族的絲氨酸/蘇氨酸蛋白激酶,能調節多種生物學功能,并在不同途徑中充當信號傳遞的角色。SIK2能通過促進糖酵解、抑制氧化磷酸化及糖異生來增強Warburg效應,并促進脂肪合成和脂肪酸β-氧化以調節細胞內脂質代謝,最終誘導卵巢癌的生長、增殖、侵襲、轉移。已有的SIK2抑制劑特異性不強,因此需要尋找到特異性更強的SIK2抑制劑。
一、篩選新型SIK2蛋白抑制劑
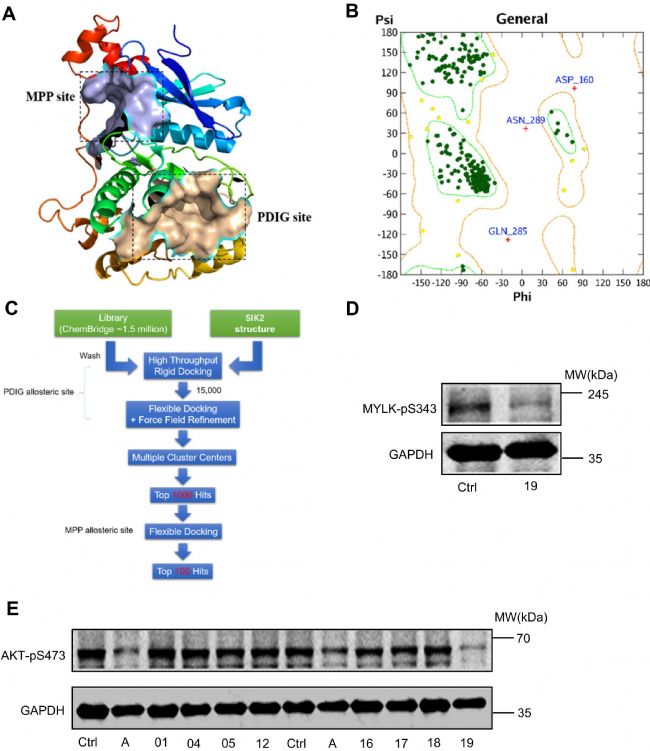
研究人員使用Molecular Operating Environment (MOE)軟件進行SIK2蛋白的同源建模。通過BLAST分析確定模板晶體結構,通過Ramachandran圖分析驗證了模型的準確性。
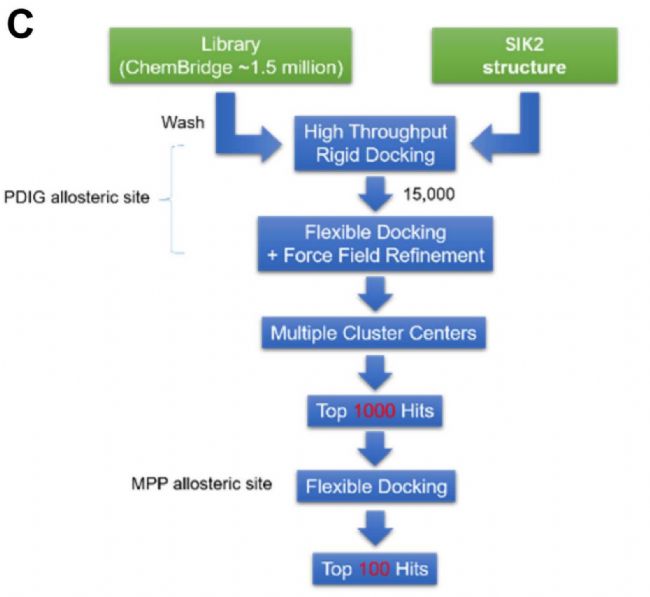
接下來,研究人員使用調整好的蛋白模型進行基于結構的虛擬篩選。定義SIK2蛋白的PDIG別構位點為結合位點,先對ChemBridge化合物庫進行高通量剛性篩選,得到排名靠前的15000個化合物。然后,研究人員對這些化合物進行柔性對接和多中心對接,得到評分最高前100個化合物。隨后,從Chembridge化合物庫中獲得前20個化合物用于進一步篩選。之前的研究表明SIK2可誘導AKT在Ser 473處和MYLK在Ser 343處的磷酸化,因此作者通過檢測上述特定位點處的磷酸化水平來評估所開發的SIK 2抑制劑的功效。結果顯示,與其他組相比,ChemBridge化合物SIC-19更顯著地降低了AKT在Ser 473處的磷酸化水平,甚至效果要優于陽性對照ARN-3236。對MYLK-Ser 343的磷酸化檢測也驗證了這一結果。

圖1. 新型SIK 2抑制劑的設計與篩選
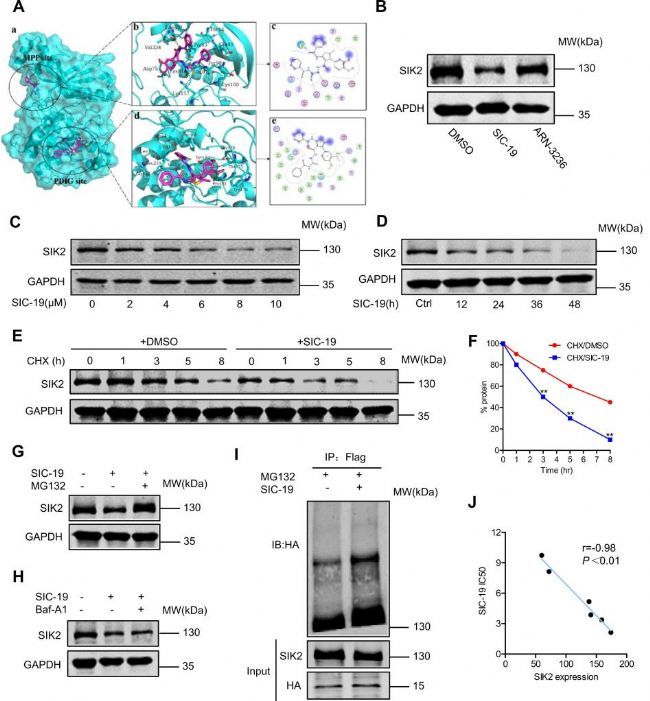
二、探究SIC-19對SIK2的抑制機理
隨后作者通過計算機模擬分析了SIC-19對SIK2的作用機制,并且還發現經過SIC-19處理后,SIK2的蛋白表達水平明顯降低,而相同濃度的ARN-3236則無明顯變化。并且SIC-19還可縮短SIK2蛋白的半衰期。作者還通過設計實驗證明了SIC-19介導的SIK2降解依賴蛋白酶體,并且SIC-19可增加SIK2的泛素化修飾。綜上,SIC-19通過泛素化-蛋白酶體的途徑誘導SIK2的降解。隨后為了評估SIC-19對腫瘤細胞的功效,研究人員檢測了SIC-19對6種卵巢癌細胞系的IC50值,范圍為2.13 μM至9.74 μM,而且該IC50值與SIK2的表達呈負相關。

圖2. SIC-19通過泛素化途徑促進SIK 2蛋白降解
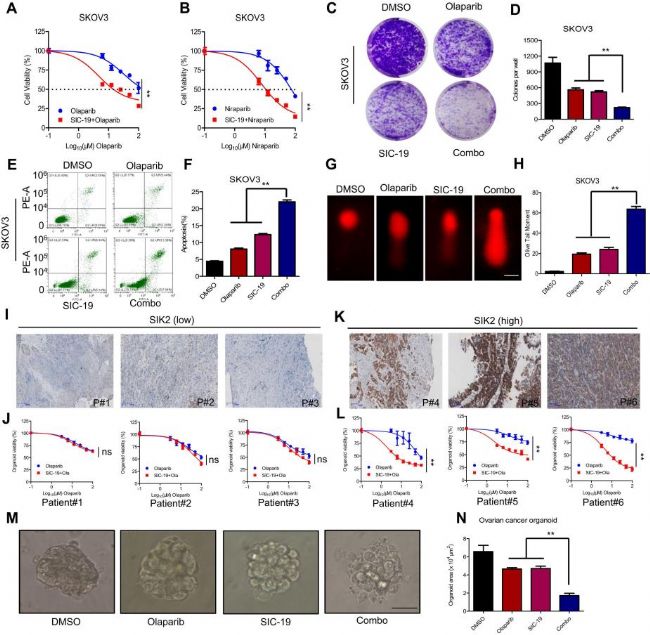
三、SIC-19可增強卵巢癌細胞對PARP抑制劑的敏感性
已知SIK2會降低AKT-(pS473)的磷酸化并增加γH2AX,而后者又是DNA雙鏈斷裂(DSB)損傷的重要標志。因此,作者對SIC-19能否增加卵巢癌細胞對PARP抑制劑的敏感性進行了考察。結果顯示與對照組相比,SIC-19處理可明顯降低奧拉帕利(Olaparib)和尼拉帕利(Niraparib)的IC50,這與直接敲除SIK2的結果是相似的。克隆形成實驗、流式細胞術凋亡檢測實驗等結果也證實了上述猜想。并且研究人員通過彗星實驗證明了SIC-19處理增加了PARP抑制劑造成的細胞損傷。綜上,SIC-19通過降解SIK2并且利用DNA修復缺陷來增強卵巢癌細胞對PARP抑制劑的敏感性。隨后,用SIC-19和各種濃度的Olaparib對類器官進行5天的組合處理,并計算細胞存活率。結果表明,當用SIC-19和Olaparib的組合處理時,具有高SIK 2表達的類器官表現出顯著的活性降低。 訂購ChemBridge,盡在AbMole。

圖3. SIC-19在體外提高了卵巢癌對PARP抑制劑的敏感性
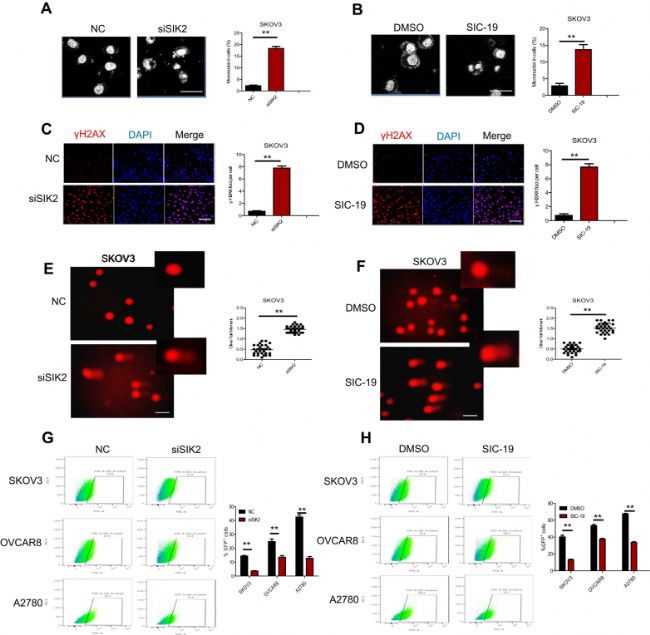
四、SIC-19增強PARP介導的DNA損傷和凋亡
為驗證SIC-19可引起DNA損傷和凋亡,作者設計了以下實驗。DNA損傷常表現為微核的增加,DAPI染色的結果表明,SIC-19處理和直接敲除SIK2含微核的細胞百分比顯著增加。γH2AX染色和彗星試驗,發現在卵巢癌SKOV3細胞中敲除SIK2和SIC-19處理后,病灶形成率均有所增加;彗星試驗結果顯示,敲除SIK2和SIC-19處理后,尾部中DNA的量增加。

圖4. SIC-19增強PARP介導的DNA損傷和凋亡
為進一步研究SIK2對同源重組(HR)介導的DNA損傷修復的影響,在穩定表達野生型BRCA1/2的SKOV3、OVCAR8和A2780細胞中進行了HR報告基因實驗,發現SIK2敲除和SIC-19處理都導致GFP+細胞比例下降,表明HR介導的DNA損傷修復受損。上述發現表明,靶向SIK2會誘導DSB損傷,阻礙卵巢癌細胞的同源重組修復(圖4)。
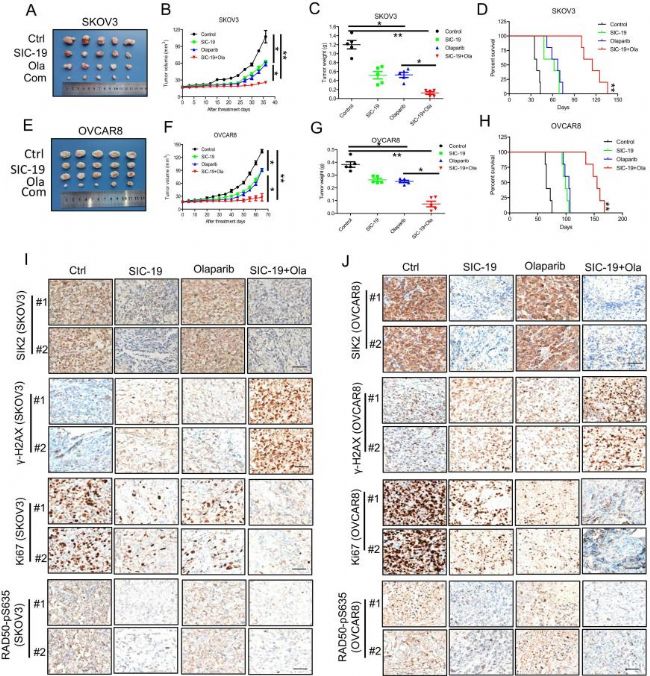
五、SIC-19可增強體內卵巢癌對PARP抑制劑的敏感性
隨后作者還分別驗證了SIK 2可易位至細胞核、SIC-19可阻斷核微絲的形成,以及SIK 2通過磷酸化RAD 50的Ser 635位點調控MRN復合體和核微絲。并對SIC-19與PARP抑制劑Olaparib組合的體內效果進行評估。SKOV3異種移植中,用SIC-19或奧拉帕尼單獨處理顯著抑制腫瘤生長(P <0.05),而二者聯合后效果更加顯著(P <0.01),且大大提高生存率。而這些結果與在OVCAR 8異種移植模型中觀察到的結果一致。SKOV 3和OVCAR 8異種移植腫瘤的免疫組化分析進一步驗證了之前的體外結果,用SIC-19處理增加γH2 AX水平,并且當與Olaparib組合時,效果進一步增強。并且在SIC-19處理的腫瘤中,SIK 2表達及其直接下游效應物pRAD 50-Ser 635均有所降低(圖5)。

圖5 SIC-19增強體內卵巢癌對PARP抑制劑的敏感性
六、總結

圖6. 基于ChemBridge數據庫的SIK2抑制劑篩選
在本研究中,研究者模擬了SIK2在體內的蛋白模型,并從ChemBridge化合物數據庫的1400000個化合物中篩選出全新的SIK2抑制劑。在此過程中,ChemBridge多樣性好且成藥性強的化合物庫為實現這一重大突破提供了堅實的支持。最終,研究人員在ChemBridge化合物庫中篩選出結合好、活性高的化合物,并應用到了抑制卵巢癌的體內外研究中!AbMole是ChemBridge在中國的官方指定合作伙伴。
鳴謝:Wang F, Yu X, Qian J, Cao Y, Dong S, et al. A novel SIK2 inhibitor SIC-19 exhibits synthetic lethality with PARP inhibitors in ovarian cancer. Drug Resist Updat.2024 May;74:101077.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





