Nature分享:血小板降解劑DePLT抑制癌癥復發和轉移的作用原理及優勢
文章原創為:莫名 文章來源于:醫藥魔方Pro
靶向蛋白降解劑(TPD)相比傳統的小分子抑制劑具有潛在優勢。PROTAC、LYTAC等異雙功能分子同時“捕獲”效應蛋白(如E3連接酶)及興趣蛋白(POI,即靶蛋白),以誘導致病蛋白通過泛素-蛋白酶體系統(UPS)或溶酶體途徑降解。
然而,從藥理學的角度,嵌合體類藥物(如PROTAC為蛋白水解靶向嵌合體,LYTAC為溶酶體靶向嵌合體)具有自身的一些挑戰。從結構上來說,嵌合體由一個linker連接兩個binder組成,往往展現出較差的類藥特性,導致分子在作用部位的積累不足,增加了“off-target”或“off-tissue, on-target”的風險。從機制上來說,有效的TPD需要形成嵌合體-效應蛋白-興趣蛋白(chimera–effector–POI)三元復合物,這需要局部劑量和蛋白質豐度之間的精確時空協調,為藥物開發和遞送帶來了進一步的挑戰。

為解決這些問題,12月3日,發表在Nature Biotechnology雜志上的一項研究中,來自威斯康星大學麥迪遜分校的一個科學家團隊開發了一個將興趣蛋白binder-效應蛋白偶聯物(POI binder–effector protein conjugates)靶向遞送到患病部位的平臺。
利用血小板回到傷口區域并在激活后釋放其表面和細胞內內容物的能力,研究團隊首先將興趣蛋白(POI,即靶蛋白)的配體(binder)預先“拴到”血小板中的分子伴侶熱休克蛋白90 (HSP90)上(采用共價結合,不改變HSP90的功能)。基于HSP90能夠調節蛋白降解的特性,科學家們創建了一個能夠在體內降解細胞內和細胞外POI的新型TPD平臺——血小板降解劑(degrader platelets,DePLT)。
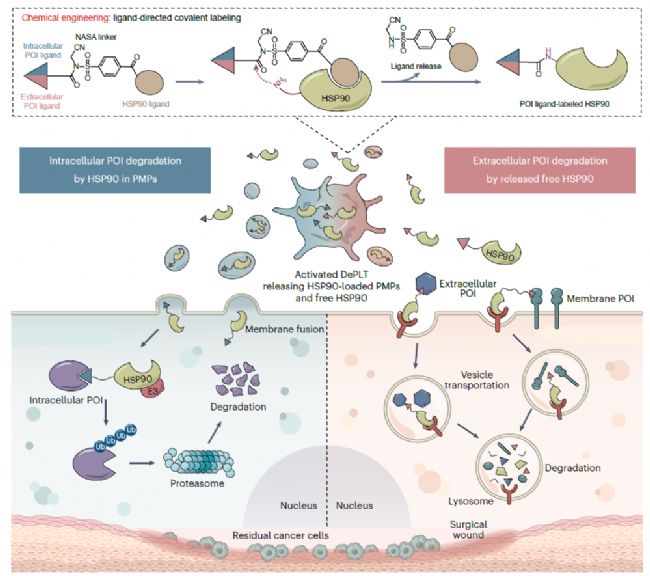
DePLT在出血性病變內降解細胞內或細胞外POI(來源:Nature Biotechnology)
研究人員預計,DePLT會特異性粘附在出血性病變上,并在凝血級聯激活后釋放興趣蛋白(POI)配體–HSP90偶聯物。激活的DePLT可通過兩種模式介導靶細胞的靶向蛋白降解:1)裝載進血小板衍生微粒(PMP)中的HSP90可以劫持UPS來降解細胞內的POI,2)釋放到環境中的游離HSP90可以誘導細胞外POI的溶酶體降解。
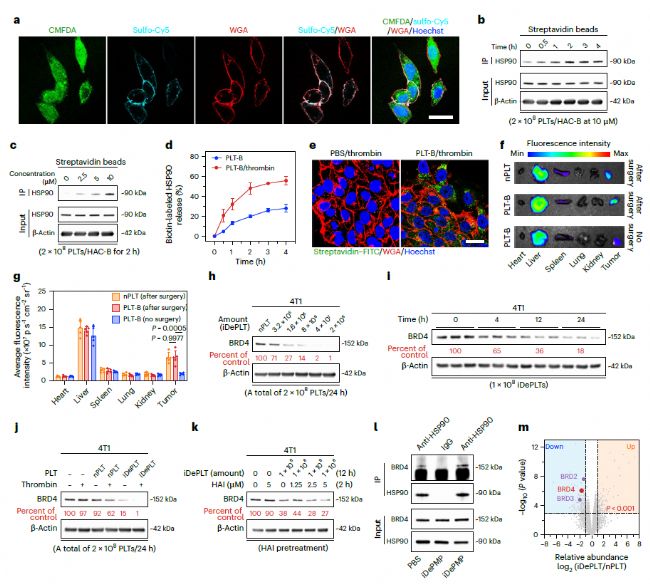
激活的DePLT通過PMP介導的膜融合轉移BRD4配體標記的HSP90到癌細胞中,然后通過UPS降解BRD4。(來源:Nature Biotechnology)
在乳腺癌細胞中,研究人員使用BRD4作為DePLT降解細胞內POI的案例。DePLT將預先標記了BRD4配體的HSP90包裝到PMP中,然后遞送到靶細胞,在靶細胞中與BRD4形成二元復合物,啟動UPS介導的降解。此外,研究還觀察到,預先標記了PD-L1配體的HSP90從活化的血小板中釋放出來,之后捕獲癌細胞表面的PD-L1,并通過低密度脂蛋白受體相關蛋白1 (LRP-1)介導的內吞作用進入靶細胞,重定向PD-L1進行溶酶體降解。
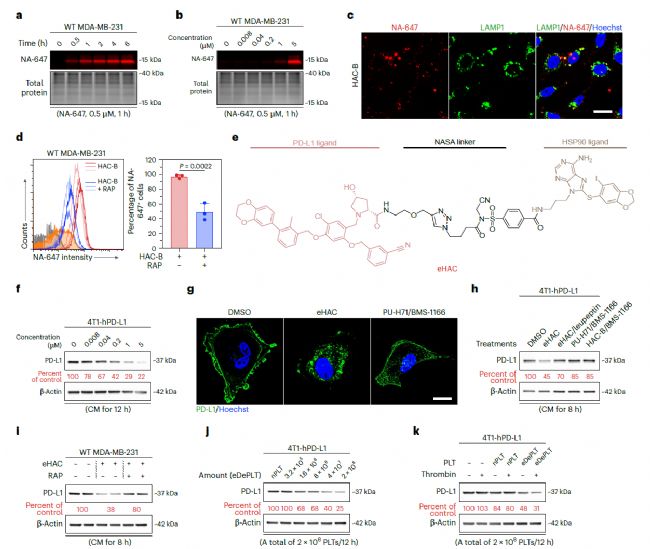
DePLT釋放PD-L1配體標記的胞外HSP90,利用溶酶體機制降解癌細胞上的PD-L1。(來源:Nature Biotechnology)
在術后乳腺癌小鼠模型中,靶向BRD4的DePLT有效抑制了癌癥復發和轉移,靶向PD-L1的DePLT成功觸發了抗癌免疫應答。
據悉,接下來,研究團隊將致力于提升DePLT技術的可控性,以促進該技術的臨床應用。
參考資料:
[1]https://www.nature.com/articles/s41587-024-02495-7
[2]https://www.nature.com/articles/s41587-024-02494-8
[3]https://mp.weixin.qq.com/s/Z7dX2DgovOEvMOLHn0t4-Q?token=862444931&lang=zh_CN





