深度梳理CAR療法:從CAR-T、CAR-NK到CAR-M的難點與解決策略
嵌合抗原免疫受體(CAR)療法的發展已有一定歲月,在過去的一二十年間,它已悄然改變惡性腫瘤的治療版圖,也將迎來其廣闊的發展前景和未來。今天小編就將對CAR-T,CAR-NK, CAR-M這幾種CAR療法展開討論,討論它們各自的優勢以及局限性。
近年來,免疫療法作為繼外科切除術,放射性療法,化療之后治療惡性腫瘤的第四大基石持續并且高速發展。現今取得巨大成功的免疫療法主要包括免疫檢查點抑制劑(ICIs)和CAR過繼細胞療法。
相較ICI療法在多靶點,多適應癥的獲批上,目前僅有六種CAR-T療法獲得FDA準許用于B細胞來源的血液系統腫瘤,略顯力絀。而CAR-T用于治療實體瘤的大門也尚未完全打開,亟待探索。
1. 何為CAR結構?
無論是CAR-T,CAR-NK,CAR-M都有相似的CAR結構,CAR是一種通過基因工程合成的細胞表面受體,由抗原結合區,鉸鏈區,跨膜區和胞內信號轉導區組成。
抗原結合區可以識別腫瘤相關抗原(TAA),決定了治療的靶向性。
鉸鏈區是一段將抗原結合區暴露給靶標抗原的間隔區域,它的長短通常都是由靶標抗原的位置決定的。
跨膜區的主要功能是將CAR定位在免疫細胞膜上。
細胞內信號傳導區是研究最廣泛的領域,是影響CAR免疫細胞抗腫瘤活性的關鍵。基于對該區域的研究和改進,產生了三代CAR結構。第一代CAR結構僅僅擁有一個CD3ζ信號區域,而T細胞的活化不僅需要TCR-CD3的激活,也需要共刺激信號CD28的激活,所以這限制了第一代CAR-T的抗腫瘤活性和在體內的存續性。二代三代CAR結構則在此基礎上,增加了CD28或者4-1BB共刺激結構域,甚至對某些共刺激域進行組合以達到更好的抗腫瘤效果。實驗證實,擁有DAP10和CD27兩種共刺激域的CAR-T細胞在體內具有最佳抗腫瘤效果。
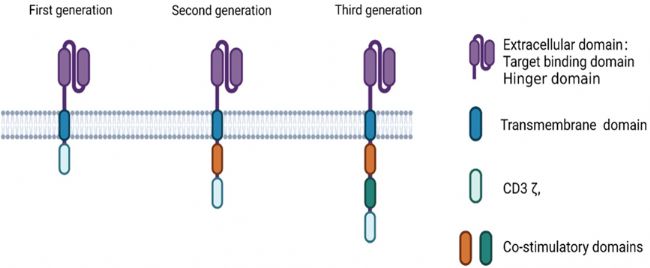
圖1:三代CAR結構(來源:資料一)
近年來發現,除了對信號傳導區的設計和改造外,一些修飾也有助于提高抗腫瘤效應,弱化治療毒性。例如表達趨化因子受體的CAR-T細胞更易浸潤至腫瘤微環境(TME);雙靶點T細胞可以靶向兩處腫瘤抗原來避免免疫逃逸的發生。
2. 奠基之石:CAR-T
治療現狀
目前通過FDA審批的六種CAR-T藥物均靶向B細胞表面marker,其中有四種靶向CD19,用于復發難治性B細胞急性淋巴細胞白血病(ALL-B)、大B細胞淋巴瘤、濾泡性淋巴瘤或套細胞淋巴瘤治療,而靶向B細胞成熟抗原(BCMA)的兩款藥物則是用于多發性骨髓瘤(MM)的治療。今年3月1日,FDA也正式批準了傳奇生物的CAR-T產品,西達基奧侖賽(cilta-cel),用于治療復發/難治性多發性骨髓瘤患者。這也是首款獲得FDA批準的國產CAR-T細胞療法。NMPA也批準了阿基侖賽注射液和奧基倫賽注射液兩款CAR-T藥物的上市。除此之外,有超過700項針對不同癌種的CAR-T臨床試驗正在全界范圍內展開。
CAR-T在實體腫瘤中應用的難點與解決策略
難點一:靶點的選擇
幾乎所有應用于實體腫瘤CAR-T療法的靶點在正常細胞上均有表達。盡管在血液腫瘤的治療上也有此弊端,但因其對被損傷的正常細胞有挽救性糾正辦法(免疫球蛋白可以補充靶向B細胞CAR-T治療后機體功能的損失),以及血細胞本身快速的再生能力,on target-off tumor 效應在血液腫瘤中得以很好的控制。而實體腫瘤卻不具備上述優勢,CAR-T治療容易對機體造成毀滅性的打擊,且沒有很好的解救方案。
策略:
i. Spilt-and策略。可以將初始信號域和共刺激信號域拆分至兩種CAR中,使CAR-T細胞只被擁有兩種TAA的細胞激活,減少誤傷。
ii. And-not策略。使CAR-T細胞在識別到某種正常組織上的marker之時,停止激活。
難點二:腫瘤抗原異質性
策略:
i. 選用雙或者多特異性CAR,靶向不同抗原。
ii. 制備裝配不同類型CAR的T細胞,靶向不同抗原。
難點三:CAR-T難以浸潤至腫瘤內部或功能受到腫瘤免疫抑制TME的影響
策略:
i. 針對不同腫瘤細胞趨化因子的表達分泌情況,在CAR-T上裝備在靶細胞上調趨化因子的受體,提高T細胞浸潤能力。
ii. 敲除CAR-T的TGF-β基因,減少免疫抑制水平,提高其抗腫瘤活性。
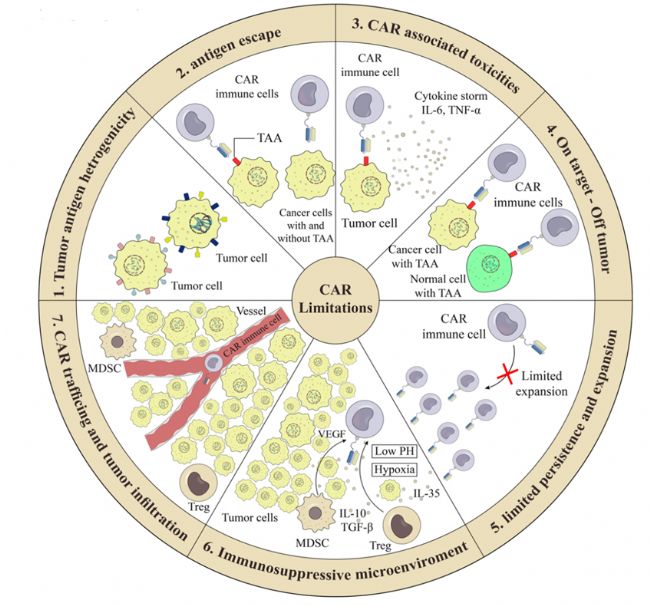
圖2:CAR-T的局限性(來源于資料二)
3. 前進之路:CAR-NK
在CAR-T的研究如火如荼之時,CAR-NK的開發也逐漸成為熱點。作為固有免疫系統中的一分子,NK細胞識別靶細胞并不需要MHC的提呈,而是直接與靶細胞結合發揮殺傷功能。不僅如此,因為細胞因子表達譜的差異,NK細胞的活化過程不會引起CRS,這也使得CAR-NK的開發具有其特別的意義和廣闊的未來。
相較于CAR-T的優勢
就免疫細胞的來源來說,CAR-T治療由于同種異體反應以及移植物抗宿主病(GVHD),往往只能選擇自體T細胞。然而大部分接受CAR-T治療的病人都已經經歷過一線或者二線的治療,很多病人的外周血中T細胞水平很低,自體T細胞的收集時間過長可能會延誤治療時機。而NK細胞的活化并非通過MHC途徑,則即使選用異體NK細胞,也可以避免GVDH。NK-92細胞系,臍帶血或是誘導多能干細胞等現成的細胞系都能成為免疫細胞的來源,并且可以批量化生產,防止延誤治療時機的慘劇出現。
就毒性反應來說,CAR-NK造成CRS和神經毒性的概率非常低,這與CAR-T的CRS高發生率有顯著差異。
就發揮殺傷作用的途徑來說,NK細胞既可以通過CAR途徑,也可以通過非CAR途徑殺傷腫瘤細胞。例如阻斷NK細胞表面的負性調節因子殺手免疫球蛋白樣受體(KIRs)提高NK細胞的活性,或是利用ADCC效應殺傷腫瘤細胞。
就生命周期來說,NK細胞在體內大約只有兩周的壽命。這顯然是一把雙刃劍,因為雖然它減輕了CAR-NK療法的on target- off tumor毒性,但如果想要達到持續的緩解狀態,就需要反復輸注。
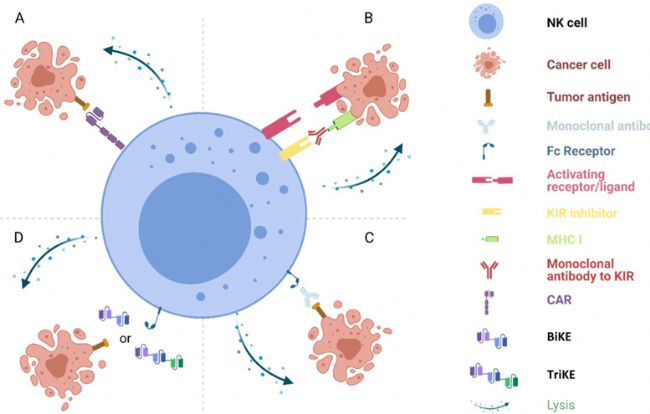
圖3: NK細胞進行癌癥免疫治療的四種途徑
(來源于資料一)
局限性
CAR-T治療中所遇到的某些挑戰在CAR-NK治療中同樣存在,例如靶點的篩選,抗原的異質性,CAR的設計以及NK細胞在腫瘤中的轉運和浸潤困難等問題。
另外值得重視的問題是如何優化CAR-NK細胞的制備和儲存工藝,更好地發揮其常備性優勢。
除此之外,NK細胞較短半衰期所造成的反復輸注CAR-NK細胞以維持長期緩解的現狀為治療造成了不小的挑戰。
腫瘤細胞所表達的MHC分子可與NK細胞表面抑制性KIRs結合抑制NK細胞的抗腫瘤活性。
4. 未來之星:CAR-M
雖然CAR-T在血液系統的惡性腫瘤中取得了巨大的成功,但我們卻還沒有在實體瘤的治療上看到明確療效。CAR-NK雖然可以克服CAR-T療法的一些缺點,但也仍然在實體瘤的應用上有很大局限性。而因巨噬細胞作為腫瘤微環境中占比最多的免疫細胞,CAR-M相比于CAR-T和CAR-NK具有以下幾點優勢:
免疫細胞在腫瘤微環境中的轉運和浸潤提高。缺氧環境下,腫瘤組織分泌的許多細胞因子(CCL2,CXCL12,CSF1和VEGF)都可以募集巨噬細胞,而一旦巨噬細胞進入腫瘤微環境,這些細胞因子在巨噬細胞上的受體隨即下調,將巨噬細胞牢牢鎖在腫瘤TME之中。
在免疫抑制微環境中強大的吞噬能力。大部分的實體瘤作為“免疫冷”腫瘤會排斥具有免疫殺傷功能的細胞進入TME,即使少部分進入TME的T細胞也總是呈現出活性缺失的狀態。而腫瘤微環境中的M1型(抗炎型)和M2型(抑炎型)都具有強大的吞噬能力,且其表型的高度可塑性也使M1和M2表型的相互轉化成為可能。
巨噬細胞在發揮吞噬作用的同時,作為抗原提呈細胞,進一步提高CAR-M的抗腫瘤活性。
盡管CAR-M在免疫治療領域具有巨大的潛能,但目前的CAR-M研究大多處于臨床前階段,只有一項靶向HER2過表達實體瘤的自體CAR-M研究處于Ⅰ期臨床階段,而CAR-M的研究主要集中在通過優化CAR結構活化和提高CAR-M吞噬靶細胞的功能。

圖4:CAR-M的研究現狀
總結與展望
CAR-T療法在血液腫瘤中取得巨大成就的同時,也因為腫瘤特異性抗原的缺乏,CAR-T細胞難以轉運和遷移至腫瘤組織內部以及免疫抑制性TME而難以在實體腫瘤的治療上發揮作用。
相比于CAR-T , CAR-NK較短的生命周期減弱了 on target-off tumor毒性,不同的細胞因子表達譜降低了CRS和神經毒性發生的風險,NK細胞非MHC途徑識別靶細胞的特性使異體CAR-NK發生GVHD的可能性降低。盡管如此,CAR-T所面臨的主要挑戰在CAR-NK上還是沒有得到有效的解決。
巨噬細胞作為TME中主要的免疫細胞,既有強大的吞噬功能,又有抗原提呈的作用以及高度的可塑性,在提高CAR免疫細胞腫瘤浸潤以及克服腫瘤免疫抑制TME這兩方面有很大發展潛力,這也在Klichinsky實驗室進行的一項靶向HER2過表達的實體腫瘤CAR-M試驗中得以印證。
CAR免疫細胞療法已然成為抗腫瘤治療的重點領域。盡管挑戰重重,科學家們仍然拿出了一個又一個的應對策略。在血液學領域高歌猛進的同時,科學家們也正努力讓CAR在實體瘤的治療上占據一席之地。CAR治療的發展也將側重于尋找適宜的腫瘤特異性抗原,根據免疫細胞的類型改造CAR結構,減毒策略,鑒別適用于裝配CAR結構的免疫細胞,以及控制CAR免疫細胞在體內發揮作用的時間和效力,努力使CAR細胞療法成為更為有效,安全的抗癌方案。
【參考文獻】
1. Pan K, Farrukh H, Chittepu VCSR, Xu H, Pan CX, Zhu Z. CAR race to cancer immunotherapy: from CAR T, CAR NK to CAR macrophage therapy. J Exp Clin Cancer Res. 2022 Mar 31;41(1):119. doi: 10.1186/s13046-022-02327-z. PMID: 35361234; PMCID: PMC8969382.
2. Keshavarz A, Salehi A, Khosravi S, Shariati Y, Nasrabadi N, Kahrizi MS, Maghsoodi S, Mardi A, Azizi R, Jamali S, Fotovat F. Recent findings on chimeric antigen receptor (CAR)-engineered immune cell therapy in solid tumors and hematological malignancies. Stem Cell Res Ther. 2022 Sep 24;13(1):482. doi: 10.1186/s13287-022-03163-w. PMID: 36153626.
3. Pan C, Liu H, Robins E, Song W, Liu D, Li Z, Zheng L. Next-generation immuno-oncology agents: current momentum shifts in cancer immunotherapy. J Hematol Oncol. 2020 Apr 3;13(1):29. doi: 10.1186/s13045-020-00862-w. PMID: 32245497; PMCID: PMC7119170.
4. Sloas C, Gill S, Klichinsky M. Engineered CAR-Macrophages as Adoptive Immunotherapies for Solid Tumors. Front Immunol. 2021 Nov 24;12:783305. doi: 10.3389/fimmu.2021.783305. PMID: 34899748; PMCID: PMC8652144.





