全新蛋白酶體CT-L抑制劑的篩選和優化及其在改善乳腺癌中的應用價值
由美國莫菲特腫瘤研究中心的Sevil Ozcan、Saïd M. Sebti發表的名為“Oxadiazole-isopropylamides as Potent and Noncovalent Proteasome Inhibitors”的論文中,研究人員通過高通量篩選ChemBridge化合物庫發現了能改善乳腺癌的全新CT-L非共價抑制劑。

ATP依賴的泛素−蛋白酶體途徑負責調控真核細胞中蛋白質的降解。其中,26S蛋白酶體是一個由19S調節復合物(RP)和20S核心顆粒(CP)組成的多功能復合物。該蛋白酶體介導的三種主要催化反應,分別是:肽酰谷氨酰肽水解(PGPHL)、胰蛋白酶樣水解(T-L)和糜蛋白酶樣水解(CT-L)。其中,CT-L在凋亡和抑癌蛋白的降解中發揮重要作用。因此,研究人員想開發具有良好抑瘤效果的新型CT-L抑制劑。研究人員從ChemBridge化合物庫中篩選出新型CT-L抑制劑,并進行了進一步的活性和結構優化。
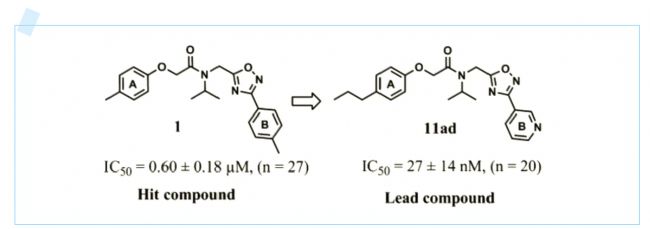
圖1.A:苗頭化合1和先導化合物11ad的結構和IC50。
現有的蛋白酶體抑制劑是通過醛基、硼酸酯、乙烯砜和環氧酮通過共價修飾與CT-L發揮作用的,但對癌癥細胞和正常細胞沒有選擇性。本文研究人員以各種化合物對癌癥細胞中CT-L的活性抑制為評判標準進行篩選,最后從ChemBridge化合物庫中篩選出新型CT-L抑制劑,并在美國癌癥研究協會會議中公布。
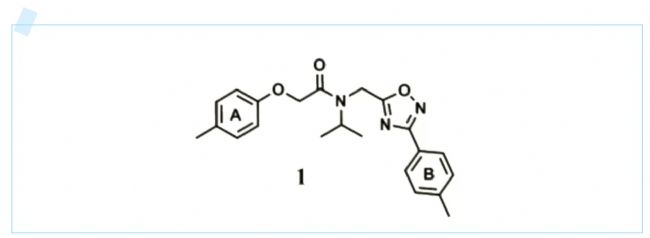
圖2.研究人員首次在美國癌癥研究協會會議中公布了新型CT-L抑制劑及其結構。
為了驗證化合物1與CT-L的結合方式,研究人員將化合物1和CT-L共價結合抑制劑Lactacystin與20S蛋白酶體孵育,并通過測定CT-L的透析結合,判斷化合物1與CT-L結合的可逆性。結果顯示,經過一段時間后,化合物1處理的CT-L開始恢復活性,說明化合物1和CT-L是非共價結合的。
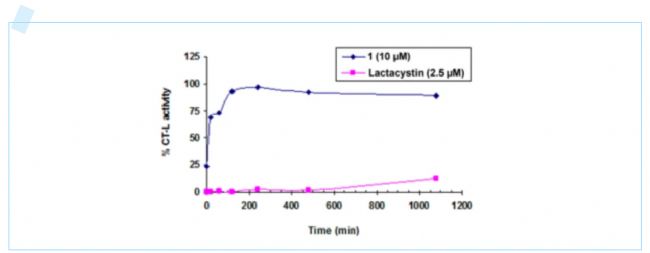 圖3.透析實驗揭示化合物1與CT-L發生非共價結合。
圖3.透析實驗揭示化合物1與CT-L發生非共價結合。
隨后,研究人員對化合物1進行了結構的優化。發現在A環上增加對位的碳原子數,比如把甲基替換為乙基有更好的活性,而使用芳雜環替代B苯環也能夠提高活性。于是,研究人員優化得到化合物11ad。
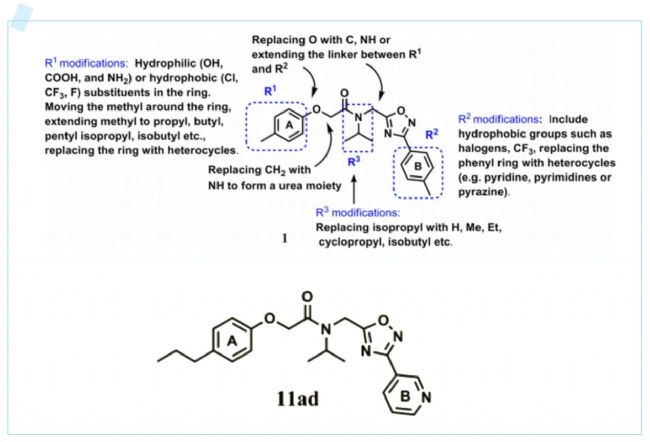
圖4.化合物1的結構優化思路及優化得到的化合物11ad結構
最后,研究人員對優化得到的化合物11ad的CT-L抑制活性在乳腺癌細胞上進行測評。研究人員分別用不同濃度化合物1和化合物11ad處理乳腺癌細胞系MDA-MB-231,并檢測其對CT-L和細胞活力的影響。結果顯示,化合物11ad對乳腺癌細胞的CT-L活性和細胞活力有很好的抑制作用,能夠顯著抑CT-L,并改善乳腺癌。
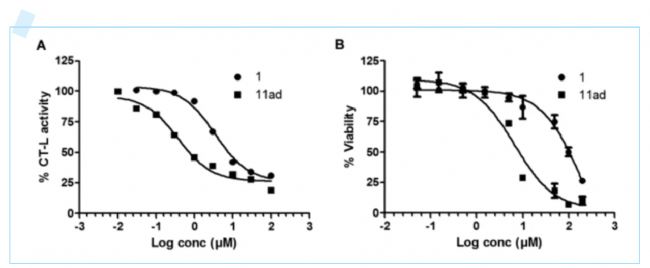 圖5.化合物1和化合物11ad對CT-L和乳腺癌抑制活性的對比
圖5.化合物1和化合物11ad對CT-L和乳腺癌抑制活性的對比
在本研究中,研究者提出蛋白酶體CT-L抑制劑在改善癌癥中的應用價值。隨后,研究者以抑制CT-L的活性作為原則,進行化合物篩選,并從ChemBridge化合物庫中篩選出新型CT-L抑制劑化合物1,通過結構優化得到先導化合物11ad。最后,研究者發現化合物11ad能夠作為新型的CT-L抑制劑,應用在改善乳腺癌中。
AbMole(奧默生物)是ChemBridge在中國的唯一官方指定合作伙伴。
鳴謝:Sevil Ozcan,Saïd M. Sebti et al. J Med Chem. 2013 May 23;56(10):3783-805..





