疫情下的醫學新答案:非人靈長類動物替代模型的選擇與評價
疫情對生活的影響是方方面面的
生命科學領域的研究工作
同樣也受到了疫情的影響
……
生命科學領域的研究工作
同樣也受到了疫情的影響
……
近日,針對新冠疫情導致的非人靈長類動物(non-human primate, NHP)短缺,美國食品藥品監督管理局(Food and Drug Administration, FDA)向新藥研發和研究人員發布新建議,敦促他們在一般毒理學研究中考慮使用NHP的替代品。
這項FDA文件是近年來開始出現的減少臨床前研究中使用NHP這一趨勢的最新例證。
什么是NHP?
NHP通常被認為是評估免疫刺激性抗體和相關產品毒性的金標準。因為與其他臨床前動物模型相比,NHP與人類的基因同源性最高。
用體外試驗替代NHP對只發生在體內的細胞非自主毒性作用,會有不能真實反應的風險,例如不能真實反應細胞因子釋放綜合征 (cytokine release syndrome, CRS) 的機制。
另一方面來說,大多數體內臨床前模型(如嚙齒動物、犬和兔)缺乏人特異性藥物靶點,轉化價值也非常低。
hu-PBMC-NSG模型是評價免疫毒性的轉化醫學實驗平臺
JAX hu-PBMC-NSG小鼠是移植有提前表征的人外周血單核細胞 (human peripheral blood mononuclear cell, PBMC) 的NSG™免疫缺陷小鼠,旨在用來在更小范圍內重現具有功能性的人免疫系統。經移植的小鼠已從簡單的“嚙齒動物模型”變成了與轉化相關的體內分析平臺。

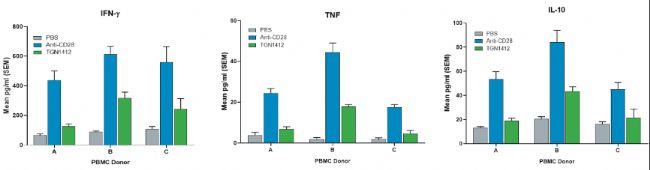
以hu-PBMC-NSG模型為平臺,評價單克隆抗體和雙特異性抗體的免疫毒性
不同于NHP,研究人員可以在hu-PBMC-NSG小鼠體內植入腫瘤,以評估藥物靶點作用引起的免疫毒性。當分析雙特異性抗體(如靶向CD3的雙特異性抗體)的CRS可能性時,這一特色至關重要(圖2)。因為評估此類抗體的活性和潛在毒性時,需要兩個抗體臂分別作用于其抗原靶標。
事實上,可以認為hu-PBMC-NSG小鼠比NHP更適合于免疫腫瘤藥物的毒理學評價,因為研究人員可以在目標腫瘤存在的情況下評價免疫毒性。
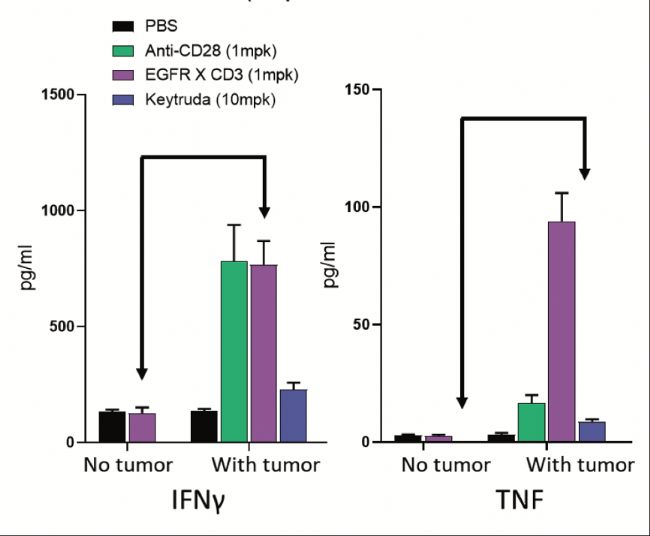
利用hu-PBMC-NSG平臺評價聯合用藥的免疫毒性
hu-PBMC-NSG小鼠的另一個用途是預測聯合用藥的CRS發生可能性。
由于成本、倫理和實際考慮等因素限制了NHP在多種藥物聯合治療測試中的使用,而hu-PBMC-NSG小鼠可為研究人員提供轉化相關結果,用以分析特定藥物聯合治療的潛在毒性和療效。
圖3為靶向EGFR的CD3雙特異抗體與Keytruda聯合治療的實例。結果表明,聯合用藥不會增加治療毒性,但也不會產生任何療效優勢。

(圖3:CD3雙特異抗體與Keytruda聯合治療不會導致促炎細胞因子釋放的絕對增加(左圖)。然而,聯合用藥會加速臨床評分癥狀(右圖),這說明細胞因子的釋放加快,進而導致毒性增強。有趣的是,聯合用藥并沒有增加療效(中圖)。)
以hu-PBMC-NSG模型轉化相關分析平臺,評估CAR T療法的免疫毒性
hu-PBMC-NSG對雙特異性抗體的反應也反映在CAR T細胞療法中,這一點尤為重要,因為大量患者會出現CRS癥狀的嚴重毒性反應。傳統的體外檢測不能模擬導致患者下游器官和神經系統毒性的全身免疫反應,而這些毒性免疫分析又是確定治療方法真正療效和安全性的關鍵特征。
在一項16天內完成的試驗中,人源化小鼠平臺重點測量單個患者的反應,其中CAR T療效和CRS可以利用單獨表征的PBMC供體一起測量,從而模擬臨床環境中的患者反應(圖4)。
在一項16天內完成的試驗中,人源化小鼠平臺重點測量單個患者的反應,其中CAR T療效和CRS可以利用單獨表征的PBMC供體一起測量,從而模擬臨床環境中的患者反應(圖4)。
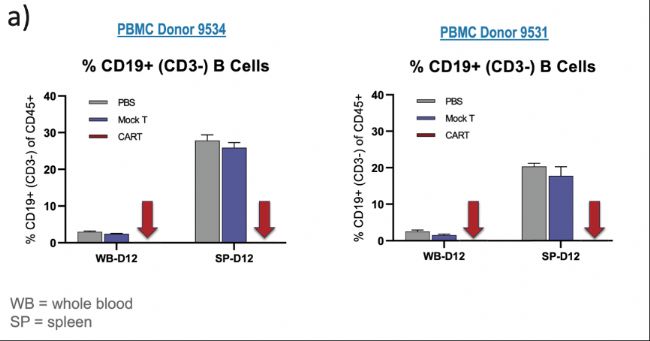
(圖4:不同供體表現出不同的活性/毒性比率。當比較圖4a中兩個單獨的供體時,在兩項研究中,模擬CAR T療法對血液或脾臟中的B細胞比率均沒有影響。代表CAR T的箭頭指向100%去除PBMC衍生的正常CD19+ B細胞,表明對兩個供體的療效和反應是完成的。)
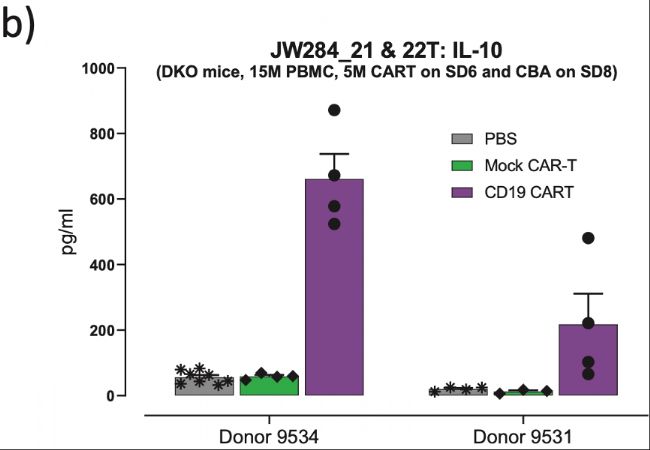
(圖4b顯示了兩個供體間相差較大的細胞因子反應(本例展示 IL-10),表明供體9531可能從CAR T療法中獲益,而沒有廣泛的毒性。WB:全血;SP:脾臟))
體內模型相對于體外方法的一個顯著優勢是:可以模擬導致復雜表型(如臨床表現和體重下降)的復雜多器官反應。
例如,在檢查前兩張圖中相同研究的體重數據時,我們看到體重的顯著差異與細胞因子水平一致。這一數據體現出通過人源化平臺檢測細胞因子反應對小鼠健康狀況的整體影響,對于體內測試評估CAR T療法的整體價值,而這也是在體外或非人源化平臺上無法實現的地方。
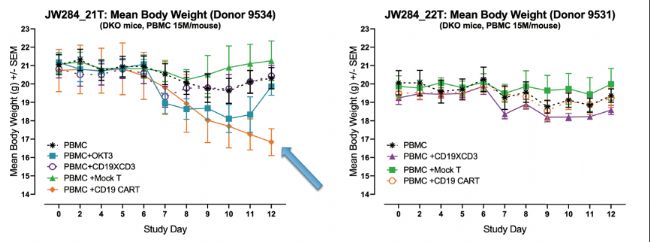
(圖5:來自供體9534(左)或9531(右)的人源化細胞植入hu-PBMC-NSG小鼠的平均體重。每種療法的符號顯示在各圖左下角。值得注意的是,植入供體9534人源化細胞并且采用CD19 CAR T療法的小鼠顯示出CRS導致的痛苦跡象(箭頭))
人源化系統
使用人源化系統可將功能完善的人免疫系統與人源靶點結合起來,提供更具預測性的數據,更好地反映在一個獨特的人類群體中所觀測到的多樣性和差異性。
有關使用人源化小鼠平臺進行抗體藥代動力學、療效和毒性研究的更多信息,請訪問以下資源或聯系杰克森實驗室專家:
人源化小鼠:
https://resources.jax.org/humanized-mice
CRS體內檢測:
https://resources.jax.org/cres
FcRn平臺和藥代動力學研究:
https://resources.jax.org/fcrn

(圖4b顯示了兩個供體間相差較大的細胞因子反應(本例展示 IL-10),表明供體9531可能從CAR T療法中獲益,而沒有廣泛的毒性。WB:全血;SP:脾臟))
體內模型相對于體外方法的一個顯著優勢是:可以模擬導致復雜表型(如臨床表現和體重下降)的復雜多器官反應。
例如,在檢查前兩張圖中相同研究的體重數據時,我們看到體重的顯著差異與細胞因子水平一致。這一數據體現出通過人源化平臺檢測細胞因子反應對小鼠健康狀況的整體影響,對于體內測試評估CAR T療法的整體價值,而這也是在體外或非人源化平臺上無法實現的地方。

(圖5:來自供體9534(左)或9531(右)的人源化細胞植入hu-PBMC-NSG小鼠的平均體重。每種療法的符號顯示在各圖左下角。值得注意的是,植入供體9534人源化細胞并且采用CD19 CAR T療法的小鼠顯示出CRS導致的痛苦跡象(箭頭))
人源化系統
使用人源化系統可將功能完善的人免疫系統與人源靶點結合起來,提供更具預測性的數據,更好地反映在一個獨特的人類群體中所觀測到的多樣性和差異性。
有關使用人源化小鼠平臺進行抗體藥代動力學、療效和毒性研究的更多信息,請訪問以下資源或聯系杰克森實驗室專家:
人源化小鼠:
https://resources.jax.org/humanized-mice
CRS體內檢測:
https://resources.jax.org/cres
FcRn平臺和藥代動力學研究:
https://resources.jax.org/fcrn

Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





