新冠靶點新視角二: 跨膜蛋白酶ADAM17和TMPRSS2
新型冠狀病毒目前在中國雖然得到了有效控制,但在全世界范圍卻愈演愈烈,科學家們對新型冠狀病毒以及由此引發的新型肺炎的研究仍然緊張地進行著。血管緊張素轉換酶2(ACE2)受體作為SARS-CoV-2感染細胞的“幫兇”成為了科研人員關注的熱點,不過研究發現新型冠狀病毒進入宿主細胞過程中,除了ACE2,很有可能還需要兩種跨膜蛋白酶:可以切割ACE2的蛋白酶ADAM17和參與ACE2與SARS-CoV-2膜融合過程的TMPRSS2,因此研究它們的作用對于我們理解新冠病毒感染機制以及藥物研發也是具有實際意義的。
TMPRSS2
絲氨酸蛋白酶在很多生理和病理過程中起著關鍵的作用,比如參與蛋白質的分解代謝、凝血、細胞生長和遷移、組織發育、腫瘤生長和轉移等。TMPRSS2是絲氨酸蛋白酶的成員,它的結構非常有趣,擁有單跨膜結構域,胞外主要由II型跨膜蛋白LDL的A類受體LDLRA、富含半胱氨酸的清道夫受體SRCR和絲氨酸蛋白酶結構域構成。值得注意的是,人TMPRSS2在前列腺、結腸、胃和唾液腺中表達,根據小鼠胚胎和成年組織的原位雜交分析表明,小鼠的TMPRSS2在胃腸道、泌尿生殖道和呼吸道上皮細胞中也均有表達,說明TMPRSS2在小鼠和人體內的表達分布非常的相似。TMPRSS2-ERG融合基因是一種受雄激素調控的基因,可在50%的前列腺癌患者中檢測到,因此TMPRSS2-ERG可作為前列腺癌的一種診斷標志。
那么TMPRSS2與病毒又有何關聯呢?2019年1月,Naoko Iwata-Yoshikawa 等人發表的研究表明,TMPRSS2可激活高致病性人冠狀病毒的突觸蛋白,例如引起嚴重急性呼吸綜合征的冠狀病毒SARS-CoV和引起中東呼吸綜合征的冠狀病毒MERS-CoV,在體外,TMPRSS2的活化可誘導病毒與細胞膜融合。實驗表明,TMPRSS2的缺乏減弱了病毒在小鼠氣道內的傳播和肺部病理的嚴重程度。早在2011年,德國病毒研究所Ilona Glowacka等人評估了SARS-CoV 的S蛋白是否被TMPRSS2蛋白水解,用WB實驗結果分析顯示,SARS S蛋白被TMPRSS2切割成幾個片段,順式切割導致SARS S片段釋放到細胞上清液中,抑制抗體介導的中和反應,反式裂解活化SARS S蛋白,使其與靶細胞融合。說明TMPRSS2可能通過減少中和抗體對病毒的識別并激活細胞與病毒之間的融合,促進病毒的傳播和發病。Stephanie Bertram等人揭示了TMPRSS2和HAT(histone acetyltransferase 組蛋白乙酰轉移酶)可共同激活hCoV-229E病毒的棘突蛋白S,驅動S與靶細胞的融合。此外,也有證據表明,通過TMPRSS2激活的229E-S可免受IFITM蛋白(在《新冠病毒靶點的預測和分析》一文中已提到)的抑制,因此說明hCoV-229E可以采用蛋白酶的途徑來確保其在宿主細胞中的活性,這也為抗病毒干擾的研究提供了新思路。
對于MERS冠狀病毒來說,TMPRSS2也充當了重要的角色,研究認為,冠狀病毒進入細胞有兩種途徑,一是細胞表面由TMPRSS2介導,另一方面在核內由組織蛋白酶L介導。Stefanie Gierer等人發現TMPRSS2和組織蛋白酶B和L可以激活hCoV-EMC,與靶細胞融合。因此TMPRSS2和組織蛋白酶成了控制hCoV-EMC的潛在靶標。在流感病毒的研究中,也有相當一部分研究者發現,TMPRSS2可以增加宿主的易感性,例如TMPRSS2在A型流感病毒(IAV)血凝素(HA)蛋白的蛋白水解激活中起重要作用,TMPRSS2促進H7N9和季節性流感病毒在體內的復制,是H7N9和H1N1病毒引起的小鼠呼吸道感染疾病的關鍵因子。
2014年,Adeline Heurich等再一次證明了TMPRSS2和HAT在冠狀病毒中的作用,他們發現,這兩種酶可以裂解并激活SARS-CoV的刺突蛋白spike進行膜融合,另外,這些酶還裂解SARS冠狀病毒受體ACE2,文獻中提到,ACE2的氨基酸序列697-716中的精氨酸殘基和賴氨酸殘基對于TMPRSS2和HAT的切割至關重要。TMPRSS2的表達增加了細胞對可溶性SARS-S碎片的攝取,同時,該研究還發現,金屬蛋白酶ADAM17與TMPRSS2在結合ACE2方面存在競爭關系,那么接下來,我們來了解一下ADAM17這個蛋白酶。
ADAM17
AMAM17是一種參與多種蛋白質胞外域脫落的跨膜金屬蛋白酶,具有黏附和蛋白水解特性,它可以使腫瘤壞死因子-α(TNF-α)前體轉化為可溶性的TNF-α。除了剪切TNF-α,該蛋白酶還在許多其他底物的加工中起作用,比如細胞粘附分子、細胞因子、生長因子受體以及表皮生長因子受體(EGFR),在Notch信號通路的激活中也起著重要作用。
那么,ADAM17與病毒感染有什么關系呢?Inoue 和Wang等分別在2007年和2008年提出了SARS-CoV可以通過網格蛋白依賴和非依賴兩種形式進入靶細胞。該研究指出,內毒素、IL-1β或TNF-α等可以刺激ACE2在膜上脫落,釋放出具有催化活性的胞外結構域,而這個脫落過程是由ADAM17介導的,這可能與SARS-CoV進入宿主細胞復制有關,實驗證明,用ADAM17的抑制劑處理細胞,會抑制SARS-CoV在細胞中的復制。
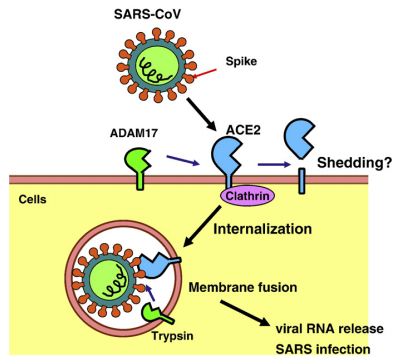
ACE2的翻譯后修飾、內化和脫落。SARS冠狀病毒(SARS-CoV)與ACE2結合并內化,以Clathrin依賴方式進入宿主細胞。(引自Keiji Kuba et al, 2010)
宿主細胞蛋白酶在SARS-CoV感染中的作用不僅局限于對S蛋白的裂解,研究表明,ACE2由宿主蛋白酶進行水解加工的過程對SARS-CoV進入細胞和發病機理起著重要作用。而SARS-S與ACE2的結合,觸發了ADAM17對ACE2的切割,有助于ACE2脫落到血管內皮細胞中,促進SARS-CoV進入細胞。在小鼠模型中,ACE2的表達可以防止肺損傷,病毒S蛋白誘導ADAM17切割ACE2在膜上脫落可能是促進SARS發病的一個重要原因。上文中講到,ADAM17與TMPRSS2在結合ACE2方面存在競爭關系,研究證明,TMPRSS2的表達可以抑制由ADAM17介導的SARS-S脫落。
除了病毒感染,ADAM17本身還有哪些功能呢?研究表明,ADAM17能夠介導糖尿病和心肌病,可以通過TGF-β/Smad通路促進胃癌的發展,可以介導ACE2膜上脫落調節心血管功能,通過調控Hippo信號通路介導人腦膠質瘤細胞的增殖和遷移,以及在乳腺癌、前列腺癌、肺纖維化、宮頸鱗癌等各項研究中都發揮著重要功能。對于ADAM17在新型冠狀病毒中有怎樣的作用?它會對病毒的入侵和復制產生怎樣的影響?我們還需要進一步的科學研究進行驗證。
綜上看來,病毒非常強大并且聰明靈活,它能夠巧妙地利用我們宿主的細胞和蛋白去滋養自身。了解它的策略,我們對抗病毒藥物的開發方向就更明確了。
參考文獻:
1. Lin BY, Ferguson C, White JT et al. Prostate-localized and androgen-regulated expression of the membrane-bound serine protease TMPRSS2. Cancer Res. 1999.
2. Bond JS. Plasma membrane proteases: introductory remarks. BBA 1991.
3. Carolin Taunow, Geraldine Engels, Annika Arendt et al, TMPRSS2 is a host factor that is essential for pneumotropism and pathogenicity of H7N9 influenza A virus in mice. JVI. 2014.
4. Kouju Sakai, Tsuyoshi Sekizuka, Yasushi Ami et al. A mutant H3N2 influenza virus uses an alternative activation mechanism in TMPRSS2 knockout mice by loss of an oligosaccharide in the hemagglutinin stalk region. JVI. 2015.
5. Kouji Sakai, Yasushi Ami, Maino Tahara et al. The host protease TMPRSS2 plays a major role in in vivo replication of emerging H7N9 and seasonal influenza viruses. JVI. 2014.
6. Bastian Hatesuer, Stephanie Bertram, Nora Mehnert et al. Tmprss2 is essential for influenza H1N1 virus pathogennesis in mice. Plos pathogens. 2013.
7. Ariane Paoloni-Giacobino, Haiming Chen, Manuel C. Peitsch et al. Cloning of the TMPRSS2 gene, which encodes a novel serine protease with transmembrane, LDLRA, and SRCR Domains and maps to 21q22.3. Genomics. 1997.
8. Ilona Glowacka, Stephanie Bertram, Marcel A. Muller et al. Evidence that TMPRSS2 activates the severe anute respiratory syndrome coronavirus spike protein for membrane fusion and reduces viral control by the humoral immune response. Journal of Virology. 2011.
9. Markku H. Vaarala, Katja S. Porwari et al. Expression of transmembrane serine protease TMPRSS2 in mouse and human tissues. Journal of pathology. 2001.
10. Zhongshan Cheng, Jie Zhou, Kelvin Kai-Wang To et al. Identification of TMPRSS2 as a susceptibility gene for severe 2009 pandemic A(H1N1) infuenza and A(H7N9) influenza. Journal of Investigative Dermatology. 2015.
11. Manon Laporte and Lieve Naesens. Airway proteases: an emerging drug target for influenza and other respiratory virus infections. Current opinion in virology. 2017.
12. Kazuya Shirato, Mlyuki Kawase, Shutoku Matsuyama. Middle east respiratory syndrome coronavirus infection mediated by the transmembrane serine protease TMPRSS2. JVI. 2013.
13. Stephanie Bertram, Ronald Dijkman, Matthias Habjan et al. TMPRSS2 activates the human coronavirus 229E for cathepsin-independent host cell entry and is expressed in viral target cells in the respiratory epithelium. JVI. 2013.
14. Stefanie Glerer, Stephanie Bertram, Granziska Kaup et al. The spike protein of the emerging betacoronavirus EMC uses a novel coronavirus receptor for entry, can be activated by TMPRSS2, and is targeted by neutralizing antibodies. JVI. 2013.
15. Shutoku Matsuyama, Noriyo Nagata, Kazuya Shirato et al. Efficient antivation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. Journal of virology. 2010.
16. Eva Bottcher, Tatyana Matrosovich, Michaela Beyerle et al, Proteolytic activation of influenza viruses by serine proteases TMPRSS2 and HAT from human airway epithelium. Journal of virology. 2006.
17. Naoko lwata-Yoshikawa, Tadashi Okamura, Yukiko Shimizu et al. TMPRSS2 contributes to virus spread and immunopathology in the airways of murine models after coronavirus infection. Journal of virology. 2019.
18. Adeline Heurich, Heike Hofmann-Winkler, Stefanie Gierer et al. TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein. JVI. 2014.
19. Inoue, Y., Tanaka, N., Tanaka, Y., Inoue, S., Morita, K., Zhuang, M., Hattori, T., & Sugamura, K. Clathrin-dependent entry of severe acute respiratory syndrome coronavirus into target cells expressing ACE2 with the cytoplasmic tail deleted. J Virol. 2007.
20. Wang, H., Yang, P., Liu, K., Guo, F., Zhang, Y., Zhang, G., & Jiang, C. SARS coronavirus entry into host cells through a novel clathrin- and caveolaeindependent endocytic pathway. Cell Res. 2008.
21. Keiji Kuba, Yumiko Imai, Takayo Ohto-Nakanishi and Josef M. Penninger. Trilogy of ACE2: A peptidase in the renin-angiotensin system, a SARS receptor, and a partner for amino acid transporters. Pharmacology & Therapeutics. 2010.





