活細胞成像揭秘免疫抑制:創傷后感染的新突破
一、研究思路
核心目標
探究創傷釋放DANGER信號(如線粒體DNA(mtDNA)、線粒體形式肽(mtFP))如何通過激活G蛋白受體激酶2 (GRK2) 抑制中性粒細胞功能,導致創傷后感染風險增加。
技術路線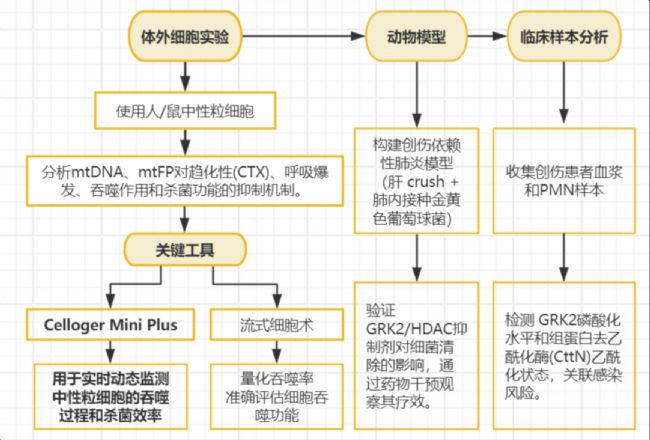
二、核心結論
1. mtDNA與mtFP的作用機制
- mtDNA:
- 通過 TLR9 非經典途徑激活GRK2,抑制 F-actin聚合和CTTN乙酰化,導致中性粒細胞 趨化性喪失和吞噬功能下降。
- GRK2抑制劑(如Paroxetine) 或 HDAC抑制劑(Valproate) 可恢復功能。
- mtFP:
- 通過 GPCR(如FPR1) 經典途徑激活GRK2,誘導GPCR內化,抑制趨化性。
2. GRK2的雙重調控路徑
- 經典路徑:mtFP → GPCR內化 → GRK2磷酸化 → β-arrestin介導信號終止。
- 非經典路徑:mtDNA → TLR9 → GRK2磷酸化 → HDAC6激活 → CttN去乙酰化 → 抑制F-actin聚合。
3. 臨床相關性
- 創傷患者血漿 mtDNA水平和PMN pGRK2表達 顯著升高,且與感染風險正相關。
三、研究意義
1. 機制創新
- 揭示 DANGER信號通過GRK2雙通路(GPCR依賴性和TLR9非依賴性) 抑制中性粒細胞功能的分子機制。
- 提出 GRK2/HDAC雙重抑制是恢復免疫功能的潛在策略。
2. 臨床轉化
- Paroxetine(GRK2抑制劑) 和 Valproate(HDAC抑制劑) 的聯合應用可有效降低創傷后感染風險,為開發新型抗感染藥物提供依據。
四、Celloger Mini Plus 的詳細應用
實驗設計
1. 吞噬功能檢測
- 樣本:人/鼠中性粒細胞與 pH-SA(pHrodo Green S. aureus Bioparticles)共孵育。
- 處理組:
- mtDNA/mtFP預處理組;
- GRK2抑制劑(Paroxetine)或HDAC抑制劑(Valproate)干預組。
- 對照組:無處理組或使用 CQ(氯喹) 阻斷內吞。
2. 成像參數
- 儀器:Celloger Mini Plus + EVOS Cell Imaging System。
- 時間點:動態監測 15分鐘 內的吞噬過程。
- 分辨率:明場成像(觀察細胞形態)+ 熒光成像(pHrodo Green信號)。
3. 數據分析
- 殺菌效率:
- 使用 Celloger Mini Plus 檢測活菌比例(圖1A);
- 補充平板計數法驗證結果一致性。
- 吞噬率:通過流式細胞術量化熒光陽性細胞比例(圖1B/C)。
關鍵結果
- mtDNA抑制吞噬:
- 中性粒細胞對S. aureus的吞噬率顯著下降;
- Valproate或Paroxetine預處理 可恢復吞噬功能。
- 動態成像證據:
- mtDNA處理組的中性粒細胞無法有效攝入熒光標記的細菌(圖1C,紅色箭頭示未吞噬顆粒)。
圖1.VAL(丙戊酸)和 PAR(帕羅西汀)能夠挽救 DAMP(損傷相關分子模式)抑制的 PMN(中性粒細胞)吞噬和殺傷能力。
五、總結
本研究通過 Celloger Mini Plus 實時動態監測中性粒細胞的吞噬行為,揭示了創傷后DANGER信號通過GRK2/HDAC通路抑制免疫功能的分子機制,并為臨床防治創傷后感染提供了 雙靶點治療策略(Paroxetine + Valproate)。該技術的應用為研究免疫細胞動態過程和疾病機制提供了重要工具。
為什么選擇 Celloger Mini Plus?
核心目標
探究創傷釋放DANGER信號(如線粒體DNA(mtDNA)、線粒體形式肽(mtFP))如何通過激活G蛋白受體激酶2 (GRK2) 抑制中性粒細胞功能,導致創傷后感染風險增加。
技術路線

二、核心結論
1. mtDNA與mtFP的作用機制
- mtDNA:
- 通過 TLR9 非經典途徑激活GRK2,抑制 F-actin聚合和CTTN乙酰化,導致中性粒細胞 趨化性喪失和吞噬功能下降。
- GRK2抑制劑(如Paroxetine) 或 HDAC抑制劑(Valproate) 可恢復功能。
- mtFP:
- 通過 GPCR(如FPR1) 經典途徑激活GRK2,誘導GPCR內化,抑制趨化性。
2. GRK2的雙重調控路徑
- 經典路徑:mtFP → GPCR內化 → GRK2磷酸化 → β-arrestin介導信號終止。
- 非經典路徑:mtDNA → TLR9 → GRK2磷酸化 → HDAC6激活 → CttN去乙酰化 → 抑制F-actin聚合。
3. 臨床相關性
- 創傷患者血漿 mtDNA水平和PMN pGRK2表達 顯著升高,且與感染風險正相關。
三、研究意義
1. 機制創新
- 揭示 DANGER信號通過GRK2雙通路(GPCR依賴性和TLR9非依賴性) 抑制中性粒細胞功能的分子機制。
- 提出 GRK2/HDAC雙重抑制是恢復免疫功能的潛在策略。
2. 臨床轉化
- Paroxetine(GRK2抑制劑) 和 Valproate(HDAC抑制劑) 的聯合應用可有效降低創傷后感染風險,為開發新型抗感染藥物提供依據。
四、Celloger Mini Plus 的詳細應用
實驗設計
1. 吞噬功能檢測
- 樣本:人/鼠中性粒細胞與 pH-SA(pHrodo Green S. aureus Bioparticles)共孵育。
- 處理組:
- mtDNA/mtFP預處理組;
- GRK2抑制劑(Paroxetine)或HDAC抑制劑(Valproate)干預組。
- 對照組:無處理組或使用 CQ(氯喹) 阻斷內吞。
2. 成像參數
- 儀器:Celloger Mini Plus + EVOS Cell Imaging System。
- 時間點:動態監測 15分鐘 內的吞噬過程。
- 分辨率:明場成像(觀察細胞形態)+ 熒光成像(pHrodo Green信號)。
3. 數據分析
- 殺菌效率:
- 使用 Celloger Mini Plus 檢測活菌比例(圖1A);
- 補充平板計數法驗證結果一致性。
- 吞噬率:通過流式細胞術量化熒光陽性細胞比例(圖1B/C)。
關鍵結果
- mtDNA抑制吞噬:
- 中性粒細胞對S. aureus的吞噬率顯著下降;
- Valproate或Paroxetine預處理 可恢復吞噬功能。
- 動態成像證據:
- mtDNA處理組的中性粒細胞無法有效攝入熒光標記的細菌(圖1C,紅色箭頭示未吞噬顆粒)。

圖1.VAL(丙戊酸)和 PAR(帕羅西汀)能夠挽救 DAMP(損傷相關分子模式)抑制的 PMN(中性粒細胞)吞噬和殺傷能力。
本研究通過 Celloger Mini Plus 實時動態監測中性粒細胞的吞噬行為,揭示了創傷后DANGER信號通過GRK2/HDAC通路抑制免疫功能的分子機制,并為臨床防治創傷后感染提供了 雙靶點治療策略(Paroxetine + Valproate)。該技術的應用為研究免疫細胞動態過程和疾病機制提供了重要工具。
為什么選擇 Celloger Mini Plus?
- 動態成像,細節無遺
傳統方法只能“死后分析”,而 Celloger Mini Plus 讓你“活捉”細胞行為。明場看形態,熒光測功能,吞噬效率、殺菌能力一目了然。 - 高效實驗,省時省力
15分鐘內完成動態監測,搭配流式細胞術驗證,數據可靠又快速。無論是基礎研究還是藥物篩選,它都能加速你的發現。 - 專業級表現,觸手可及
從中性粒細胞的 F-actin 聚合到細菌清除效率,Celloger Mini Plus 的成像結果直接支撐了 GRK2/HDAC 雙通路機制的提出,專業度毋庸置疑。 - 科研轉化新引擎
這項研究不僅解鎖了免疫抑制的秘密,還為抗感染藥物開發指路。而這一切,離不開 Celloger Mini Plus 的精準助力。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





