代謝功能障礙相關脂肪性肝炎MASH的介紹及相關常用小鼠模型匯總
什么是MASH
代謝功能障礙相關脂肪性肝炎(metabolic dysfunction-associated steatohepatitis,MASH,原稱為NASH)是一種與代謝紊亂相關的肝臟疾病。其特征是肝臟中脂肪的異常積累,伴隨著炎癥和肝細胞損傷,這種炎癥和損傷可能導致肝纖維化、肝硬化、肝衰竭甚至死亡[1-3]。
目前,在全球范圍,已經有超1億例MASH患者。我們迫切需要闡明潛在的治療靶點并開發有效的藥物治療方法。據預測,2030年全球MASH藥物市場可能達到322億美元。
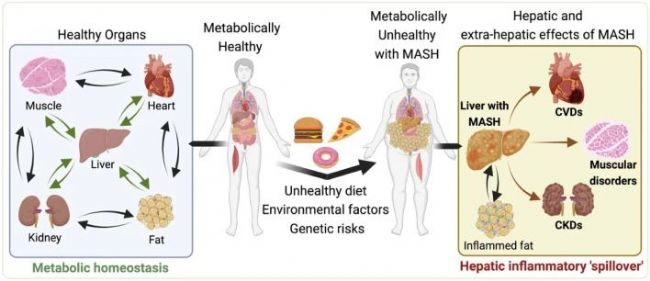
Fig.1 Systemic Impacts of MASLD and MASH[4].
MASH引起的肝臟疾病進展
脂肪肝的形成:
MASH的最初階段通常是脂肪肝。雖然脂肪肝本身可能不會引起嚴重的肝損傷,但它為更嚴重的肝病提供了基礎。
炎癥和肝細胞損傷:
隨著疾病的發展,脂肪肝可能進展為肝炎。這一階段的特點是肝臟中發生炎癥和肝細胞損傷,同時可能伴隨著肝功能輕微下降。炎癥和損傷是由肝臟中積累的脂肪導致的,這種狀況如果不加以控制,可能會導致更嚴重的肝病。
纖維化與肝硬化:
持續的炎癥和損傷會導致肝臟產生過多的瘢痕組織,這一過程被稱為纖維化。肝纖維化這是一種肝功能嚴重受損的狀態,會顯著增加肝衰竭和肝癌的風險。
肝癌風險的增加:
在MASH發展的晚期階段,持續的肝損傷和纖維化導致其發展為肝癌的風險顯著增加,需要盡早發現和治療。
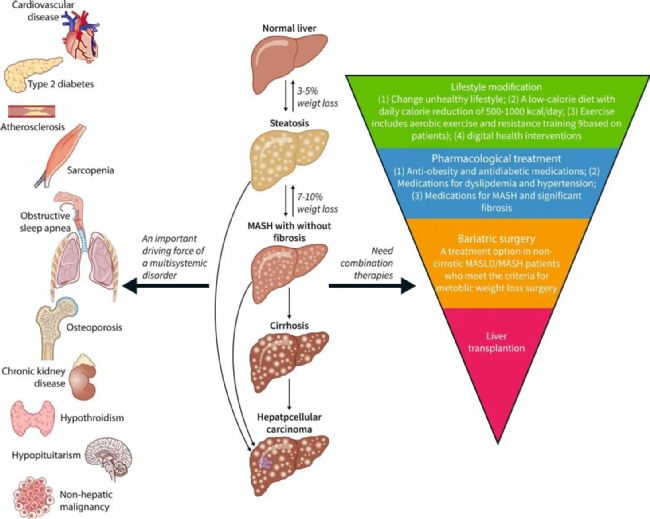
Fig.2 MASLD as an important driving force of multisystemic disorders and its management[5].
MASH的主要病理特征
糖尿病、肥胖和高脂血癥是促使MASH發生發展的重要因素。研究表明,MASH發病機制較為復雜,胰島素抵抗、氧化應激、炎癥反應和脂質代謝異常等多個環節均與之相關[6]。
脂質過度積累:
當出現胰島素抵抗時,脂肪組織中脂肪分解的過度激活會增加循環中游離脂肪酸(FFAs)的水平,最終促進脂肪在肝臟中沉積,導致脂肪肝。此外,攝入過量碳水化合物或部分由胰島素抵抗條件下肝臟脂肪生成的轉錄調控紊亂會促進肝臟中的脂肪的新生合成,其中固醇調節元件結合蛋白1c(SREBP1c)和碳水化合物調節元件結合蛋白(ChREBP)是催化脂肪生成的兩個重要轉錄因子,是影響脂肪變性發展為MASH的關鍵因素。過量的膽固醇會明顯加劇細胞毒性以及肝細胞、免疫細胞和造血干細胞的促炎和促組織壞死作用。
免疫細胞浸潤:
脂質的過度積累會破壞肝細胞的正常功能,引發內質網(ER)應激、線粒體功能障礙和活性氧(ROS)的產生。這些事件激活了關鍵的信號通路,包括c-Jun N端激酶(JNK)通路和NF-κB通路,從而誘發炎癥和細胞凋亡,成為MASH發展的主要驅動因素。
造血干細胞活化:
若不加以防治,MASLD可發展為不可逆的肝纖維化,甚至肝癌。在造血干細胞誘導的纖維化發展過程中,多種生長因子發揮著關鍵作用,例如TGF-β、血小板衍生生長因子(PDGF)、血管內皮生長因子(VEGF)等。此外,免疫細胞介導的肝細胞殺傷也是導致肝纖維化的原因之一,因此抑制特定趨化因子和NF-κB可減輕肝纖維化的進展。
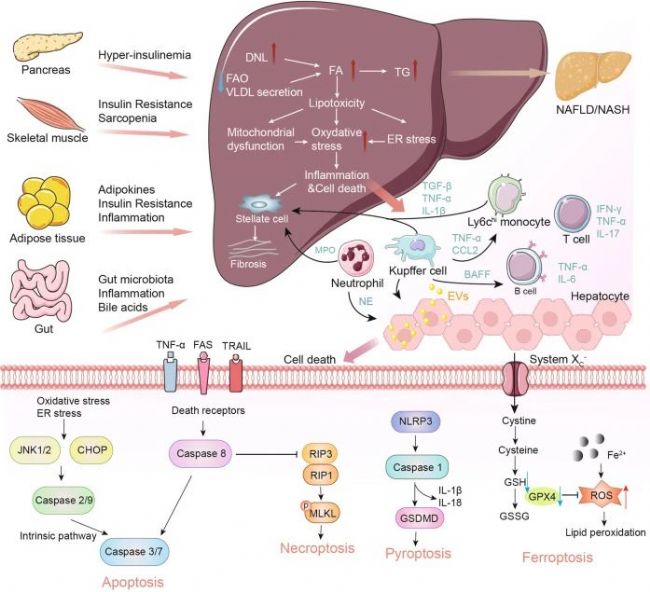
Fig.3 Schematic summary of the pathogenesis and interorgan crosstalk of MASH[7].
MASH治療藥物的研發進展
自1980年MASH這一疾病被提出以來,針對MASH的藥物研發已開展了幾十年,由于其發病機制復雜,大量的新藥研究失敗于臨床開發階段。但是鑒于其龐大的市場潛力,多種治療策略仍在進行研究。以下是幾類MASH藥物的研發進展。
法尼醇X受體(FXR)激動劑:
FXR主要在肝臟和腸道表達,其內源性配體為膽汁酸(BA)。FXR作為一種腸肝調節因子,不僅參與膽汁酸信號傳導,調控膽汁酸合成和轉運,還可以調節葡萄糖穩態、脂質和膽固醇代謝等其他生理功能以及抑制炎癥。作為BAs穩態、脂質和葡萄糖代謝的關鍵調節因子,FXR激動劑正在不斷開發并嘗試治療MAFLD。奧貝膽酸(OCA)是一款極具代表性的FXR激動劑,也是全球第一個進入III期臨床的MASH藥物。然而,奧貝膽酸會引起嚴重的瘙癢癥和血脂可逆性異常等副作用,這直接限制了其臨床用途。
胰高血糖素樣肽-1受體(GLP-1R)激動劑:
GLP-1R激動劑能夠刺激胰島素的分泌、降低胰高血糖素的分泌、延緩胃排空以及減少食欲,從而有助于體重管理,是目前常用的治療2型糖尿病的藥物,也被視為潛在的MASH治療藥物。Semaglutide(司美格魯肽)是一種GLP-1R激動劑。在MASH的治療研究中,Semaglutide顯示出了減少肝臟脂肪積累、降低炎癥水平以及改善肝纖維化的潛力。
脂肪生成抑制劑:
肝臟DNL過多會導致總膽固醇(TG)積累和脂肪毒性,從而導致肝臟脂肪變性。FA的生物合成過程包括以下步驟:糖酵解、脂肪生成、去飽和、延伸和酯化。由碳水化合物底物參與脂肪酸生物合成的關鍵酶包括檸檬酸ATP合酶(ACLY)、乙酰輔酶A(乙酰-CoA)羧化酶(ACC)和脂肪酸合成酶(FASN)等。臨床前研究顯示,ACLY抑制劑和單酰基甘油酰基轉移酶2(MGAT2)抑制劑具有治療MASH的潛力。
聯合療法:
鑒于MASH藥物開發的復雜性,針對多個靶點的聯合療法也引起了人們的興趣,因為與單一療法相比,聯合療法有望產生更多的益處和更少的副作用。例如ACC抑制劑與DGAT2抑制劑的聯合應用、幾種FXR激動劑的聯合療法、與抗糖尿病藥物聯合使用等。
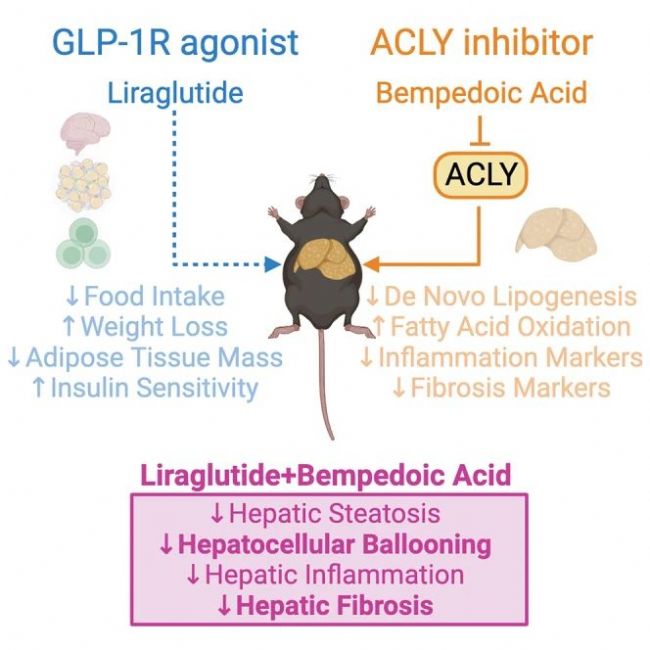
Fig.4 Combining an inhibitor of liver ACLY, bempedoic acid, and the GLP-1R agonist liraglutide reduces liver steatosis, hepatocellular ballooning, and hepatic fibrosis in a mouse model of MASH[8].
動物模型

小鼠模型在MASH(代謝功能障礙相關脂肪性肝炎)研究中扮演著至關重要的角色。通過小鼠模型,研究人員可以觀察和分析MASH的病理生理過程,包括脂肪在肝臟中的積累、炎癥反應、纖維化進程以及與代謝紊亂的相互作用,這對于疾病進展研究和治療干預有重要意義。南模生物自主研發了多種MASH小鼠模型,以滿足該部分臨床前研究需求,助力相關新藥研發:
01 GAN飲食誘導的MASH模型:
GAN(Gubra-Amylin NASH)飲食是一種經過改良、無反式脂肪的高脂高膽固醇高果糖飼料,其誘導的MASH動物模型更好地模擬了人類疾病的發生,在生理、代謝和組織病理學方面有良好的轉化性。

02 HFD+CCl4誘導的MASH模型:
HFD+CCL4模型的構建由兩部分組成:首先是高脂飲食(High-Fat Diet,HFD)單獨誘導肝脂肪變性以及炎癥反應,然后在HFD的基礎上用CCL4誘導肝纖維化。

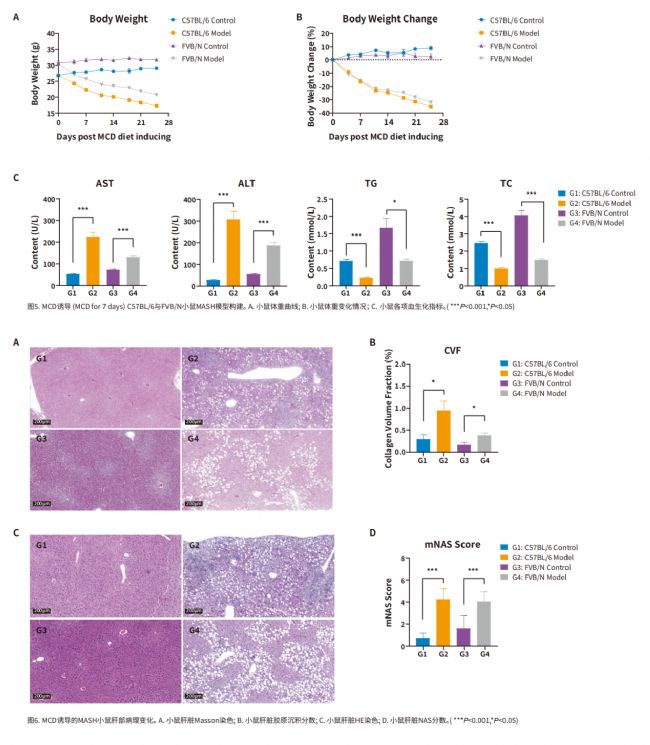
03 MCD飲食誘導的MASH模型:
甲硫氨酸和膽堿缺乏飲食(Methionine‒Choline-Deficient Diet,MCD)含有21%脂肪,63%蔗糖為主的碳水化合物,缺乏膽堿和甲硫氨酸,該飲食方案可通過引起肝臟脂類的輸出障礙從而驅動肝損傷。MCD模型在較短的時間內即可表現出MASH和肝纖維化。
南模生物深耕基因編輯領域,提供全方位模式生物服務,包括基因修飾成品模型供應、個性化模型定制、飼養繁育、表型分析、藥效評價等,滿足不同實驗室需求。若您有相關需求,歡迎撥打400-728-0660熱線或于南模生物微信公眾號在線咨詢,我們的專業團隊將竭誠為您服務!
關于我們
上海南方模式生物科技股份有限公司(Shanghai Model Organisms Center, Inc.,簡稱"南模生物"),成立于2000年9月,是一家上交所科創板上市高科技生物公司(股票代碼:688265),始終以編輯基因、解碼生命為己任,專注于模式生物領域,打造了以基因修飾動物模型研發為核心,涵蓋多物種模型構建、飼養繁育、表型分析、藥物臨床前評價等多個技術平臺,致力于為全球高校、科研院所、制藥企業等客戶提供全方位、一體化的基因修飾動物模型產品解決方案。
參考文獻
[1] GOLDBERG D,DITAH IC,SAEIAN K,et al. Changes in the prevalence of hepatitis C virus infection,nonalcoholic steatohepatitis,and alcoholic liver disease among patients with cirrhosis or liver failure on the waitlist for liver transplantation[J]. Gastroenterology,2017,152(5):1090-1099.e1.
[2] Petta S, Targher G, Romeo S, Pajvani UB, Zheng MH, Aghemo A, Valenti LVC. The first MASH drug therapy on the horizon: Current perspectives of resmetirom. Liver Int. 2024 Jul;44(7):1526-1536. doi: 10.1111/liv.15930. Epub 2024 Apr 5. PMID: 38578141.
[3] Estes, C. et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan,Spain, United Kingdom, and United States for the period 2016–2030. J. Hepatol. 69,896–904 (2018).
[4] Sandireddy R, Sakthivel S, Gupta P, Behari J, Tripathi M, Singh BK. Systemic impacts of metabolic dysfunction-associated steatotic liver disease (MASLD) and metabolic dysfunction-associated steatohepatitis (MASH) on heart, muscle, and kidney related diseases. Front Cell Dev Biol. 2024 Jul 16;12:1433857. doi: 10.3389/fcell.2024.1433857. PMID: 39086662; PMCID: PMC11289778.
[5] Zeng J, Fan JG, Francque SM. Therapeutic management of metabolic dysfunction associated steatotic liver disease. United European Gastroenterol J. 2024 Mar;12(2):177-186. doi: 10.1002/ueg2.12525. Epub 2024 Jan 9. PMID: 38193865; PMCID: PMC10954426.
[6] BUZZETTI E,PINZANI M,TSOCHATZIS EA. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism,2016,65(8):1038-1048.
[7] Xu X, Poulsen KL, Wu L, Liu S, Miyata T, Song Q, Wei Q, Zhao C, Lin C, Yang J. Targeted therapeutics and novel signaling pathways in non-alcohol-associated fatty liver/steatohepatitis (NAFL/NASH). Signal Transduct Target Ther. 2022 Aug 13;7(1):287. doi: 10.1038/s41392-022-01119-3. PMID: 35963848; PMCID: PMC9376100.
[8] Desjardins EM, Wu J, Lavoie DCT, Ahmadi E, Townsend LK, Morrow MR, Wang D, Tsakiridis EE, Batchuluun B, Fayyazi R, Kwiecien JM, Tsakiridis T, Lally JSV, Paré G, Pinkosky SL, Steinberg GR. Combination of an ACLY inhibitor with a GLP-1R agonist exerts additive benefits on nonalcoholic steatohepatitis and hepatic fibrosis in mice. Cell Rep Med. 2023 Sep 19;4(9):101193. doi: 10.1016/j.xcrm.2023.101193. PMID: 37729871; PMCID: PMC10518624.





