文獻解讀:小鼠模型助力揭示SLC35D3對肥胖及能量代謝調控新機制
作為全社會的主要健康負擔之一,肥胖一直被認為是2型糖尿病、高血壓、代謝綜合征及眾多心血管疾病的危險因素,而能量代謝異常與肥胖的進展密切相關。改善異常的能量代謝,加速能量消耗以降低肥胖,可以顯著改善心血管疾病的患病風險。脂肪組織分布于機體各個部位,是能量代謝的重要部位,也是改善肥胖的主要靶器官。深入探索脂肪組織的能量代謝調節機制對改善肥胖及相關的心血管疾病是十分重要的。
中國醫學科學院阜外醫院汪一波教授團隊通過深入研究,發現了肥胖干預的新靶點“SLC35D3”。研究團隊首次揭示了SLC35D3對脂肪組織能量代謝的調控作用,發現Slc35d3的脂肪細胞特異性敲除引起了小鼠的胰島素抵抗并抑制了脂肪組織的能量消耗,加速肥胖;而Slc35d3的脂肪細胞特異性過表達則表現出對肥胖的顯著抵抗,促進了能量代謝。既往研究已經證實,NOTCH1與能量代謝密切相關。研究團隊進一步證實SLC35D3通過與NOTCH1的細胞外結構域ECD相互作用,促進NOTCH1在內質網(endoplasmic reticulum, ER)中的駐留,從而降低了細胞膜表面的NOTCH1水平,介導白色脂肪組織棕色化和能量代謝的調節。因此,靶向SLC35D3可作為改善肥胖,加速能量消耗的新的潛在靶點。該研究以“SLC35D3 promotes white adipose tissue browning to ameliorate obesity by NOTCH signaling”為題于2023年11月23日在Nature Communications上發表,賽業生物為該研究提供了工具小鼠。
研究材料
在該研究中,研究人員使用了Slc35d3 flox/flox小鼠、LSL-Slc35d3小鼠、Adiponectin-cre小鼠、ob/ob小鼠和DIO小鼠進行動物實驗,其中Adiponectin-cre小鼠、ob/ob小鼠(產品編號:C001368)由賽業生物提供。此外,研究人員還利用了293T細胞、原代脂肪細胞、SLC35D3質粒和siRNA、AAV-shNotch1病毒、Notch1慢病毒等進行了相關表型和分子機制研究。
研究方法
本研究采用多種實驗技術手段,包括轉錄組RNA測序、原位雜交實驗、免疫共沉淀、Western blots、RT-qPCR、免疫熒光、原代細胞培養、表面等離子體共振等實驗。發現穩定小膠質細胞胞膜上的NKA很可能成為治療應激性焦慮癥的新策略。
技術路線
01 研究人員發現Slc35d3在肥胖小鼠脂肪組織中表達降低
02 Slc35d3脂肪組織敲除小鼠表型研究
03 Slc35d3脂肪組織敲入小鼠表型研究
04 Slc35d3調控Notch1通路的機制研究
研究結果
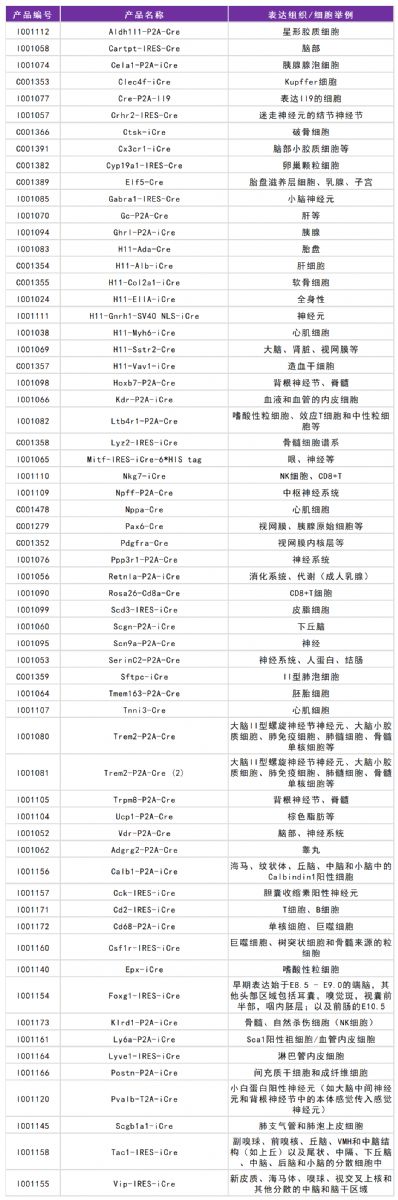
通過對小鼠不同組織的研究,研究人員首先發現了Slc35d3在脂肪組織中富集,隨后結合qPCR和WB實驗,進一步發現Slc35d3在ob/ob小鼠和DIO小鼠,其中ob/ob小鼠(產品編號:C001368)由賽業生物提供。兩種肥胖小鼠的不同脂肪組織中表達均顯著降低(圖1)。
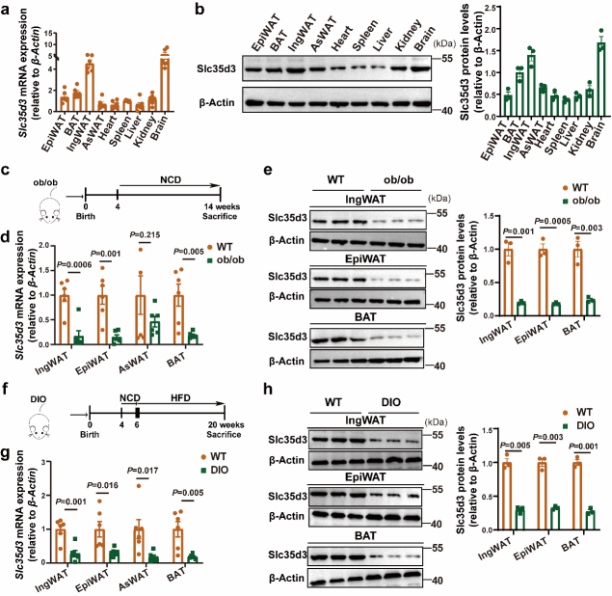
圖1 SLC35D3在肥胖小鼠的脂肪組織中表達降低[1]
Slc35d3在脂肪組織中表達水平的改變引起了研究人員極大的興趣。隨后,研究人員構建了Slc35d3脂肪組織特異性敲除小鼠,檢測Slc35d3基因敲除對小鼠表型的影響(其中造模所需Adiponectin-cre工具小鼠由賽業生物提供)。在常規飲食的喂養下,Slc35d3敲除小鼠體重顯著增加,血清脂質含量(TG,TC,FFA)水平也顯著升高,敲除小鼠的不同脂肪組織重量均顯著高于對照小鼠。葡萄糖耐量實驗和胰島素敏感性試驗證實敲除小鼠具有明顯的胰島素抵抗表型。在能量代謝方面,Slc35d3的敲除顯著抑制了小鼠的能量消耗,原代脂肪細胞的耗氧率也明顯降低,敲除鼠脂肪組織的產熱基因、線粒體代謝基因、脂解基因的表達,以及對寒冷刺激的抵抗能力也顯著低于對照小鼠。
有趣的是,Slc35d3脂肪組織特異性敲入小鼠則表現出相反的表型(其中造模所需Adiponectin-cre工具小鼠由賽業生物提供)。不管是喂養常規飲食還是高脂飲食,敲入小鼠都表現出對肥胖進展可觀的抵抗力,血清脂質含量以及不同脂肪組織的重量顯著低于對照小鼠。敲入小鼠還表現出更好的葡萄糖耐受和胰島素敏感性。能量代謝方面,Slc35d3的過表達加速了小鼠的能量消耗,原代脂肪細胞的耗氧率、脂肪組織的產熱基因、線粒體代謝基因的表達均升高。總結來說,Slc35d3的表達水平與肥胖進展以及脂肪組織的能量代謝密切相關(圖2)。
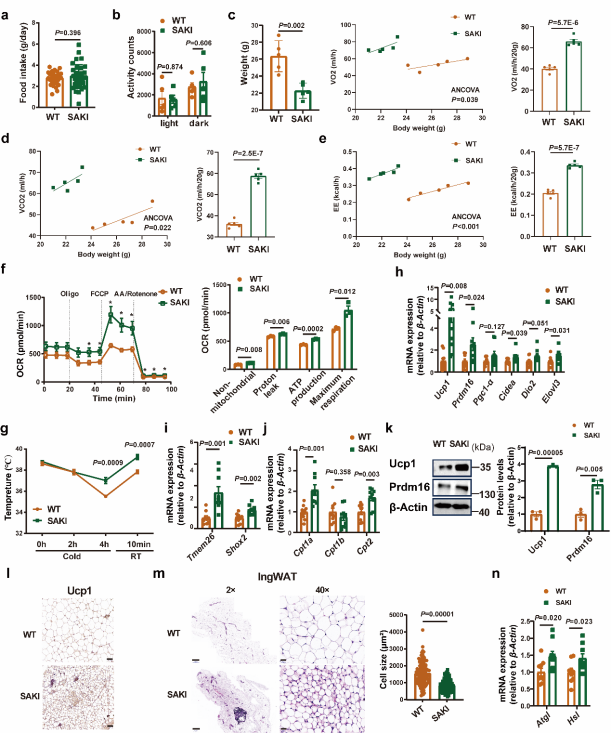
圖2 Slc35d3敲入小鼠表現出增加的能量消耗[1]
在分子調控機制上,研究人員也進行了深入探索。既往研究已經揭示了Notch通路的激活能促進肥胖,抑制脂肪組織能量消耗;而抑制Notch通路能顯著改善肥胖表型,提高能量代謝。通過對Slc35d3敲入小鼠的脂肪組織進行轉錄組測序,研究人員發現Notch信號通路在Slc35d3敲入小鼠中被顯著抑制。通過免疫熒光實驗,研究人員發現Notch1與SLC35D3存在共定位,免疫共沉淀及pull-down試驗證實SLC35D3與Notch1的細胞外結構域ECD存在直接的相互作用,該效應主要發生在細胞的內質網(ER)中。進一步的研究顯示,SLC35D3的過表達促進了Notch1在ER中的積累,而降低了細胞膜表面Notch1的水平;相反,SLC35D3的敲除則降低了ER中Notch1的水平,而極大的升高了細胞膜表面Notch1的水平。研究人員隨后在小鼠中利用原位注射AAV介導了脂肪組織中Notch1的敲低,發現小鼠的胰島素敏感性被顯著改善,脂解基因和產熱基因的表達水平也升高了,且Notch1的敲低在敲除小鼠中具有更顯著的改善效果。綜上,SLC35D3通過與ECD的相互作用,調節Notch1從內質網向細胞膜的轉運,進而調控小鼠的能量代謝和肥胖進展(圖3)。
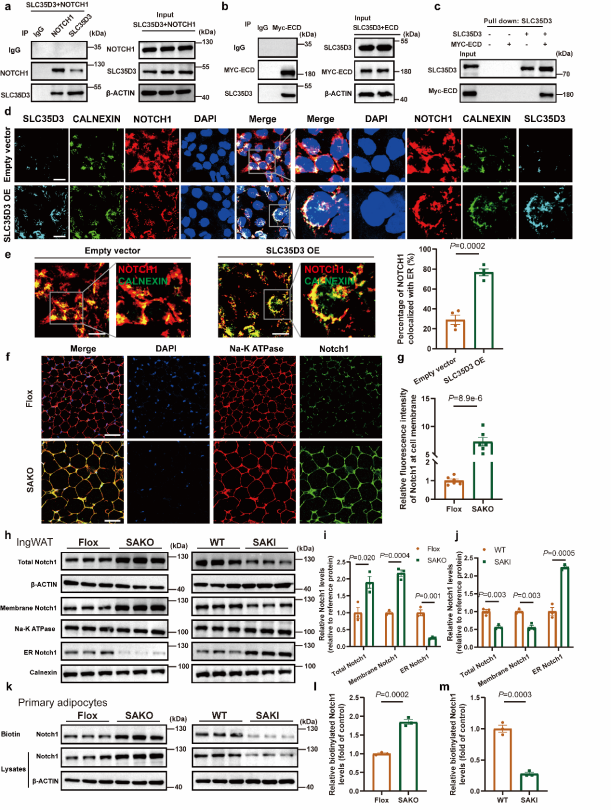
圖3 SLC35D3促進NOTCH1在內質網ER中的駐留[1]
研究結論
該研究首次揭示了Slc35d3對肥胖和能量代謝的調控作用,其通過與Notch1的相互作用調節Notch1從內質網向細胞膜的轉運,從而影響肥胖進程和能量代謝(圖4)。因此,在肥胖個體中,脂肪組織中低水平的SLC35D3可作為加速能量消耗,改善肥胖的一個新的潛在靶點。

圖4 SLC35D3調節NOTCH1從內質網向細胞膜的轉運[1]
參考文獻:
[1]Wang H, Yu L, Wang J, Zhang Y, Xu M, Lv C, Cui B, Yuan M, Zhang Y, Yan Y, Hui R, Wang Y. SLC35D3 promotes white adipose tissue browning to ameliorate obesity by NOTCH signaling. Nat Commun. 2023 Nov 23;14(1):7643. doi: 10.1038/s41467-023-43418-5. PMID: 37996411; PMCID: PMC10667520.
代謝和心血管疾病模型推薦
在代謝和心血管疾病研究領域,賽業生物的研發團隊建立了II型糖尿病(ob/ob)、HFD+CCl4誘導的MASH(NASH)、高脂飲食誘導肥胖(DIO)、動脈粥樣硬化等代謝相關的疾病模型和優質、全面的體內藥理藥效評價和體外研發服務,助力疾病研究與新藥開發。
Cre工具鼠模型構建
賽業生物藥物篩選評價小鼠模型平臺可為研究人員提供Cre工具鼠、誘導型Cre工具鼠、熒光標記模型等多類型工具鼠模型,同時提供工具鼠定制服務,助力新藥研發。本文使用的Adiponectin-cre小鼠由賽業生物提供。