文獻解讀:ILC2在對抗寄生蟲感染和組織保護方面發(fā)揮非冗余作用新發(fā)現(xiàn)
新近的一些研究表明,神經(jīng)元和免疫細(xì)胞共同合作來調(diào)節(jié)抗微生物免疫、炎癥和組織穩(wěn)態(tài)。例如,神經(jīng)元變阻器提供興奮或抑制信號,控制黏膜屏障表面II型固有淋巴細(xì)胞(ILC2)的功能。ILC2則表達(dá)神經(jīng)調(diào)節(jié)肽U(NMU)的受體NMUR1,NMU是一種膽堿能神經(jīng)肽,可刺激ILC2增殖并產(chǎn)生II型細(xì)胞因子。
然而,ILC2與適應(yīng)性淋巴細(xì)胞擁有許多共同功能。例如,它們都能產(chǎn)生II型細(xì)胞因子,釋放保護組織的雙調(diào)蛋白(AREG),在促進抗寄生蟲免疫、代謝穩(wěn)態(tài)和組織保護方面發(fā)揮著重要作用。這就引發(fā)了科學(xué)界的爭議,ILC2在體內(nèi)是執(zhí)行冗余功能還是非冗余功能?
威爾·康奈爾醫(yī)學(xué)院領(lǐng)導(dǎo)的研究團隊利用一種新的遺傳工具,證明ILC2在保護屏障組織免受寄生蟲感染以及腸道損傷和炎癥后的組織保護方面發(fā)揮著非冗余作用。這項研究成果發(fā)表在《Nature》雜志上。
研究材料與方法
在這項研究中,研究人員委托賽業(yè)生物構(gòu)建了Nmur1iCre-eGFP小鼠。這種新的遺傳工具能夠在適應(yīng)性免疫系統(tǒng)存在的情況下,以ILC2為靶點進行基因敲除。在此基礎(chǔ)上,他們又構(gòu)建了AregΔILC2小鼠,以探究ILC2來源的AREG的潛在作用。他們利用小鼠腸道感染和炎癥模型及潰瘍性結(jié)腸炎患者的腸道樣本來分析AREG的功能,并在分析過程中采用了流式分選和免疫熒光染色等技術(shù)。
技術(shù)路線
01 構(gòu)建Nmur1iCre-eGFP小鼠,實現(xiàn)ILC2的特異性靶向
02 構(gòu)建AregΔILC2小鼠,實現(xiàn)ILC2特異性的Areg敲除
03 利用小鼠腸道感染和炎癥模型來分析ILC2來源的AREG的潛在功能
04 探究神經(jīng)元產(chǎn)生的NMU是否能調(diào)節(jié)ILC2來源的AREG的功能
研究結(jié)果
1 一種新型的遺傳工具
為了描繪ILC2和適應(yīng)性淋巴細(xì)胞的不同功能,研究人員根據(jù)NMUR1在ILC2上的表達(dá)模式,開發(fā)出一種在體內(nèi)靶向ILC2的新型遺傳工具。他們委托賽業(yè)生物構(gòu)建了Nmur1iCre-eGFP小鼠,這種小鼠表達(dá)iCre重組酶和eGFP報告基因,它們位于Nmur1啟動子的下游(圖1)。他們發(fā)現(xiàn),NMUR1–eGFP報告基因僅在ILC2中高表達(dá),而在ILC1和ILC3亞群以及適應(yīng)性淋巴細(xì)胞中的表達(dá)量極低甚至沒有。
為證實這些結(jié)果,研究人員構(gòu)建了Nmur1iCre-eGFPROSA26LSL-RFP小鼠。在各種組織中,幾乎所有ILC2和ILC2前體都觀察到iCre誘導(dǎo)的RFP表達(dá),而在其他免疫細(xì)胞中只有極少的誘導(dǎo)。此外,他們還構(gòu)建了Nmur1iCre-eGFPROSA26LSL-DTR小鼠,這個品系能夠組成型表達(dá)白喉毒素受體。在注射白喉毒素后,小鼠多個組織中的ILC2幾乎被完全清除。這些數(shù)據(jù)表明,Nmur1iCre-eGFP小鼠為報告Nmur1表達(dá)和體內(nèi)多個組織中的ILC2特異性消融提供了一種新工具。
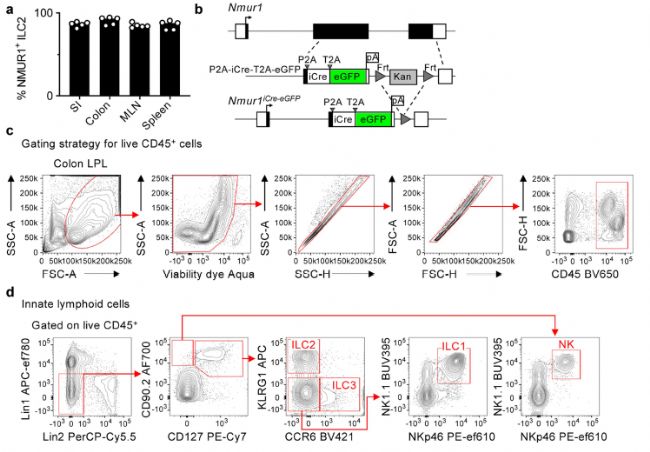
圖1 NMUR1–eGFP報告基因在ILC2中高表達(dá)[1]
2 ILC2來源的AREG發(fā)揮非冗余功能
ILC2富集于包括腸道在內(nèi)的屏障表面,通過釋放雙調(diào)蛋白(AREG)來介導(dǎo)組織修復(fù)和穩(wěn)態(tài)。為了研究ILC2來源的AREG的潛在非冗余作用,研究人員需要對Areg進行靶向敲除。考慮到只有一小部分AREG+ ILC2共表達(dá)IL-5,但大多數(shù)AREG+ ILC2也表達(dá)NMUR1,他們認(rèn)為,與Il5Cre-tdTomato(Red5)小鼠品系相比,他們認(rèn)為Nmur1iCre-eGFP小鼠能夠?qū)崿F(xiàn)ILC2中更靶向且更高效的Areg敲除。
為了驗證這一假設(shè),他們構(gòu)建了Aregfl/-小鼠,將其與Red5或Nmur1iCre-eGFP小鼠雜交,分別產(chǎn)生了AregΔRed5和AregΔILC2小鼠。對于AregΔRed5小鼠,ILC2中AREG表達(dá)量沒有明顯下降,但對于AregΔILC2小鼠,ILC2中AREG的表達(dá)幾乎完全缺失,實現(xiàn)了ILC2特異性的Areg敲除。
接下來,研究人員利用小鼠腸道感染和炎癥模型來檢驗AREG在體內(nèi)是執(zhí)行冗余還是非冗余功能。他們觀察到,在鼠鞭蟲(Trichuris muris)感染野生型小鼠后,盲腸ILC2產(chǎn)生的AREG增加,表明ILC2來源的AREG可能在促進抗寄生蟲反應(yīng)中發(fā)揮關(guān)鍵作用。與Aregfl/-對照組相比,AregΔILC2小鼠的ILC2中AREG表達(dá)量極低,而且感染后小鼠杯狀細(xì)胞的反應(yīng)程度顯著降低(圖2),這與之前的研究一致,表明AREG可調(diào)節(jié)上皮細(xì)胞反應(yīng),包括分化為杯狀細(xì)胞來分泌粘液。同時,AregΔILC2小鼠體內(nèi)的寄生蟲數(shù)量也明顯多于Aregfl/-小鼠。
考慮到TH2細(xì)胞和Treg細(xì)胞在某些情況下也能產(chǎn)生AREG,研究人員進一步分析了鼠鞭蟲感染后盲腸ILC2、Treg細(xì)胞和效應(yīng)CD4+ T細(xì)胞產(chǎn)生AREG的動力學(xué)。從數(shù)量上看,ILC2和Treg細(xì)胞是AREG的主要來源,而產(chǎn)生AREG的CD4+ T細(xì)胞只占少數(shù)。與Aregfl/-小鼠相比,AregΔCD4小鼠(CD4+ T細(xì)胞區(qū)室缺乏AREG表達(dá))在感染后的寄生蟲數(shù)量相當(dāng),這表明ILC2來源的AREG通過調(diào)節(jié)腸上皮細(xì)胞反應(yīng),在抗蠕蟲免疫中發(fā)揮著重要而非冗余的作用。
此外,ILC2也在腸道損傷后的組織保護中發(fā)揮著關(guān)鍵作用。不過,ILC2產(chǎn)生的AREG是否是促進組織保護機制所必需的,目前還不清楚。于是,研究人員將AregΔILC2小鼠暴露在DSS下以誘導(dǎo)腸道損傷和炎癥。與Aregfl/-對照組相比,AregΔILC2小鼠表現(xiàn)出更嚴(yán)重的疾病,表現(xiàn)為體重明顯下降和腸上皮損傷(圖2)。這表明在缺乏ILC2來源的AREG的情況下,組織保護反應(yīng)明顯受損,且其他細(xì)胞來源的AREG無法補償ILC2來源的AREG。由此可見,ILC2來源的AREG在非感染性腸道損傷和炎癥中介導(dǎo)了組織保護的非冗余作用。
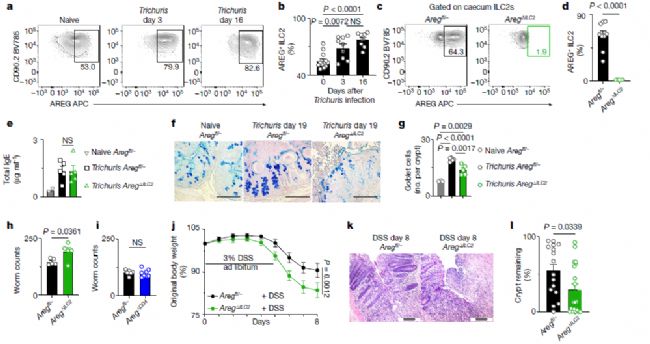
圖2 ILC2來源的AREG對清除寄生蟲和腸道損傷后的組織保護至關(guān)重要[1]
3 NMU誘導(dǎo)人類和小鼠ILC2產(chǎn)生AREG
最近的研究發(fā)現(xiàn)了多種神經(jīng)肽,它們可在屏障表面對ILC2功能進行正向或負(fù)向調(diào)節(jié),例如,NMU可促進ILC2產(chǎn)生II型細(xì)胞因子。那么,NMU是否能調(diào)節(jié)ILC2來源的AREG的非冗余組織保護功能呢?研究人員觀察到,對于暴露于DSS和鼠鞭蟲感染的小鼠,結(jié)腸內(nèi)Nmu的表達(dá)顯著增加,且Nmu的表達(dá)僅限于腸神經(jīng)元亞群。
在小鼠體內(nèi)注射NMU會導(dǎo)致ILC2產(chǎn)生的AREG增加,但不會導(dǎo)致CD4+ T細(xì)胞產(chǎn)生的AREG增加(圖3)。與此一致的是,與對照組相比,暴露于DSS的小鼠注射NMU后,上皮隱窩結(jié)構(gòu)得到改善,因此疾病嚴(yán)重程度大大減輕(圖3)。由于AregΔILC2小鼠在接受NMU處理后腸上皮結(jié)構(gòu)沒有得到改善,他們認(rèn)為NMU的組織保護作用依賴于ILC2來源的AREG。這些數(shù)據(jù)表明,炎癥誘導(dǎo)神經(jīng)元產(chǎn)生的NMU和ILC2介導(dǎo)的組織保護之間存在關(guān)聯(lián)。
最后,研究人員試圖以人類腸道炎癥為背景,看看MNU和ILC2–AREG軸之間是否存在關(guān)聯(lián)。與小鼠腸道炎癥模型中的結(jié)果一致,潰瘍性結(jié)腸炎患者腸道樣本中的NMU表達(dá)相對于健康樣本增加。而且,對于從炎癥性腸病患者腸活檢樣本中分離出的ILC2,體外NMU刺激導(dǎo)致AREG的上調(diào)(圖3)。由此可見,NMU調(diào)節(jié)的ILC2-AREG反應(yīng)是一種進化保守的組織保護機制,在腸道損傷和炎癥發(fā)生時激活。
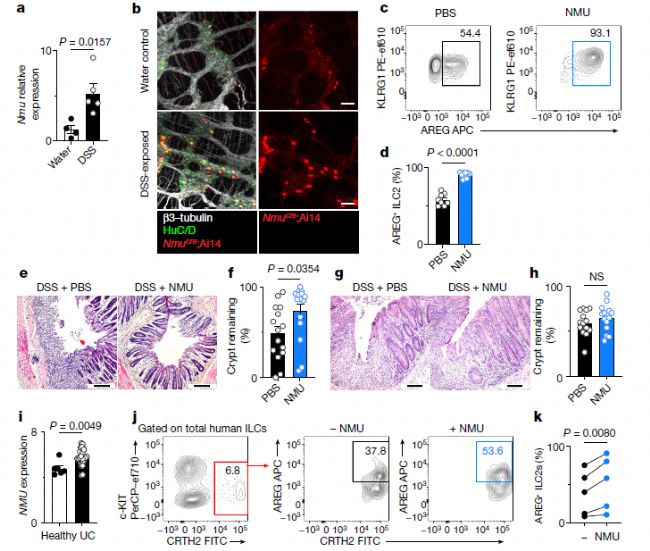
圖3 NMU介導(dǎo)了ILC2來源的AREG的非冗余組織保護功能[1]
研究結(jié)論
研究人員總結(jié)道,利用新的遺傳工具,他們證明了在適應(yīng)性免疫反應(yīng)起作用的情況下,腸道粘膜屏障的損傷會導(dǎo)致腸神經(jīng)元中NMU上調(diào),而NMU會刺激結(jié)腸ILC2產(chǎn)生AREG。通過這條由NMU調(diào)節(jié)的ILC2-AREG通路,ILC2在促進抗寄生蟲免疫以及組織保護方面發(fā)揮了重要的非冗余作用,這有望為多種感染和炎癥的治療提供新的見解。
參考文獻:
[1]Tsou, A.M., Yano, H., Parkhurst, C.N. et al. Neuropeptide regulation of non-redundant ILC2 responses at barrier surfaces. Nature 611, 787–793 (2022). https://doi.org/10.1038/s41586-022-05297-6
- 無需外部注射DT,DTA小鼠精準(zhǔn)驅(qū)動細(xì)胞條件性剔除的介紹
- 細(xì)胞條件性剔除之白喉毒素受體(DTR)小鼠在細(xì)胞功能研究中的應(yīng)用
- Nature文獻解讀:雙功能疫苗佐劑技術(shù)研發(fā)突破抗原呈遞“最后一公里”
- 小鼠模型在揭示平滑肌細(xì)胞對主動脈疾病的起源依賴性易感性中的應(yīng)用
- 利用 CRISPR/Cas9 技術(shù)構(gòu)建基因敲除小鼠的實驗流程
- 小鼠模型在揭示免疫檢查點LAG3新機制中的應(yīng)用,為精準(zhǔn)治療提供新策略
- 分子膠&PROTACs熱門靶點CRBN的介紹及其在臨床研究中的應(yīng)用
- 廣譜抗炎藥新靶點:NLRP3抑制劑的作用機制及人源化小鼠模型的介紹






