隱性遺傳病血友病致病基因介紹及相關動物模型的應用
血友病(Hemophilia)是一種X染色體連鎖的隱性遺傳性出血性疾病,主要由凝血因子Ⅷ(FⅧ,由F8基因編碼)或凝血因子Ⅸ(FⅨ,由F9基因編碼)的缺乏或功能異常引起[1]。患者常表現為關節、肌肉和深部組織出血,也可表現為胃腸道、中樞神經系統等內部臟器出血等。若反復出血,不及時治療可導致關節畸形和(或)假腫瘤形成,嚴重者可危及生命。外傷或手術后延遲性出血是本病的特點[2]。根據患者缺乏凝血因子的類型,可以分為血友病A(Hemophilia A, HEMA)(FⅧ缺乏)及血友病B(Hemophilia B, HEMB)(FⅨ缺乏)兩種類型[3]。
據《中國血友病診治報告2023》顯示,我國血友病患病率在(2.73-3.09)/10萬,其中男性患者占據主要比例,女性血友病患者極其罕見。在男性患者中,血友病A的發病率約為1/5000,血友病B的發病率約為1/25000。所有血友病患者中,血友病A占80%~85%,血友病B占15%~20%[4]。血友病的發病率沒有種族或地區差異,但由于經濟等方面的原因,血友病的患病率在不同國家甚至同一國家的不同時期都存在很大的差異。
根據WFH(世界血友病聯盟)2022年的統計數據(圖1&圖2),全球范圍內,中國血友病的患病率相對較低。然而,考慮到我國龐大的人口基數,實際上患有血友病的人數高達32638人,這使得中國成為全球擁有最多血友病患者的國家。值得注意的是,由于血友病屬于罕見病,部分患者可能未能得到正式診斷或記錄在案。因此,實際的患者數量可能會高于官方統計的數字。這進一步強調了了解血友病發病機制的重要性,以及為血友病患者及其家屬提供更多幫助的緊迫性。
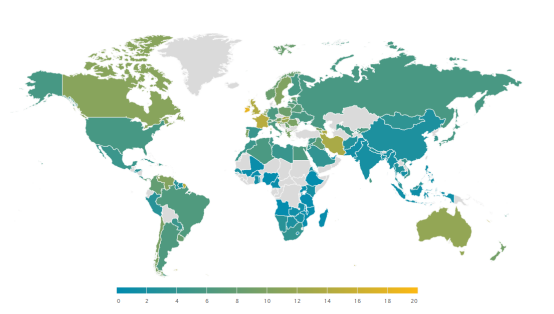
圖1 2022年血友病每10萬人患病率
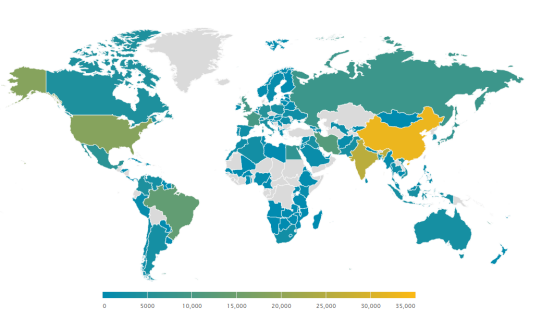
圖2 2022年血友病患者全球分布概況
致病基因

圖3 近年來血友病發生與基因突變相關性
(圖片來源:兒科血友病管理網絡(PedNet))
根據兒科血友病管理網絡(PedNet)提供的數據(圖3),我們得知在血友病患者中,86%的病例源于基因突變。這一數據揭示了血友病的分子基礎,并突顯了遺傳學在理解與治療該疾病中的核心地位。通過深入研究血友病的遺傳學機制,我們可以更好地預測疾病的發生風險,制定預防策略,并為患者提供更有效的治療方法。
F8基因與血友病A:
F8基因位于X染色體長臂末端Xq28,包含26個外顯子和25個內含子,這些區域在基因表達中起著關鍵作用。
F8基因的主要功能是編碼凝血因子VIII,這是一種關鍵的蛋白質,參與血液凝固過程。凝血因子VIII在血液凝固級聯反應中發揮重要作用,幫助防止過度出血。
與血友病A的關系:血友病A是一種遺傳性疾病,主要影響男性,因為F8基因位于X染色體上。罕見病數據中心(簡稱“RDDC”,網址:https://rddc.tsinghua-gd.org/)收錄了血友病A與F8基因突變的關系(圖4)。數據顯示,F8基因有544種突變可能導致或影響血友病A的發生。這些突變包括內含子22倒位、點突變、缺失或異常基因插入等[5,6]。這些突變會導致凝血因子VIII的合成障礙或功能異常,進而引發血友病A。
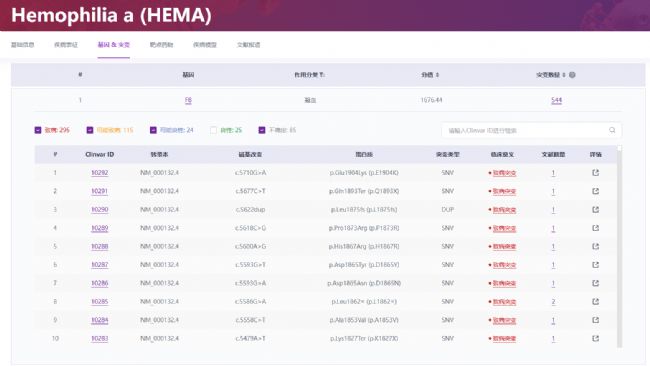
圖4 血友病A與F8基因突變密切相關
F9基因與血友病B:
F9基因位于X染色體長臂Xq26.3~27.2,包含8個外顯子、7個內含子及側翼序列。
F9基因為凝血因子IX提供指令,凝血因子IX同樣在血液凝固過程中發揮重要作用。
與血友病B的關系:根據RDDC數據庫的記錄,血友病B與F9基因的突變有著密切的關系(圖5)。目前已知,F9基因有339種不同的突變形式可能會導致或增加血友病B的風險。這些突變類型包括缺失、插入和點突變等[7,8]。當F9基因發生突變時,可能會導致凝血因子IX的合成減少或其功能出現異常,從而引發血友病B。
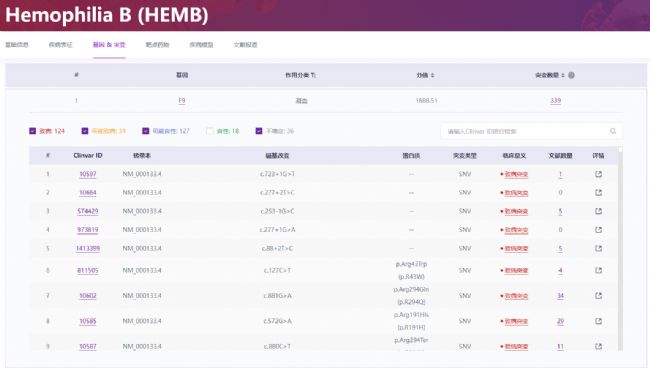
圖5 血友病B與F9基因突變密切相關
動物模型
鑒于人類與大鼠和小鼠基因的高度相似性,這兩種嚙齒類動物在血友病的遺傳學和治療研究中扮演著關鍵角色。它們的基因組結構與人類相近,因此成為理解血友病遺傳機制、測試新療法及開發治療策略的重要模型。
選擇大鼠和小鼠作為研究模型具有多重優勢:它們繁殖迅速,成本較低,且其生物學特性和生理反應近似于人類。這使得科研人員能在控制條件下進行實驗,以探究血友病的遺傳原因、病理發展過程,以及評估新治療方法的效果。
當前生物醫學實驗中常見的血友病模型小鼠主要包括:
1. 血友病A小鼠模型(F8缺陷):這種模型的F8基因被敲除或突變,導致無法正常合成F8,表現出嚴重的出血傾向,如關節出血、皮膚出血、鼻出血等,并可能伴有生長發育遲緩、貧血等癥狀。
2. 血友病B小鼠模型(F9缺陷):在此模型中,F9基因被敲除或突變,導致無法正常合成F9,同樣表現出嚴重的出血傾向及其他相關癥狀。
3. 重組凝血因子治療模型:通過導入人類凝血因子F8或F9基因,使小鼠能正常合成凝血因子,模擬血友病患者的病情。這些小鼠在接受治療后,出血傾向明顯改善,但需要定期注射以維持效果。
4. 基因編輯模型:利用CRISPR/Cas9等技術精確編輯小鼠的F8或F9基因,模擬血友病患者的遺傳變異。這些小鼠展現出與患者相似的出血傾向和癥狀,并可用于研究基因編輯技術在血友病治療中的應用。
治療前景——基因治療
血友病的治療領域正迎來顯著的突破與革新。過去,我們主要依賴于注射血漿或輸注凝血因子的傳統替代療法,這些療法既有應急式的按需治療,也有規律性的預防性治療[9]。然而,隨著生命科學技術的飛速進步,基因治療已經嶄露頭角,正逐漸成為單基因疾病治療的新潮流。
近三十年來,血友病A(HA)和血友病B(HB)在基因治療領域尤為突出,成為了推動該領域發展的模型疾病[10]。基因治療為血友病患者帶來了全新的治療可能性,因為它能夠實現凝血因子的持續內源性表達。這一創新的治療方式不僅有效消除了突破性出血和微出血的風險,還顯著減少了因合并癥和頻繁醫療干預而給患者帶來的負擔。更為重要的是,它極大地提高了患者的生活質量,為血友病患者帶來了前所未有的治療希望[11]。
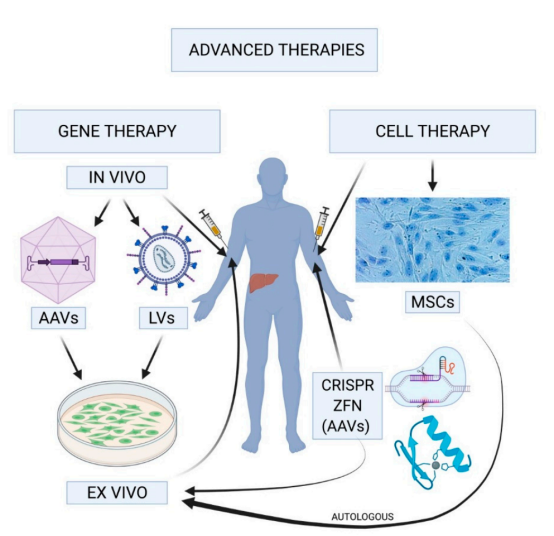
圖6 血友病基因治療工作原理[12]
圖6展示了血友病的基因治療策略,主要分為體內基因治療和體外基因治療兩大類:體內基因治療涉及將含有“治療基因”的載體,例如腺相關病毒(AAV)或慢病毒(LV),通過全身性的注射方式輸送到患者體內。這種方法直接在患者體內實施,旨在通過引入功能性基因來糾正遺傳缺陷,從而治療疾病。相比之下,體外基因治療則首先需要在體外環境中對自體或同種異體細胞進行轉染操作,這些經過基因修飾的細胞在培養基中擴增后,再被輸回至患者體內。此方法的優勢在于可以對細胞進行精確的基因編輯,并在控制的環境中驗證其安全性和有效性之后,再將其應用于患者。這兩種策略都旨在通過基因層面的干預,為血友病患者提供更為精準和持久的治療效果。通過選擇合適的策略,可以為患者提供個性化的治療方案,以達到最佳的治療效果。
根據智慧芽新藥情報庫上的統計資料,血友病A和血友病B的基因治療藥物研發領域正經歷著顯著的發展。在醫學科技不斷進步的今天,針對血友病B的F9基因,已有Etranacogene dezaparvovec和Fidanacogene elaparvovec藥物獲批上市(圖7)。
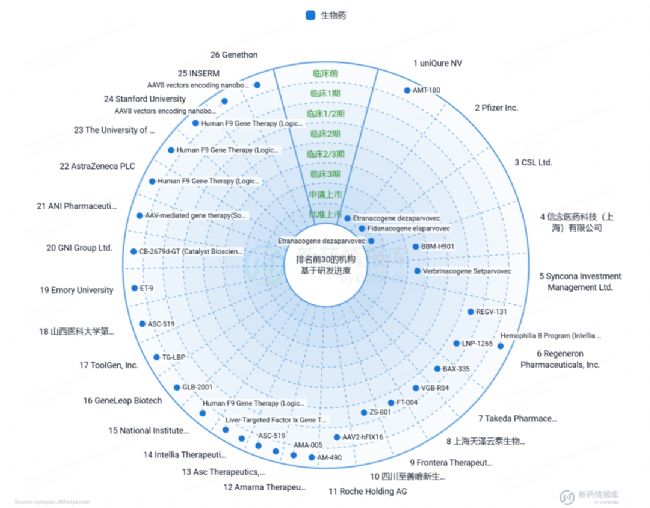
圖7 血友病B的基因治療藥物研發現狀
針對血友病A的基因治療藥物:Valoctocogene roxaparvovec已獲批上市,雖然這個藥物的靶向基因為F10(圖8)。這些進展不僅標志著科研工作者不懈的努力,也給患者帶來了新的希望。
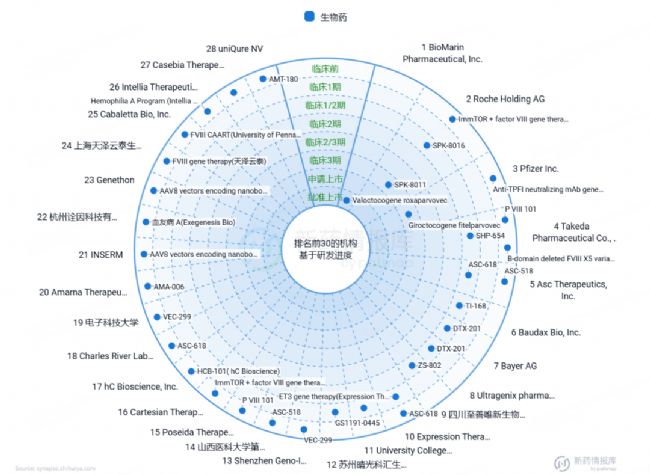
圖8 血友病A的基因治療藥物研發現狀
此外,還有近60種基因治療藥物正處于臨床或臨床前試驗階段。這些潛在療法的研發背后,是來自全球各地制藥企業的共同努力。其中,Pfizer、BioMarin等全球知名的制藥企業赫然在列,他們憑借雄厚的科研實力,為血友病的治療貢獻了重要的力量。同樣值得注意的是,多家中國藥企也在積極參與其中,如信念醫藥科技(上海)有限公司、蘇州諾潔貝生物技術有限公司、蘇州晴光科匯生物科技有限公司等。他們的參與不僅展現了國內外制藥行業對于血友病基因治療藥物開發的高度重視,也體現了中國在全球醫藥研發領域的活躍參與和貢獻。
這些成果不僅是科技進步的體現,更是對廣大血友病患者的希望之光。隨著更多的基因治療藥物進入臨床試驗階段,未來有望為血友病患者提供更多、更有效的治療選擇。同時,這也預示著血友病治療領域的研發方向正在從傳統的蛋白替代療法轉向更為前沿的基因治療技術,為全球醫藥研發領域的創新和發展注入新的活力。
賽業生物血液疾病相關模型
針對血友病研究,賽業生物構建了F8 KO、F9 KO小鼠模型,這些模型出現了凝血功能障礙等血友病相關表型,可用于研究人類血友病的遺傳機制和臨床表型,助力治療藥物的開發、篩選和評價。
除了血友病,賽業生物還開發了一系列針對血液疾病(特別是血液罕見病)的基因編輯模型,包含基因敲除、基因敲入、點突變等類型,同時,我們也可根據研究人員的需求進行定制或合作開發。
血液疾病模型推薦
|
血液疾病 |
英文名稱 |
打靶基因 |
打靶方式 |
|
血友病A |
Hemophilia A, FA |
FⅧ(F8) |
KO、CKO、Humanization (WT、MU) |
|
血友病B |
Hemophilia B, FB |
FⅨ(F9) |
KO、CKO、Humanization (WT、MU) |
|
血友病C |
Hemophilia C, FC |
FⅪ(F11) |
KO、CKO、Humanization (WT) |
|
β地中海貧血 |
β-thalassemia |
Hbb-bs+Hbb-bt |
KO |
|
先天性純紅細胞再生障礙性貧血 |
Diamond-Blackfan anemia, DBA |
Flvcr1 |
KO、CKO |
|
范可尼貧血 |
Fanconi anemia, FA |
Fanca |
CKO |
|
Usp1 |
KO、CKO |
||
|
血小板無力癥 |
Glanzmann's thrombasthenia, GT |
Itga2b |
KO、CKO、MU |
參考文獻:
[1]E. Berntorp, K. Fischer, D.P. Hart, M.E. Mancuso, D. Stephensen, A.D. Shapiro, V. Blanchette, Haemophilia, Nat Rev Dis Primers 7(1) (2021) 45.
[2]國家衛生健康委罕見病診療與保障專家委員會辦公室, 罕見病診療指南(2019 年版), (2019) 214-220.
[3]P.H. Bolton-Maggs, K.J. Pasi, Haemophilias A and B, Lancet 361(9371) (2003) 1801-9.
[4]Consensus of Chinese expert on the diagnosis and treatment of hemophilia (version 2017), Zhonghua Xue Ye Xue Za Zhi 38(5) (2017) 364-370.
[5]Y. Liu, D. Li, D. Yu, Q. Liang, G. Chen, F. Li, L. Gao, Z. Li, T. Xie, L. Wu, A. Mao, L. Wu, D. Liang, Comprehensive Analysis of Hemophilia A (CAHEA): Towards Full Characterization of the F8 Gene Variants by Long-Read Sequencing, Thromb Haemost 123(12) (2023) 1151-1164.
[6]T.J.S. Lopes, R. Rios, T. Nogueira, R.F. Mello, Prediction of hemophilia A severity using a small-input machine-learning framework, NPJ Syst Biol Appl 7(1) (2021) 22.
[7]A. Dericquebourg, M. Fretigny, N. Chatron, B. Tardy, C. Zawadzki, H. Chambost, C. Vinciguerra, Y. Jourdy, Whole F9 gene sequencing identified deep intronic variations in genetically unresolved hemophilia B patients, J Thromb Haemost 21(4) (2023) 828-837.
[8]V. Labarque, M.E. Mancuso, M. Kartal-Kaess, R. Ljung, T.S. Mikkelsen, N.G. Andersson, F8/F9 variants in the population-based PedNet Registry cohort compared with locus-specific genetic databases of the European Association for Haemophilia and Allied Disorders and the Centers for Disease Control and Prevention Hemophilia A or Hemophilia B Mutation Project, Res Pract Thromb Haemost 7(1) (2023) 100036.
[9]P.M. Mannucci, Hemophilia therapy: the future has begun, Haematologica 105(3) (2020) 545-553.
[10]B.J. Samelson-Jones, L.A. George, Adeno-Associated Virus Gene Therapy for Hemophilia, Annu Rev Med 74 (2023) 231-247.
[11]A.C. Nathwani, Gene therapy for hemophilia, Hematology Am Soc Hematol Educ Program 2019(1) (2019) 1-8.
[12]E.C. Rodríguez-Merchán, J.A. De Pablo-Moreno, A. Liras, Gene Therapy in Hemophilia: Recent Advances, Int J Mol Sci 22(14) (2021).





