LPA人源化小鼠模型在Lp(a)靶向藥物評估中的應用
心血管疾病(CVDs)是全球死亡的主要原因,占所有死亡的32%,對人們的身心健康和生活質量產生嚴重影響[1]。CVDs的形式多樣,包括冠狀動脈心臟病、腦血管疾病、周圍動脈疾病和深靜脈血栓等。其主要由不健康的生活方式引起,如不良飲食、吸煙、缺乏運動,以及高血壓、高血糖、高血脂和肥胖等。此外,遺傳風險因素也是導致CVDs的原因之一,其中脂蛋白(a)(Lp(a))是新近發現的遺傳風險因素。循環中Lp(a)水平與動脈粥樣硬化性心血管疾病風險成正比[2-3]。由于Lp(a)水平無法通過改變生活方式來降低,并且目前沒有能在不產生其他影響的情況下降低Lp(a)水平的治療藥物,因此降低Lp(a)水平以預防或治療CVDs是當前重要的研究方向。

圖1 心血管疾病(CVDs)及其風險因素[2]
脂蛋白(a)(Lp(a))高表達增加心血管疾病風險
脂蛋白(a)(Lp(a))是一種特殊的脂蛋白顆粒,由載脂蛋白(a)(Apo(a))與低密度脂蛋白(LDL)上的載脂蛋白B(ApoB)連接而成,其中Apo(a)的編碼基因LPA僅存在于人類和部分非人靈長類動物中[4]。作為心血管疾病的新標志物和獨立風險因素,Lp(a)通過促進血管炎癥、動脈粥樣硬化、鈣化和血栓形成來發揮作用。全球約20%~25%的人口Lp(a)水平達到或超過50 mg/dL,這一水平被認為會增加心血管風險[4-5]。與Lp(a)相關的風險增加主要由Apo(a)的促凝效應和氧化ApoB相關磷脂的動脈粥樣硬化及促炎效應所致。由于血漿中Lp(a)濃度主要受LPA基因控制,通過改變生活方式或使用現有藥物來降低其水平效果有限,因此開發直接靶向調控LPA基因表達的小核酸藥物療法成為研究焦點[4-5]。早期臨床結果表明,靶向肝臟Lp(a)合成的小干擾RNA(siRNA)能顯著降低血脂,且療效可持續至少7個月[6-7]。

圖2 脂蛋白(a)(Lp(a))由載脂蛋白(a)(Apo(a))與低密度脂蛋白(LDL)膽固醇結合而成[8]
LPA人源化小鼠模型用于Lp(a)靶向藥物評估
在藥物臨床前研究中,小鼠是最常用的模型動物。由于LPA基因僅在靈長類動物中存在,評估相關靶向藥物時需在小鼠中引入人類LPA基因。賽業生物開發了多款表達人源LPA基因的小鼠模型。其中,H11-Alb-hLPA小鼠(產品編號:C001542)在肝臟中表達人類LPA基因,受Alb啟動子調控。另一款是條件誘導型LPA基因人源化模型(產品編號:C001521),受CAG啟動子調控,與Alb-Cre小鼠(肝臟特異性Cre小鼠)交配后得到的B6-hLPA(CKI)/Alb-Cre小鼠(產品編號:C001522)可通過Cre重組酶介導的表達終止元件(LSL)刪除實現人LPA基因在小鼠肝臟的持續性高表達。以下是這些模型的詳細表型信息。
人源LPA基因的成功表達
H11-Alb-hLPA小鼠和B6-hLPA(CKI)/Alb-Cre小鼠與野生型小鼠相比,均成功表達人源LPA基因。

圖3 野生型(WT)小鼠、H11-Alb-hLPA小鼠和B6-hLPA(CKI)/Alb-Cre小鼠肝臟中人源LPA基因表達的RT-qPCR檢測結果
持續穩定的LPA蛋白表達
在檢測周期(6~11周齡)內,H11-Alb-hLPA小鼠和B6-hLPA(CKI)/Alb-cre小鼠血清中的人源LPA蛋白表達持續且穩定。雄性小鼠的LPA蛋白表達量普遍高于雌性,但雌性的表達水平更穩定。此外,由于兩款小鼠選擇了不同的啟動子驅動LPA的表達,B6-hLPA(CKI)/Alb-Cre小鼠的血清中LPA蛋白濃度遠高于H11-Alb-hLPA小鼠,適合需高水平LPA蛋白表達的研究。
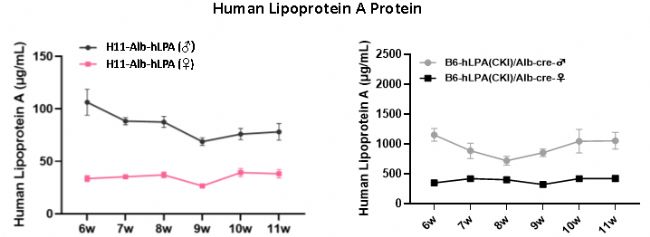
圖4 不同性別小鼠在6~11周齡時血清中人源LPA蛋白表達的ELISA檢測
總 結
H11-Alb-hLPA小鼠(產品編號:C001542)和B6-hLPA(CKI)/Alb-Cre(產品編號:C001522)小鼠均成功表達人源LPA基因,并在血清中顯示出穩定的人源LPA蛋白表達,其中雄性小鼠的表達量較雌性高。此外,B6-hLPA(CKI)/Alb-Cre小鼠的血清LPA蛋白濃度遠高于H11-Alb-hLPA小鼠,建議根據研究中對LPA蛋白表達水平和小鼠遺傳特性的不同需求,選擇合適的人源化品系。綜上所述,這些LPA基因人源化模型適用于動脈粥樣硬化、血栓性心血管疾病等疾病研究,以及人LPA基因靶向藥物的開發和評價。
此外,賽業生物還提供多種心血管代謝領域的遺傳性疾病模型和靶點人源化小鼠,以及多種誘導型疾病模型,滿足研發人員在不同疾病領域的實驗和研究需求。
代謝及心血管疾病模型