INHBE靶點人源化模型在肥胖癥siRNA療法研究中的應用
GLP-1R激動劑,如司美格魯肽,是目前最熱門的減肥藥物。然而,研究顯示,這類藥物在減肥過程中存在一些問題。例如,司美格魯肽會顯著降低去脂體重,約40%的減重來自骨骼和肌肉的減少[1]。此外,GLP-1R激動劑會抑制獎賞系統,耐受性較差,1年后有68%的人不再耐受[2]。最重要的是,大部分患者在停用GLP-1R激動劑后體重會迅速反彈,會陷入對藥物的長期依賴[2-3]。因此,研究人員仍在尋找具有良好耐受性、無體重反彈風險且無肌肉萎縮等副作用的減肥藥物。目前,許多小核酸藥企已經開始關注INHBE抑制療法。這種療法在增加脂肪消耗和長期改善新陳代謝的同時,能保持正常的肌肉質量,因此具有巨大的發展潛力。
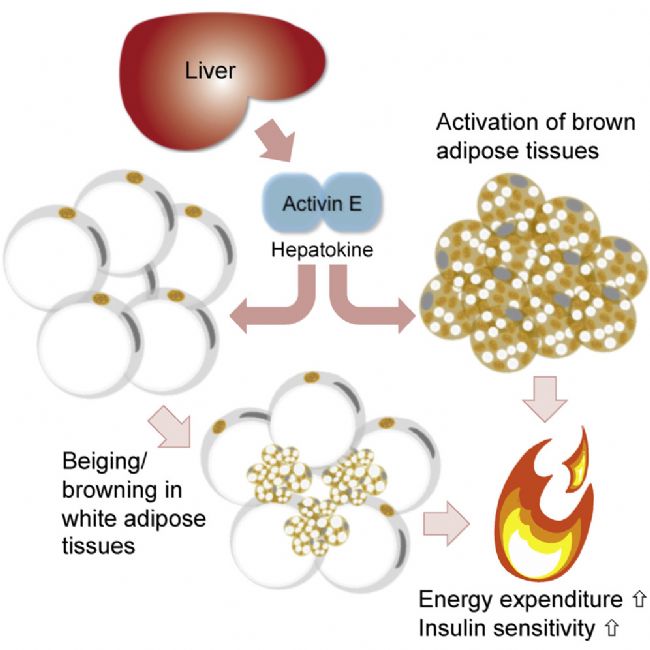
圖1 INHBE(Activin E)通過影響脂肪分布、能量消耗和胰島素敏感性調控代謝的潛在預測途徑[4]
INHBE作為減肥藥物靶點的發現
抑制素亞基βE(INHBE)是轉化生長因子-β(TGF-β)超家族的一員,它在肝細胞中高度特異性地表達。早期研究發現,INHBE可能是在肥胖和胰島素抵抗的條件下,改變全身代謝狀態的肝臟因子[5]。其肝臟表達水平與人類的胰島素抵抗和體重指數正相關。2022年,Alnylam Pharmaceuticals和再生元遺傳學中心(RGC)分別發表的兩篇論文,正式將INHBE與減肥靶點聯系起來[6-7]。這兩篇文章揭示了INHBE與脂肪調節的密切關系,即INHBE蛋白的罕見預測功能缺失(pLOF)突變通過促進健康的脂肪儲存,保護患者免受肝臟炎癥、血脂異常和Ⅱ型糖尿病影響。攜帶此類突變患者的脂肪分布更為正常,腹部脂肪明顯減少,代謝狀況良好,且罹患心血管疾病和Ⅱ型糖尿病的風險顯著降低[6-8]。因此,作為一種肝臟特異性表達的脂肪貯存負調控因子,利用GalNAc等成熟的肝臟遞送平臺開發RNAi藥物,以抑制INHBE的表達成為治療與脂肪分布和儲存不當相關代謝性疾病的潛在優勢策略。
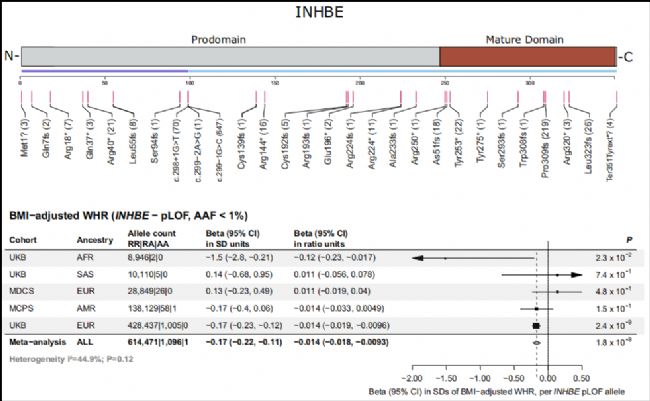
圖2 INHBE的罕見預測功能缺失(pLOF)突變與良好的脂肪分布情況密切相關[7]
靶向INHBE的RNAi療法開發
自INHBE被正式確認為肥胖癥的潛在治療靶點以來,其靶向療法開發進展迅速。在小核酸治療領域,多家藥企已經開發出了在臨床前動物研究中顯示出顯著效果的INHBE siRNA藥物。再生元、Alnylam Pharmaceuticals、Arrowhead Pharmaceuticals和Wave Life Sciences等企業都在積極布局這一領域[9-11]。Arrowhead計劃在年底前提交ARO-INHBE臨床試驗申請(CTA),而Wave Life和Alnylam將在今年確定INHBE GalNAc-siRNA和ALN-INHBE的臨床候選藥物[11-12],并計劃在明年提交CTA。此外,再生元申請的INHBE抑制療法專利也已獲批[9]。因此,可以預見,作為具有巨大潛力的減肥藥物靶點,靶向INHBE的藥物研發競爭將日益激烈。
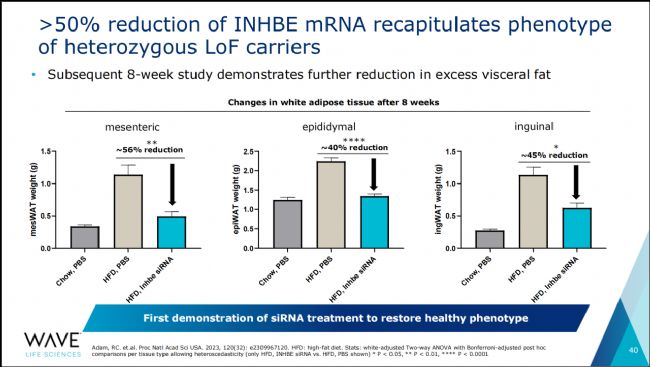
圖3 通過siRNA將小鼠體內INHBE mRNA水平降低50%可重現人類雜合LOF攜帶者表型[11]
RNA干擾藥物(RNAi)主要包括小干擾RNA(siRNA)和反義寡核苷酸(ASO),這些藥物都是通過靶向人源基因的mRNA來發揮作用。考慮到人類和動物在基因上的差異,賽業生物自主研發了B6-hINHBE小鼠模型(產品編號:C001533),該模型僅表達人源INHBE基因,這將有助于加速靶向人源INHBE基因的RNAi療法進入臨床階段。以下是該模型的具體信息。
B6-hINHBE小鼠成功表達
人源INHBE基因和蛋白
RT-qPCR的檢測結果表明,B6-hINHBE小鼠的肝臟中顯著表達人源INHBE基因,而小鼠內源性Inhbe基因的表達則未被檢測到。Western blot的檢測結果顯示,B6-hINHBE小鼠的血清中存在顯著的人源INHBE蛋白表達。
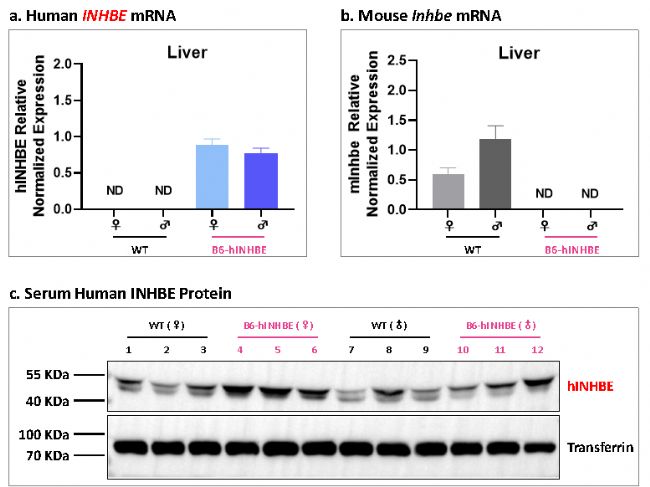
圖4 B6-hINHBE小鼠體內人源INHBE基因和蛋白的表達情況
注:由于該檢測抗體可能交叉識別人和小鼠INHBE蛋白,因此在野生型小鼠樣本中也檢測到INHBE陽性條帶。
總 結
針對人源基因和mRNA的小核酸(RNAi)抑制療法是靶向INHBE治療肥胖癥和其他與脂肪分布和儲存不當相關的代謝性疾病的主要途徑,而B6-hINHBE小鼠(產品編號:C001533)高表達人源INHBE基因和蛋白,因此可用于需要精準靶向人源INHBE的療法研究。
此外,賽業生物在肥胖等心血管代謝疾病研究領域也開發了多種遺傳疾病模型、誘導型疾病模型和人源化模型,包括GLP-1R和GDF15等熱門減肥靶點人源化模型。這些模型可供研究人員用于開發針對不同疾病的靶向藥物。
代謝和心血管疾病精選模型——基因編輯

代謝和心血管疾病精選模型——誘導造模






