骨質疏松癥簡介及其研究常用的動物模型
為了更好地了解骨質疏松癥的發病機制以及尋找有效的治療方法,構建行之有效的骨質疏松實驗動物模型至關重要。今天,小編就為大家詳細介紹下骨質疏松癥研究常用的動物模型。
骨質疏松癥簡介
骨質疏松癥(osteoporosis,OP)是好發于中老年人的一種常見的全身性骨骼代謝性疾病,以低骨量和骨組織微結構破壞為特征,易導致骨質脆性增加和骨折傾向。其最常見的癥狀是疼痛,以腰背痛最為多見,其次是身長縮短、駝背,嚴重者可見骨折,甚至誘發死亡。
依據病因,OP主要分為原發性和繼發性兩大類。原發性OP約占80%,包括絕經后OP(Ⅰ型)、老年性OP(Ⅱ型)和特發性OP(包括青少年型)3種;繼發性則是繼發于各種全身性或內分泌代謝性疾病的OP。因此,該病可發生于不同性別和任何年齡,但多見于絕經后婦女和老年男性。
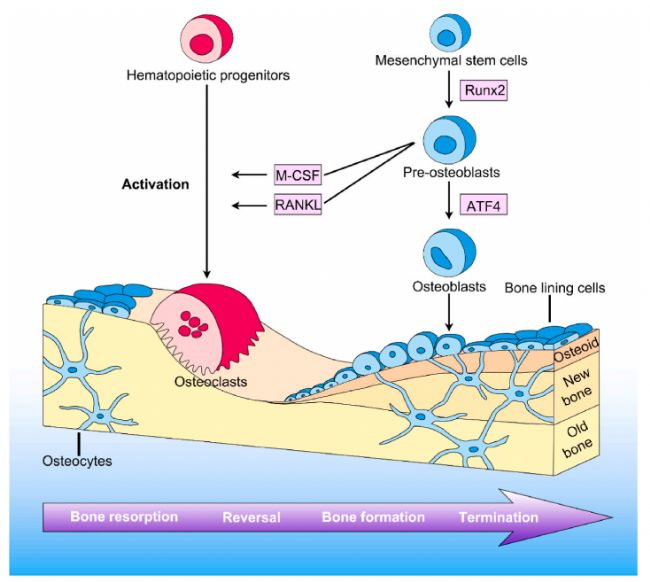
圖2. 骨重塑的過程[4]
常用的骨質疏松動物模型
目前,常用來誘發骨質疏松的動物有大鼠、小鼠、兔、羊、豬、狗和非人類靈長類動物等,造模方法有去勢法、藥物致骨質疏松法、營養法、失用法,以及一些特殊類型的造模方法如轉基因法、基因突變法、腦源性造模法等,有的用單一種方法,有的兩種或多種方法聯合使用。
按照發病機制,骨質疏松動物模型可分為兩類:
(1)減少骨形成為主導機制的模型,如老年性骨質疏松模型、糖皮質激素誘導的骨質疏松模型;
(2)增加骨吸收為主導機制的模型,如去卵巢骨質疏松模型、失用性骨質疏松模型、營養性骨質疏松模型。
01 去卵巢骨質疏松模型
1969年Saville通過手術切除雌性大鼠卵巢,首次建立絕經后骨質疏松動物模型。該方法成功率高,重復性好,適用范圍廣。與婦女絕經后骨質疏松相似,雌性大鼠切除卵巢后也會出現骨量減少、骨強度下降、骨丟失加快等癥狀,因此去卵巢造模方法被廣泛認為是絕經后骨質疏松癥造模的金標準。
南模生物依托自身豐富的疾病動物模型構建經驗,采用雙側卵巢摘除術(OVX),構建了穩定的大、小鼠骨質疏松癥模型,可用于骨質疏松癥的發病機制、治療方法與藥物篩選等研究。
案例展示:

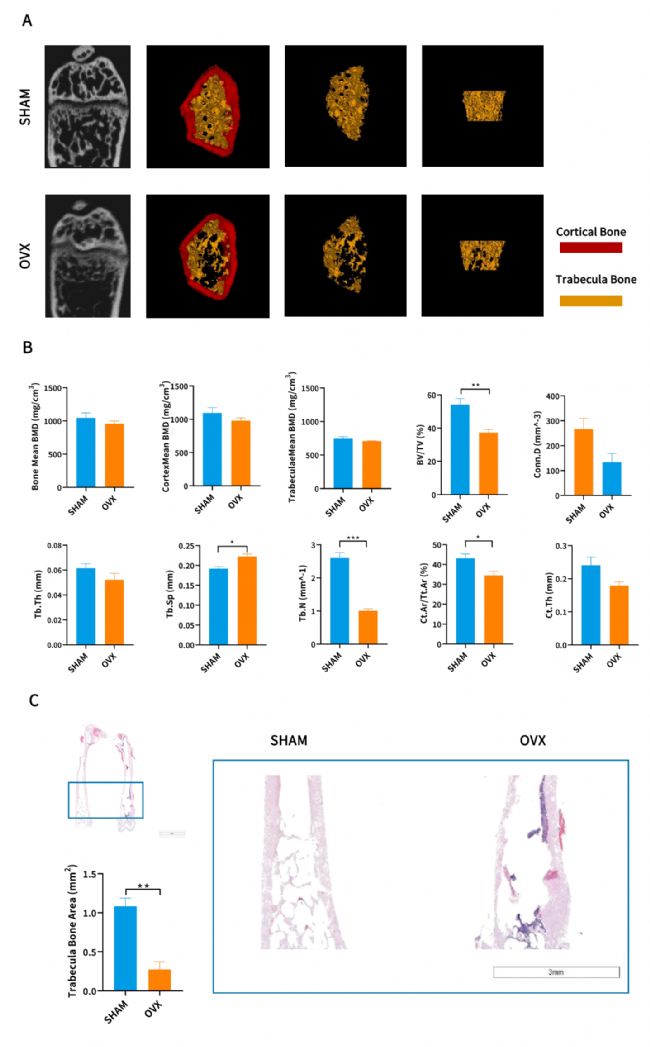
老年性骨質疏松癥是由于年齡的老化引起的骨質疏松癥。SAMP6可作為老年性骨質疏松癥模型,它是目前僅有的一種能證明增齡性骨脆性骨折的動物。SAMP6在4月齡時骨量達到峰值,之后骨量逐漸丟失,并且上述變化在雌雄之間無差異,與老年性骨質疏松癥患者的病理變化相似。
03 糖皮質激素誘導的骨質疏松模型
糖皮質激素所致的骨質疏松癥的發病率僅次于絕經后骨質疏松和老年性骨質疏松,因此糖皮質激素誘導法制作的骨質疏松試驗動物模型對研究人類繼發性骨質疏松癥具有重要意義,目前應用最多的是地塞米松和潑尼松龍。在使用糖皮質激素造模時應把握好劑量,合適的劑量既可以有效引起骨量丟失,又不會因免疫抑制過強導致動物死亡。
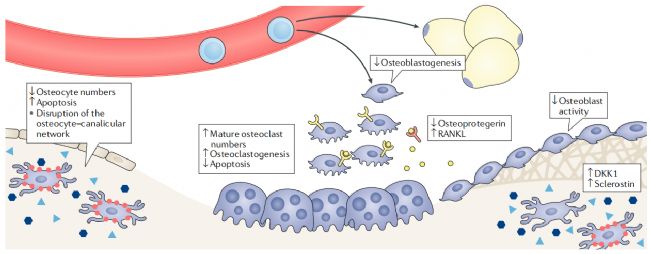
圖5. 糖皮質激素誘導的骨質疏松癥初始階段的骨重塑[7]
04 失用性骨質疏松模型
失用性骨質疏松是由于運動能力受限或功能障礙而引起骨代謝障礙,多由失重狀態、長期臥床或制動等因素導致。常用的建模方法有足切除法、尾懸吊法、坐骨神經切除法等,這些模型的成功復制為臨床失用性骨質疏松的治療和預防提供了很好的試驗材料。
05 營養性骨質疏松模型
營養是影響骨密度的眾多因素之一,許多營養學研究者通過限制飲食中的鈣、蛋白質、維生素D等的攝入成功復制了營養缺乏型骨質疏松模型,該模型主要用于骨質疏松的營養療法研究及日常膳食不均引起的骨質疏松的發病機制研究,但在建立該模型時試驗動物的飼料配方復雜,且影響因素較多,因此難以普及推廣。
06 基因工程法誘導的骨質疏松模型
基因工程法是指通過基因編輯技術將外源性基因插入動物基因組或對動物自身基因進行突變、敲除、過表達等使動物具有骨質疏松特性,常用動物有小鼠和斑馬魚。
目前,基因工程法建立OP模型仍處于探索階段,部分研究將基因工程技術與去勢法相結合,探究目的基因對于OP的影響,從而有助于臨床OP新療法的研究;另一部分研究旨在探究目的基因敲除或過表達后對于骨骼系統的影響,從而致力于OP發病機制的探索。


骨質疏松癥動物模型的評價指標
骨質疏松模型是否復制成功,需要用客觀的指標來評價,骨質疏松的動物模型和造模方法很多,但評價指標是一致的,主要包括骨密度測定、病理學骨組織形態觀察、生化指標檢測分析、骨生物力學指標測試等(見表1),其中最主要的是骨量與骨組織病理學變化這兩項指標。
表1. 骨質疏松癥常用動物模型評價方法[1]

南模生物配備了Quantum GX2 Micro-CT小動物活體影像系統,該儀器成像系統模式靈活,兼容離體樣本、小鼠、大鼠等多種樣本,具備快速、低劑量的掃描模式,可在動物正常生理狀態下以非侵入性的方式進行骨骼結構成像,是骨相關研究的利器。
Reference:
[1] 孫凱,魏戌,朱立國,等.病證結合模式下骨質疏松癥實驗動物模型的研究進展[J].中國骨質疏松雜志,2019.DOI:CNKI:SUN:ZGZS.0.2019-09-028.
[2] 江瑞雪,蔣欣泉,文晉.骨質疏松動物模型研究現狀與進展[J].中國骨質疏松雜志,2022(007):028.
[3] Hendrickx G, Boudin E, Van Hul W. A look behind the scenes: the risk and pathogenesis of primary osteoporosis. Nat Rev Rheumatol. 2015;11(8):462-474. doi:10.1038/nrrheum.2015.48
[4] Lei C, Song JH, Li S, et al. Advances in materials-based therapeutic strategies against osteoporosis. Biomaterials. 2023;296:122066. doi:10.1016/j.biomaterials.2023.122066
[5] 祁珊珊.骨質疏松疾病動物模型的研究進展[J].黑龍江畜牧獸醫,2016(5):3.DOI:10.13881/j.cnki.hljxmsy.2016.0776.
[6] Manolagas SC. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev. 2000;21(2):115-137. doi:10.1210/edrv.21.2.0395
[7] Chotiyarnwong P, McCloskey EV. Pathogenesis of glucocorticoid-induced osteoporosis and options for treatment. Nat Rev Endocrinol. 2020;16(8):437-447. doi:10.1038/s41574-020-0341-0
[8] Boudin E, Van Hul W. MECHANISMS IN ENDOCRINOLOGY: Genetics of human bone formation. Eur J Endocrinol. 2017;177(2):R69-R83. doi:10.1530/EJE-16-0990
[9] Compston JE, McClung MR, Leslie WD. Osteoporosis. Lancet. 2019;393(10169):364-376. doi:10.1016/S0140-6736(18)32112-3





