小鼠模型在發現調控NAFLD疾病進程的新型蛋白CAND1研究中的應用
非酒精性脂肪肝病(NAFLD)包含一系列疾病,非酒精性脂肪性肝(NAFL)和非酒精性脂肪性肝炎(NASH),甚至最后發展為肝硬化和肝細胞癌。NAFLD患者肝臟最常見的病理特征是肝細胞脂肪變性、胰島素抵抗、炎癥甚至纖維化。盡管在探索NAFLD的新分子機制和治療靶點方面投入越來越多,但由于缺乏有效的治療藥物,NAFLD的治療仍然存在重大挑戰和困難。
Cullin-RING連接酶(CRLs)是大約250種酶復合物的集合,這些酶復合物使蛋白質底物泛素化以改變其功能或標記其蛋白酶體降解。在NAFLD的發展過程中,許多蛋白的穩態被擾亂,干預泛素-蛋白酶體系統微調靶蛋白的表達已成為NAFLD潛在的治療策略。
2023年8月1日,哈爾濱醫科大學潘振偉團隊在《Nature Communications》發表題為“Cullin-associated and neddylation-dissociated protein 1 (CAND1) alleviates NAFLD by reducing ubiquitinated degradation of ACAA2”的研究論文,該研究發現CAND1在NAFLD患者,高脂喂養小鼠和PA誘導的肝細胞中蛋白和mRNA水平顯著降低,并且CAND1抑制Cullin1,FBXO42和ACAA2復合物組裝進而阻止ACAA2的泛素化降解,減緩NAFLD疾病進程,AR作為CAND1的轉錄因子調節CAND1的表達。AR-CAND1-ACAA2信號軸為揭示NAFLD的發病機制提供了新的方向,對于今后的藥物治療具有重要的臨床意義。

圖片來源:《Nature Communications》(https://doi.org/10.1038/s41467-023-40327-5)
研究材料
在這項研究中,研究人員使用CAND1flox/flox和CAND1knockin小鼠分別與Alb-cre工具鼠雜交得到了肝臟特異性敲除和過表達的小鼠,小鼠都由賽業公司提供。此外研究人員還使用了NAFLD人群樣本檢測。
研究方法
作者采用了多種實驗技術,包括各種組織學染色、WB、qPCR、蛋白質組學測序、蛋白質免疫共沉淀(Co-IP)和熒光素酶報告基因實驗等。
技術路線
01 GEO數據庫篩出候選基因CAND1
02 構建CAND1基因敲除和過表達小鼠模型驗證其功能
03 CAND1調節NAFLD的機制探究
04 調控CAND1表達水平的機制研究
研究結果

圖1 CAND1在NAFLD患者,HFD小鼠和PA誘導的肝細胞中低表達[[1]
研究人員在NAFLD患者和正常供者的肝活檢樣本中檢測了CAND1的表達水平。與正常供體相比,NAFLD患者肝臟組織中CAND1 mRNA和蛋白質含量降低。與對照組相比,HFD喂養后小鼠肝臟中CAND1 mRNA和蛋白質水平也顯著降低。此外,AML12和THLE-2細胞暴露于棕櫚酸(PA)24小時后,CAND1 mRNA和蛋白質水平也顯著降低,這些結果表明,CAND1在NAFLD的發展中起著合理的作用,如圖1所示。
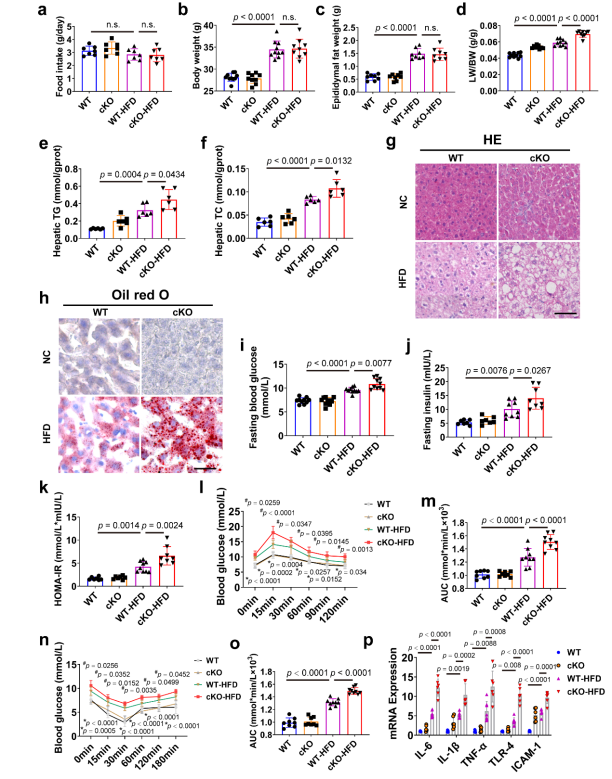
圖2 肝細胞特異性CAND1缺乏加劇了雄性小鼠hfd誘導的肝損傷[1]
為了驗證CAND1對肝細胞的特異性作用,研究人員使用賽業生物提供的CAND1flox/flox小鼠與Alb-cre工具鼠雜交構建了肝細胞特異性CAND1敲除(條件敲除,cKO)雄性小鼠。值得注意的是,在HFD治療后,WT和CAND1 cKO小鼠的食物攝入量沒有統計學差異。HFD處理增加了16周后WT和CAND1 cKO小鼠的體重和附睪脂肪重量,WT-HFD和CAND1 cKO-HFD小鼠的體重和附睪脂肪重量相當。CAND1 cKO-HFD小鼠的LB/BW比增加。與WT-HFD小鼠相比,CAND1 cKO-HFD小鼠的TG和TC水平顯著升高。H&E和油紅O染色顯示,CAND1 cKO-HFD小鼠肝臟中的脂質積累比WT-HFD小鼠更嚴重。CNAD1 cKO-HFD小鼠表現出更高的空腹血糖、胰島素濃度和HOMA-IR。此外,與WT-HFD小鼠相比,CAND1 cKO-HFD小鼠表現出更強的葡萄糖耐量和胰島素敏感性。肝臟炎癥是NAFL發展為NASH的常見病理改變。與WT-HFD小鼠相比,CAND1 cKO-HFD小鼠肝臟中促炎因子的表達增加。然而,WT-HFD和CAND1 cKO-HFD小鼠的纖維化面積和血清αFP(肝癌標志物)水平沒有差異。這些發現表明肝細胞中CAND1缺乏加重了hfd誘導的肝損傷,如圖2所示。

圖3 肝細胞特異性CAND1過表達改善雄性小鼠hfd誘導的肝損傷[1]
研究人員進一步使用賽業生物提供的CAND1knockin小鼠與Alb-cre工具鼠雜交建立了肝細胞特異性CAND1過表達(條件敲入,cKI)雄性小鼠系,以驗證肝細胞CAND1對HFD治療后肝損傷的功能。HFD或NC治療后,WT與CAND1 cKI小鼠的進食量無統計學差異。HFD治療在HFD治療16周后增加了WT和CAND1 cKI雄性小鼠的體重和附睪脂肪重量,WT-HFD和cKI-HFD小鼠的體重和附睪脂肪重量相當。與CAND1 cKO小鼠的變化相反,肝細胞特異性過表達CAND1在很大程度上保護了HFD誘導的肝脂肪變性、肝抵抗和炎癥。具體而言,肝細胞中CAND1的過表達改善了肝脂肪變性,降低了LW/BW比和肝臟中TG和TC的含量。與WT-HFD小鼠相比,CAND1 cKI-HFD小鼠的糖耐量和胰島素敏感性顯著提高。此外,CAND1 cKI-HFD小鼠的促炎因子mRNA水平低于WT-HFD小鼠。天狼星紅染色顯示WT-HFD和cKI-HFD雄性小鼠的纖維化面積沒有差異。這些數據證實了CAND1在hfd誘導的肝損傷中的保護作用,如圖3所示。
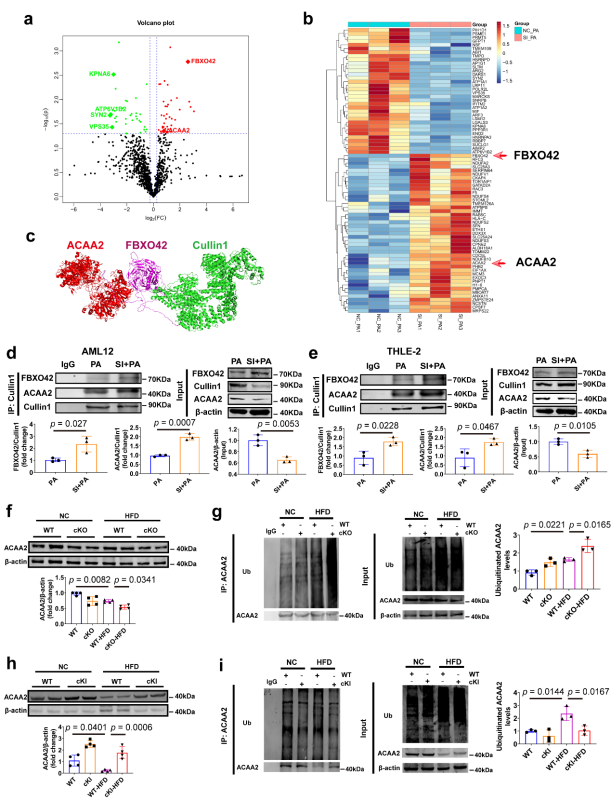
圖4 CAND1控制脂肪酸β-氧化基因ACAA2的泛素化降解[1]
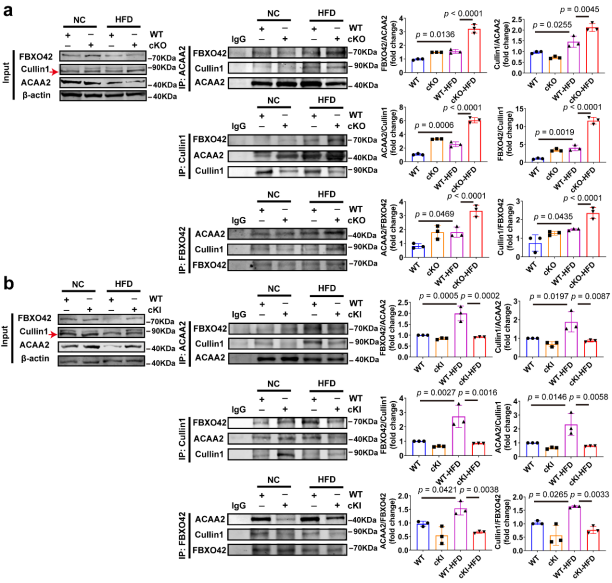
圖5 CAND1抑制Cullin1、FBXO42和ACAA2復合物的形成[1]
CAND1通過調節含有底物受體的F-box和Cullin1復合物的組裝來控制全局CRLs網絡的動力學。為了闡明CAND1調控NAFLD發展的機制,研究人員進行了Co-IP和質譜分析,以鑒定轉染NC或siCAND1的PA處理的L02細胞中的cullin1結合蛋白。共獲得72個解除調控的cullin1結合蛋白,其中39個基因上調,33個基因下調。在上調基因中,乙酰輔酶A酰基轉移酶2(ACAA2)和F-box蛋白42(FBXO42)引起了研究人員的注意。ACAA2是一種脂肪酸β氧化的硫解酶,其過表達可促進脂肪酸氧化并抑制脂質積累。F-box蛋白FBXO42是一種底物受體,可招募靶蛋白并促進其泛素化降解。他們推測Cullin1、FBXO42和ACAA2可能形成一個SCF復合物,調節ACAA2的泛素化和降解,從而影響CAND1對NAFLD的作用。分子對接也預測了FBXO42與ACAA2和Cullin1結合。
研究人員檢測了Cullin1、FBXO42和ACAA2復合物在AML12和THLE-2細胞中的形成。PA處理后siCAND1中ACAA2、Cullin1和FBXO42復合物的形成較NC組明顯增加,PA處理后siCAND1中ACAA2蛋白表達較NC組明顯下調。
與WT小鼠相比,WT-hfd小鼠的ACAA2蛋白表達明顯降低。與WT-hfd小鼠相比,CAND1 cKO-HFD小鼠的ACAA2蛋白顯著降低,表明ACAA2泛素化程度較高。CAND1 cKI-HFD雄性小鼠的ACAA2蛋白顯著上調,泛素化水平明顯降低。
接下來,研究人員用Co-IP法檢測Cullin1、FBXO42和ACAA2復合物。與WT小鼠相比,WT-hfd小鼠中ACAA2、Cullin1和FBXO42復合物的形成明顯增加,且CAND1 cKO-HFD中ACAA2、Cullin1和FBXO42復合物的含量高于WT-hfd小鼠。然而,與WT-HFD小鼠相比,CAND1 cKI-HFD小鼠中ACAA2、Cullin1和FBXO42復合物的含量較少。這些結果表明,CAND1抑制ACAA2、Cullin1和FBXO42復合物的組裝,從而抑制ACAA2的泛素化降解,如圖4,5所示。
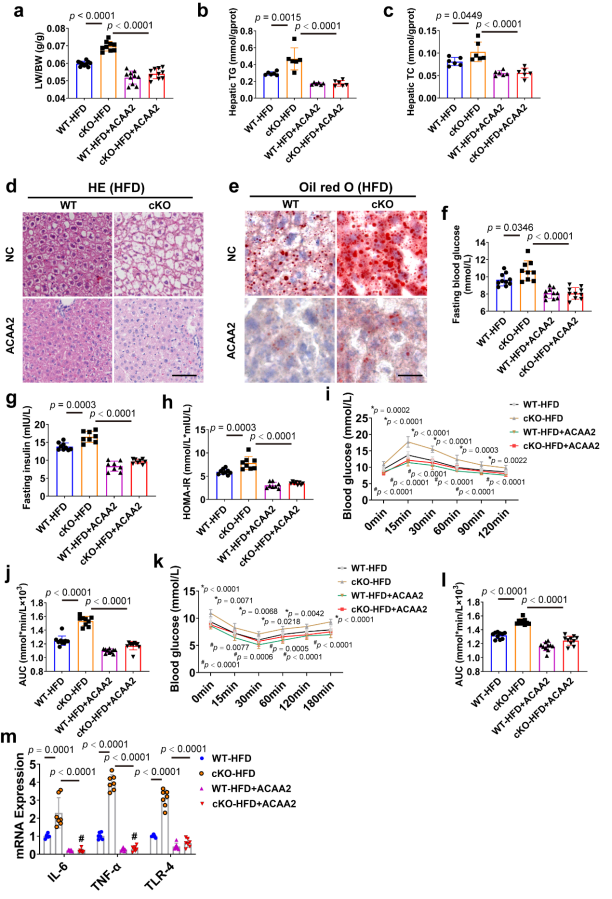
圖6 ACAA2過表達可改善因CAND1缺陷增強的雄性小鼠肝脂肪變性、胰島素抵抗和炎癥[1]
為了進一步闡明CAND1對NAFLD的調節作用是否由ACAA2介導,研究人員通過尾靜脈向雄性小鼠注射AAV8-ACAA2病毒,特異性提高了ACAA2在肝細胞中的表達。ACAA2過表達大大改善了CAND1 cKO-HFD小鼠的病理改變,包括LB/BW比、肝臟TG和TC水平以及脂質積累。此外,ACAA2過表達顯著消除了CAND1條件敲除對飼喂HFD小鼠的空腹血糖、空腹胰島素和HOMA-IR指數的加重作用。此外,ACAA2過表達改善了CAND1 cKO-HFD小鼠的葡萄糖耐量和胰島素敏感性,這一點通過腹腔注射GTT和ITT得到了證明。ACAA2過表達也降低了CAND1 cKO-HFD小鼠中促炎因子IL-6、TNF-α和TLR-4的水平。這些結果表明,肝細胞CAND1對NAFLD進展的影響是由ACAA2介導的,如圖6所示。
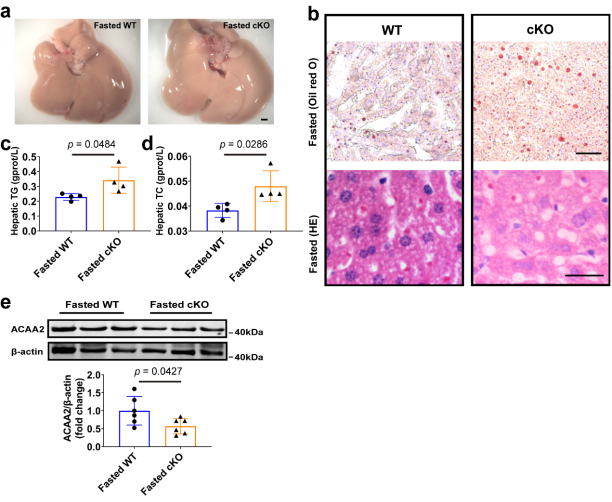
圖7 肝細胞特異性CAND1敲除促進雄性小鼠饑餓誘導的脂肪肝[1]
在禁食條件下,過量的脂肪酸被重新酯化成甘油三酯,在肝臟細胞內儲存,從而導致饑餓性脂肪肝。然后,研究人員探討了CAND1是否也對饑餓誘導的脂肪肝有調節作用。在雄性小鼠饑餓24h后,他們檢測了肝臟脂質的積累。結果顯示,與WT小鼠相比,CAND1 cKO雄性小鼠饑餓后肝臟脂質積累更為嚴重。CAND1 cKO雄性小鼠肝臟中TG和TC水平也顯著升高。此外,CAND1 cKO中ACAA2水平顯著降低。這些數據表明,CAND1也抑制饑餓誘導的肝臟脂質代謝,如圖7所示。
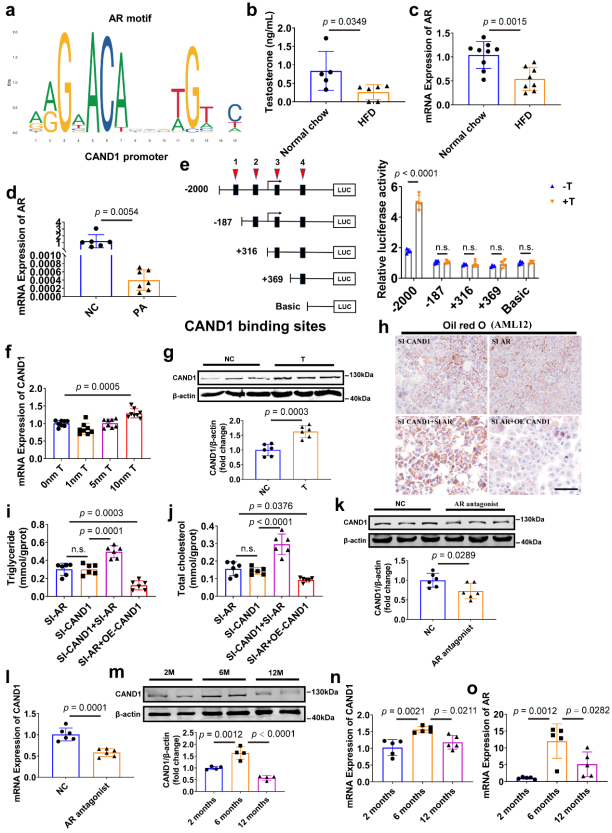
圖8 雄激素/雄激素受體(AR)信號調控CAND1的轉錄[1]
由于NAFLD肝臟中CAND1的mRNA水平降低,他們隨后探索了CAND1的轉錄調控。研究人員使用JASPAR網站預測了CAND1基因的轉錄因子,并在CAND1基因的啟動子區域確定了四個雄激素受體(AR)的潛在結合位點。他們觀察到NAFLD雄性小鼠與正常鼠相比睪酮和AR水平下降。PA誘導后AML12細胞中AR表達也下降。有趣的是,與WT雄性小鼠相比,CAND1 cKO雄性小鼠的AR表達和睪酮水平顯著降低。
為了闡明AR對CAND1轉錄的直接影響,研究人員將AR過表達質粒和含有順序截斷的CAND1啟動子的質粒共轉染到細胞中。在CAND1啟動子區域鑒定了四個推測的AR結合位點。這些結合位點的序列缺失表明,ar結合位點1是ar促進CAND1轉錄活性的主要位點。此外,睪酮處理上調了AML12細胞中CAND1的mRNA和蛋白水平。pa誘導的脂質積累在siCAND1組和siAR組相似。在AML12細胞中,與單獨敲低CAND1相比,AR和CAND1的同時敲低加重了PA誘導的脂質積累,而在PA處理后,CAND1的過表達減輕了AR缺陷引起的AML12細胞中的脂質積累。研究人員給雄性小鼠服用AR拮抗劑enzalutamide(10mg/kg),發現CAND1 mRNA和蛋白水平顯著降低。并且,小鼠出生后2-6個月肝臟中CAND1水平升高,12個月時下降,這與AR的表達變化一致。這些結果表明,CAND1的轉錄受雄激素受體的調節,如圖8所示。
研究結論
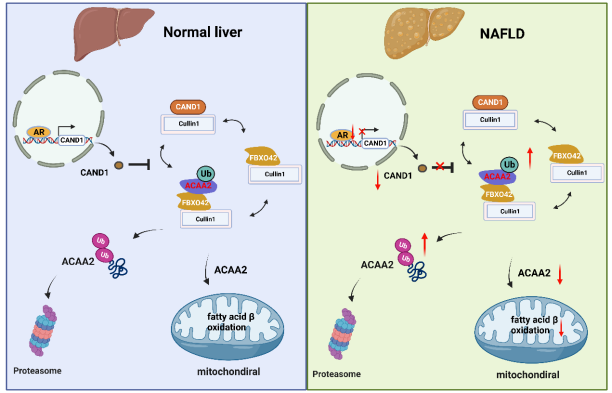
圖9 CAND1在調節ACAA2泛素化和降解中的作用[1]
在本研究中,作者發現CAND1阻斷Cullin1、FBXO42和ACAA2復合物的組裝,抑制ACAA2的泛素化降解,從而維持肝細胞內脂肪酸降解的速度,減少肝臟內脂質積累。雄激素受體通過結合-187到-2000啟動子區域來決定CAND1的轉錄。研究結果表明,CAND1是治療NAFLD的一個潛在的靶點。
原文檢索:
[1] Xiang Huang, Xin Liu, Xingda Li, Yang Zhang, Jianjun Gao, Ying Yang 1, Yuan Jiang, Haiyu Gao, Chongsong Sun, Lina Xuan, Lexin Zhao, Jiahui Song, Hairong Bao, Zhiwen Zhou, Shangxuan Li, Xiaofang Zhang, Yanjie Lu, Xiangyu Zhong, Baofeng Yang, Zhenwei Pan. Cullin-associated and neddylation-dissociated protein 1 (CAND1) alleviates NAFLD by reducing ubiquitinated degradation of ACAA2. Nature Communications, 2023 Aug 1;14(1):4620. doi: 10.1038/s41467-023-40327-5.





