家族性滲出性玻璃體視網膜病變(FEVR)介紹及相關小鼠模型
家族性滲出性玻璃體視網膜病變(FEVR)是一組罕見的遺傳性視網膜疾病,其特征是異常的視網膜血管生成,導致周圍視網膜血管化不完全,隨后出現視網膜缺血。FEVR的無血管視網膜導致缺氧和新生血管生長刺激進入玻璃體,從而導致后期的玻璃體視網膜牽拉、黃斑下滲出和出血、視網膜褶皺、牽拉性視網膜脫離和黃斑移位。FEVR的臨床表現往往不對稱,在同一家庭的受影響成員之間也會有顯著差異。輕度疾病患者可能無癥狀,而重度疾病患者可能表現為嚴重的視力喪失。目前尚無特效藥物可用于治療FEVR,但激光治療、玻璃體切割手術等方法可以幫助緩解癥狀和保護視力[1]。
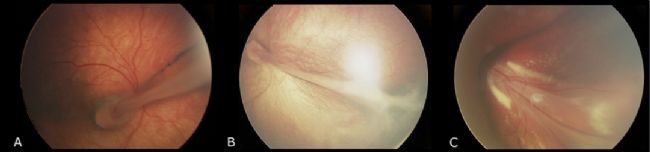
家族性滲出性玻璃體視網膜病變(FEVR)的視網膜褶皺表型[2]
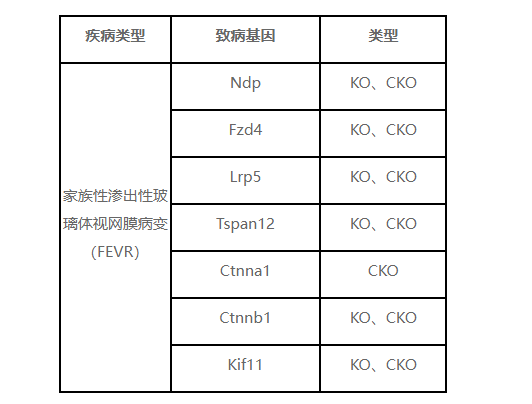
血管發育受多種信號通路精密調控,其中Wnt信號通路是關鍵調控系統之一。Norrin/β-Catenin信號通路是一種重要的Wnt信號傳導途徑,它在眼睛和耳朵的血管發育中起著核心作用[3]。在這條通路中,主要是通過Norrin與其受體FZD4、LRP5和TSPAN12結合形成復合物來實現調節作用,從而促進視網膜血管生成。目前已知至少有9個基因的突變會導致FEVR,包括NDP,FZD4,LRP5,TSPAN12,ZNF408,KIF11,RCBTB1,CTNNB1和JAG1,占全球所有FEVR病例的約50%。這些基因突變會影響Wnt信號通路的正常調節作用,導致視網膜血管生成異常和視網膜缺血等癥狀[4]。
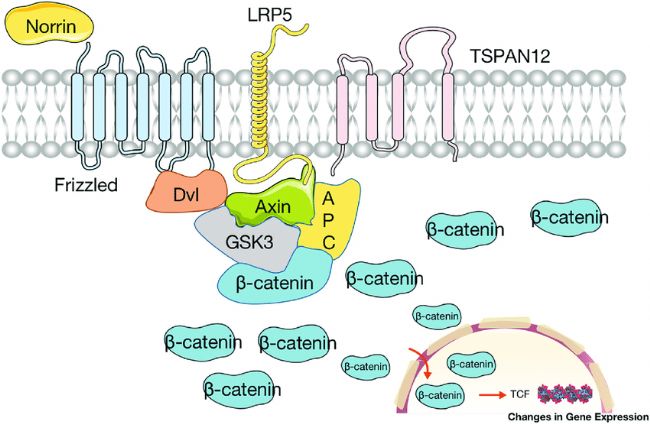
Norrin/β-Catenin信號通路調控視網膜血管發生的途徑[4]
01.NDP相關FEVR
NDP基因編碼Norrin蛋白,該蛋白與視網膜血管的生長和發育有關。Norrin蛋白與FZD4蛋白結合,形成高親和力的配體-受體對,并與輔助組分TSPAN12一起,通過促進β-Catenin進入細胞核,誘導FZD4和LRP5依賴性激活經典Wnt通路。Wnt信號通路在眼睛的生長和發育中起著重要作用,其缺陷會影響這一過程,并在FEVR和Norrie疾病的病理過程中起著重要作用[5]。因此,NDP基因突變會影響Norrin蛋白的功能,從而影響Wnt信號通路,導致FEVR的發生。在小鼠中,Ndp基因的敲除將導致淺層視網膜血管發育延遲,并且無法形成深層視網膜血管,進一步會形成類似微動脈瘤的病變,這是典型的視網膜血管缺陷表型[6]。
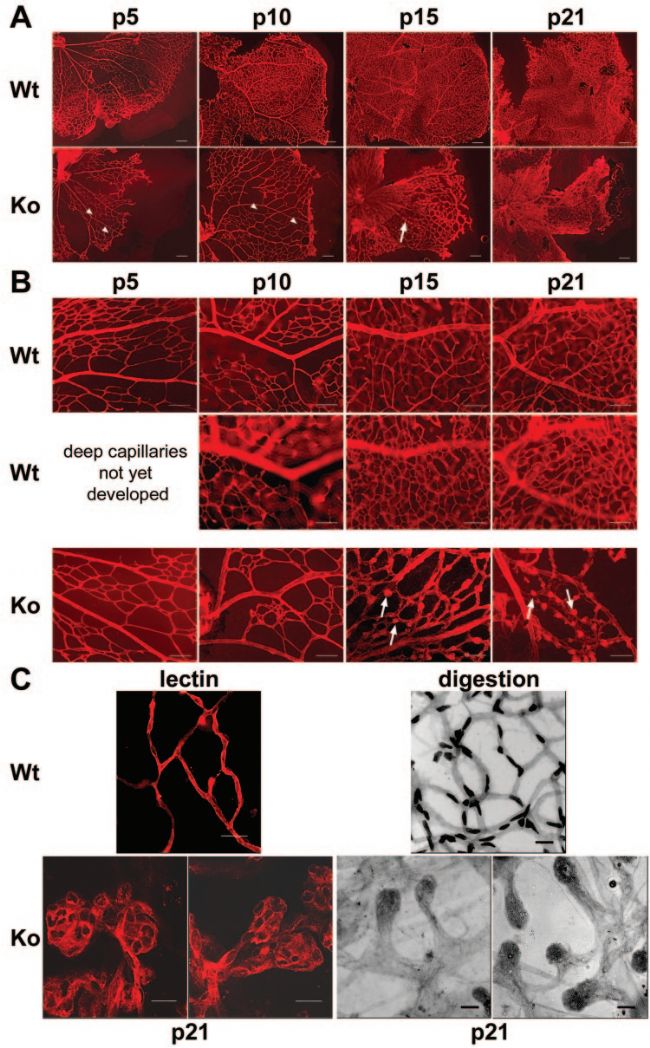
Ndp-KO小鼠存在視網膜淺層血管的缺陷和深層毛細血管網絡的缺失[6]
02.FZD4相關FEVR
FZD4作為Wnt信號通路的受體,可通過結合Wnt蛋白來激活該通路,并促進視網膜血管的正常發育。FZD4突變導致其無法與Wnt蛋白結合,從而導致Wnt信號通路的抑制,這種異常會導致靜脈瘤的形成和視網膜缺血等癥狀。此外,FZD4基因突變也可能通過影響TGF-β信號通路和Notch信號通路等其他信號通路的調節,從而影響視網膜血管的發育和維護。以上兩種機制可能共同導致了FEVR的發生或惡化[7]。與Ndp敲除小鼠表型相似,Fzd4-KO小鼠的視網膜和內耳的血管發育受到了極大的影響并且出現視網膜應激的表型。Fz4的缺失導致多個表型的出現,包括視網膜表面內皮細胞遷移的延緩,視網膜內的二級和三級血管分枝的消除,玻璃體血管系統程序性退化的極大延遲,并在耳蝸血管內產生漸進性擴大和退化以及小腦血管的漸進性紊亂等。此外,Fz4缺失可能還會導致其他非血管方面的表型,如腦部退化和聽力障礙[8]。
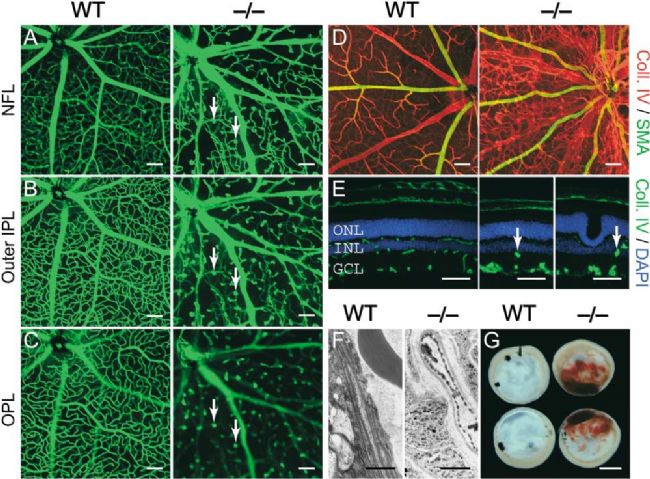
Fzd4-KO小鼠存在視網膜血管缺陷的表型[8]
03.TSPAN12相關FEVR
TSPAN12基因編碼的跨膜蛋白同樣也是Wnt信號通路中的一個重要成員,TSPAN12可以與FZD4共同作用,參與Wnt信號通路的調節,促進視網膜血管的正常發育。TSPAN12的突變與FZD4突變導致的表型較為相似,都導致靜脈瘤的形成和視網膜缺血等癥狀,并通過影響VEGF和Notch等信號通路,來影響視網膜血管的發育和維護[9]。同樣,Tspan12基因敲除小鼠擁有和Fzd4敲除小鼠相似的表型,包括靜脈瘤的形成、血管分支和血管消退的異常等視網膜內血管發育異常。此外,Tspan12缺失還會導致小鼠出現視力障礙、視網膜缺血以及心臟異常、肝臟異常和骨骼畸形等其他器官和組織的發育異常[10]。
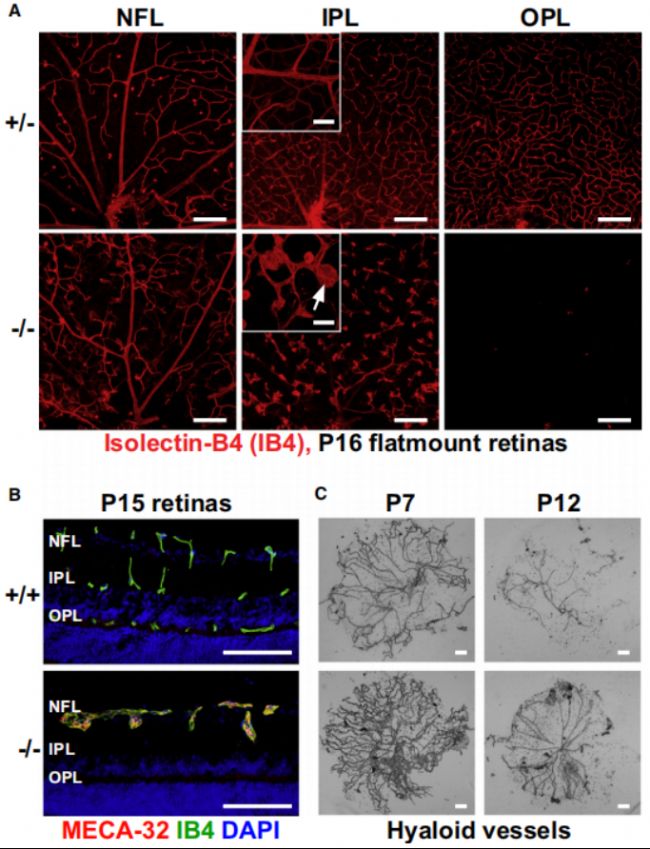
Tspan12-KO小鼠存在微動脈瘤和玻璃體血管退化延遲等表型[10]
04.LRP5相關FEVR
LRP5作為Wnt信號通路的受體,可以通過結合Wnt蛋白來激活Norrin/β-Catenin信號通路,參與視網膜血管形成的調控。LRP5基因的功能缺失型導致其無法與Wnt蛋白結合,造成Wnt信號通路異常,導致視網膜血管的異常發育,包括靜脈瘤的形成和視網膜缺血等癥狀,最終導致FEVR的發生。此外,LRP5也參與調控骨密度和膽固醇代謝途徑的調節,LRP5基因的功能喪失突變會也導致骨質疏松-假瘤綜合征(OPPG)。相反,LRP5的功能增強突變會導致異常骨密度增高[11]。因此LRP基因敲除小鼠除表現為視網膜血管異常和視網膜發育不良等眼部疾病表型外,還呈現骨骼畸形和低骨密度等骨骼表型以及膽固醇代謝異常和高膽固醇血癥等心血管表型[12-14]。與Ndp和Fzd4基因敲除小鼠相比,Lrp5-KO小鼠的視網膜病變視網膜更溫和,且出現骨骼畸形和代謝失常等非視網膜血管表型。
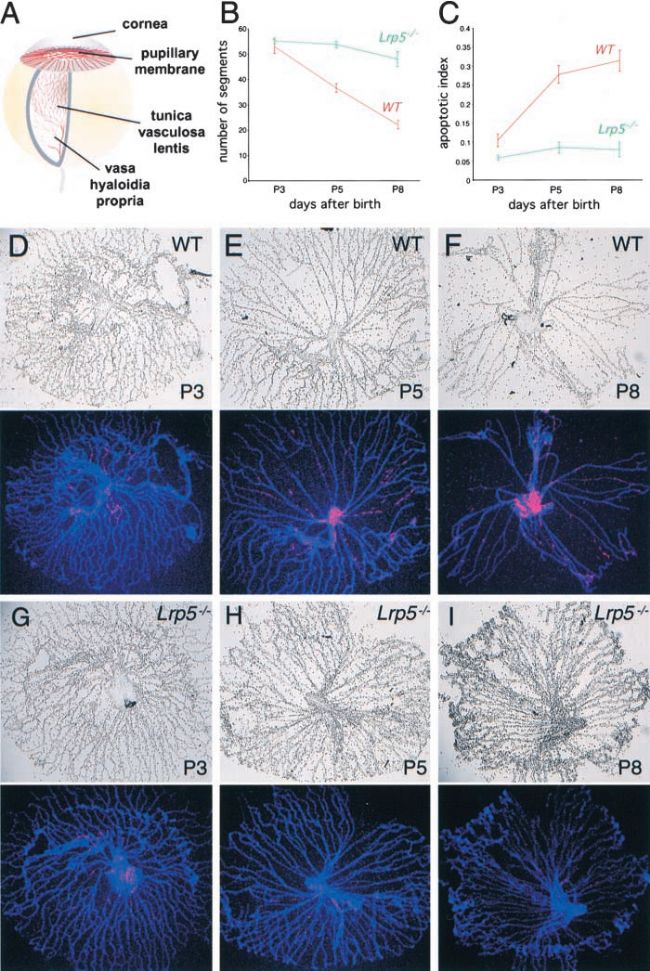
Lrp5-KO小鼠的玻璃體血管退化存在缺陷[12]
05.CTNNB1相關FEVR
CTNNB1基因編碼的β-catenin蛋白是一種粘著連接蛋白,它與鈣粘蛋白、α-catenin共同組成粘附連接復合體,通過調控細胞生長以及細胞間的粘附,在上皮細胞層的構建與維持中起著重要作用。通常認為,CTNNB1基因的缺失會導致CTNNB1綜合征,這是一種嚴重的神經發育障礙。最近的研究發現CTNNB1基因的某些功能缺失突變也會導致伴痙攣性肌癱和視力缺陷(NEDSDV)和家族性滲出性玻璃體視網膜病變(FEVR)等視網膜缺陷疾疾病[15-16]。在小鼠中的研究表明,Ctnnb1基因全身性敲除的會導致胚胎期死亡、胚胎發育異常、神經管缺陷、肝臟發育異常、腎臟發育異常和心臟發育異常等嚴重表型的出現,但鮮有視網膜表型報道。最近的一項研究發現內皮細胞特異性Ctnnb1敲除會降低Norrin/β-catenin通路的活性,從而影響視網膜血管生成。在該小鼠模型中,視網膜血管生成受到抑制,表現出FEVR樣表型[17],此外,編碼α-catenin的Ctnna1基因的內皮細胞特異性缺失同樣呈現除與Ctnnb1缺失小鼠類似的FEVR樣表型,也可用于該疾病的研究[18]。
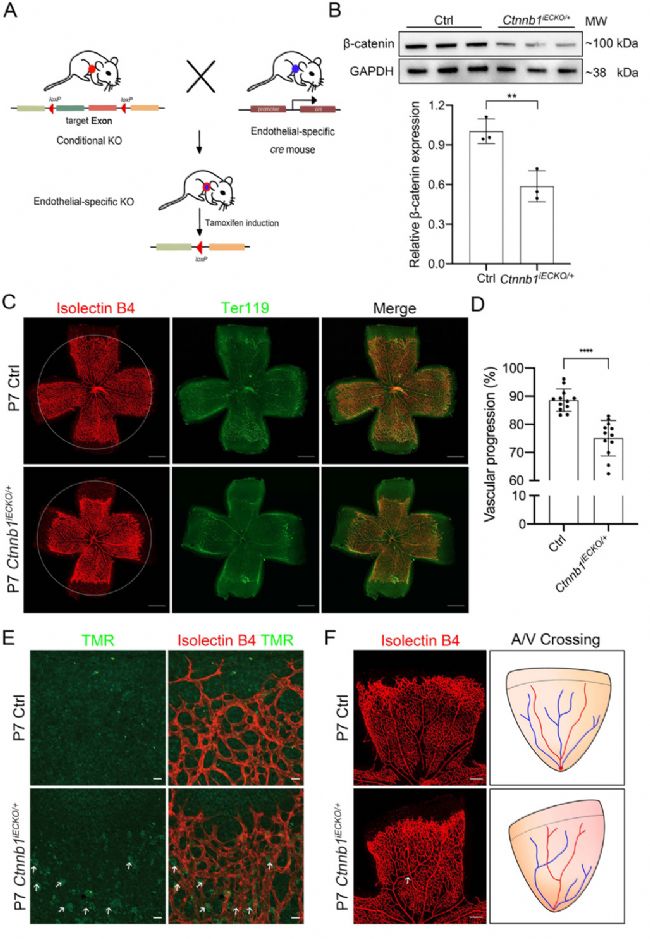
內皮細胞特異性Ctnnb1敲除的小鼠出現與FEVR類似的表型[17]
06.KIF11相關FEVR
KIF11是獨立于Norrin/β-Catenin信號通路的另一個重要的FEVR致病基因,該基因編碼的馬達蛋白參與了細胞分裂和微管動力學等生物學過程。KIF11也是視網膜母細胞中的一個重要因子,能夠調節微管動力學并參與視網膜血管的生長和分支。在人類中,KIF11的失活突變與伴或不伴小頭畸形的視網膜血管低下和以淋巴水腫,脈絡膜視網膜發育不良,小頭畸形和/或智力低下的不同組合為特征的多器官綜合征有關。研究表明,一些FEVR患者體內KIF11的突變可能影響其視網膜血管的發育和穩定,但具體機制未知。因此,Kif11基因敲除小鼠模型已被用來研究KIF11基因突變與FEVR之間的關系。最近的一項研究表明內皮細胞特異性Kif11敲除會導致小鼠視網膜血管系統嚴重發育遲緩和小腦脈管系統輕度發育遲緩[19]。內皮細胞Kif11-cKO小鼠的表型與內皮細胞Ctnnb1-cKO小鼠非常相似,進一步證明KIF11缺失與FEVR之間的密切聯系。

早期內皮細胞特異性Kif11敲除的小鼠的視網膜血管生長嚴重遲緩[19]
07.賽業生物罕見病研究資源基因編輯小鼠
小鼠基因編輯模型在罕見病機制研究和藥物研發評價中起著重要作用,賽業生物擁有數千種自主研發的基因編輯小鼠品系,可提供包括NDP,FZD4和LRP5等在內的多種基因敲除或條件性敲除罕見病研究小鼠模型。同時也可根據您的科研需求進行專業化的定制服務,加速您的課題研究。