重度免疫缺陷大鼠SRG的應用特點及支持數據
維通利華于2023年初推出重度免疫缺陷大鼠SRG(T、B、NK細胞缺失),大鼠的胸腺及脾臟高度萎縮,這種重度免疫缺陷特性,結合大鼠的生理學特性,在腫瘤學、免疫學、異種移植研究中展現獨特優勢:
1.支持更多種類的人源CDX/PDX模型建立,快速擴充腫瘤生物樣本
- 重度免疫缺陷特性,可支持更多種類人源CDX/PDX的建模
- SRG大鼠體型大,耐受力強,可承擔的腫瘤負荷是小鼠的10倍,通過少次傳代即可迅速建立、擴大腫瘤樣本庫,盡快開展項目研究。
2.SRG大鼠體型大,可在腫瘤藥效、藥代動力學、毒理學評估中發揮極大優勢
- 提供更豐富的生物樣本量(腫瘤組織、血液等)
- 同一只動物支持多次采樣,提高數據一致性
- 支持藥效、藥代動力學、毒理學多種方法分析數據
- 降低外科操作難度(采血、插管等)
- 耐受性高,壽命長,支持長期實驗
點擊獲取SRG大鼠更多信息點
研發者真正關注的問題來了:

1.Charles River 維通利華內測多種人源腫瘤細胞系CDX數據
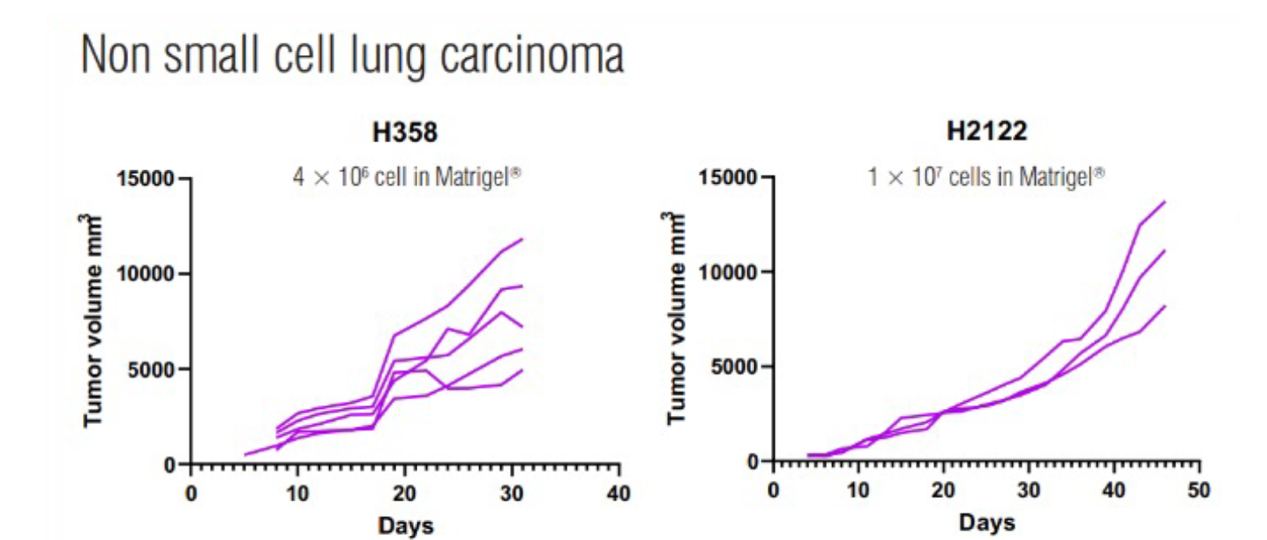
非小細胞肺癌

肺鱗狀細胞癌


前列腺癌


其他更多肺乳頭狀腺癌、腦膠質瘤、結腸癌、腎癌、乳腺癌、胰腺癌、舌鱗狀細胞癌、纖維肉瘤等等的CDX數據,是不是也很期待?
2.客戶合作:SRG大鼠的人源細胞系CDX數據

前列腺癌

結腸癌

腎癌

單核細胞白血病

以上兩部分數據,我們可以看到SRG大鼠在CDX造模的實力了,可以支持多種癌種的建模。同時,我們可以發現SRG大鼠在CDX建模的優勢:跟小鼠相比,腫瘤細胞移植量接近,但腫瘤負荷的體積可以是小鼠的10倍,腫瘤負荷可以達到20000mm3。
這樣一個優勢就在腫瘤藥效、藥代動力學、或者腫瘤轉移機制研究中發揮了重要作用:一只動物可以采集的腫瘤、血液等樣本量大,用于多維度實驗分析。
我們在上一篇SRG的介紹中,提到SRG在腫瘤藥效、藥代中的優勢。利用SRG建立的VCap腫瘤異種移植模型:
- 發現血清PSA(前列腺特異性抗體)水平與VCap腫瘤體積呈正相關。SRG大鼠可在多個時間點取材檢測并存活。而小鼠必須處死才能獲得檢測需要的血清量,所獲得數據不具有連續性,也會受個體間差異影響。
- 對SRG建立的VCap CDX模型,每周對腫瘤進行一次針刺活檢,連續四周。數據顯示,以合理科學的頻率連續采樣對動物腫瘤生長沒有明顯影響。
3.最新研究成果:與小鼠相比,SRG大鼠是研究腫瘤擴散機制更合適的模型
2023.2.28日在Cell Biology 雜志上發表的文章“Metastasis from the tumor interior and necrotic core formation are regulated by breast cancer-derived angiopoietin-like 7”中,全方位對比了SRG大鼠和NSG小鼠在揭秘腫瘤擴散轉移機制研究中的應用,發現SRG腫瘤異種移植模型可以更好地富集到腫瘤循環細胞(CTC, Circulating Tumor Cell),可以進一步更好地揭秘腫瘤擴散轉移的機制。




A:將等量4T1-GFP細胞分別移植到NSG小鼠和SRG大鼠相同的時間后,同步收集這兩種異種移植模型的腫瘤及血液樣本。
B、C:收集到的腫瘤樣本,SRG大鼠的腫瘤重量及體積分別是NSG小鼠的3倍左右,此時已達到NSG小鼠腫瘤體積的上限值(2000mm3)。
D、E、F、G:收集到的血液樣本,SRG大鼠的血液體積是NSG小鼠的10倍左右,進而產生10倍左右的單一CTCs及CTC clusters.
E、H:血液中CTC細胞的形態及比例在NSG小鼠及SRG大鼠中是一致的。
I、J:顯微鏡觀察,SRG大鼠肺轉移灶豐度是NSG小鼠的四倍左右。
研究中SRG大鼠和NSG小鼠中移植的4T1細胞數量相同,并且腫瘤是在同一時間采集的,上述結果中的直接比較數據表明,SRG大鼠移植模型將會將腫瘤轉移擴散機制研究效率提高10倍左右,因此,研究中確定使用SRG大鼠異種移植模型來進行腫瘤轉移機制的研究。
研究中發現,單一CTCs及CTC clusters豐度增加并非隨著腫瘤的生長而成線性關系,在腫瘤移植后22-27天,單一CTC豐度增加50倍,CTC clusters豐度增加10倍。進一步的研究發現,CTC細胞轉移與腫瘤壞死、血管擴張和腫瘤-壞死交界處的血管內栓塞有密切的聯系。在此研究結果的基礎上,進一步的序列分析結果發現,抑制乳腺癌衍生的血管生成素Angptl7將會使腫瘤核心的組織壞死正常化,并減少循環腫瘤細胞CTCs和腫瘤轉移的數量。
總結
越來越多的研究數據表明:SRG大鼠兼具重度免疫缺陷特性(T/B/NK細胞缺失)及大鼠的生理學特性
- 可以制備多種腫瘤異種移植CDX/PDX模型,接種等量的腫瘤細胞,可承擔的腫瘤負荷是小鼠的10倍,可在一只小鼠上采集的生物樣本(腫瘤,血液等)遠遠大于小鼠,對后續的腫瘤藥效,藥代、毒理學評估等有巨大的優勢,是腫瘤研究的巨大潛力模型。
- SRG大鼠在PDX模型建模方面優勢尤其突出,建模成功率高,可通過少次傳代即可迅速建立、擴大樣本庫,減少建庫時間。







