呼吸疾病國家重點實驗室揭示SARS-CoV-2誘發心功能障礙的機制
COVID-19相關的心功能障礙是引起患者死亡的主要危險因素之一。有研究報道,20-28%的COVID-19患者會出現不同程度的心功能障礙和心臟損傷。IL-18是IL-1家族的促炎細胞因子,作為非活性前體合成,由Caspase 1加工成活性形式后釋放。內源性IL-18已被證明會導致心肌缺血后的收縮功能障礙,而過量的IL-18可介導心臟炎癥、纖維化和室性心動過速。然而,IL-18在COVID-19相關的心功能障礙的調控和作用尚不清楚。
2023年3月9日,呼吸疾病國家重點實驗室湯海洋教授團隊在Signal Transduction and Targeted Therapy雜志在線發表了題為“SARS-CoV-2 Spike Protein Induces IL-18-mediated Cardiopulmonary Inflammation Via Reduced Mitophagy”的研究論文。該研究揭示了SARS-CoV-2誘發心功能障礙的機制,闡明了IL-18在COVID-19相關的心功能障礙的作用,為緩解心臟損傷提供了理論基礎和新的治療靶點。

圖片來源:《Signal Transduction and Targeted Therapy》
研究材料
在這項研究中,研究人員使用了hACE2人源化小鼠(賽業產品編號:C001191)、SARS-CoV-2 Spike蛋白、人肺動脈內皮細胞、人心微血管內皮細胞。
研究方法
細胞因子篩選、免疫熒光、經胸超聲心動圖、心電圖、Masson染色、免疫印跡、DHE染色等。
技術路線
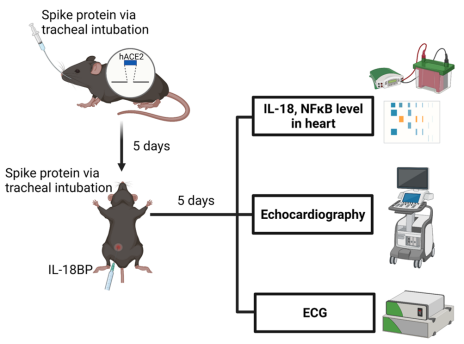
研究結果
首先,以賽業提供的人源化ACE2小鼠(hACE2)為研究對象,利用SARS-CoV-2 Spike蛋白經氣管插管刺激小鼠肺部建立COVID-19動物模型。與IgG對照組相比,Spike蛋白處理組的心臟組織中IL-18和炎性小體NLRP3表達增加,NF-κB信號通路被激活,心肌出現膠原沉積,并且心律失常、左心室舒張功能障礙風險增加。
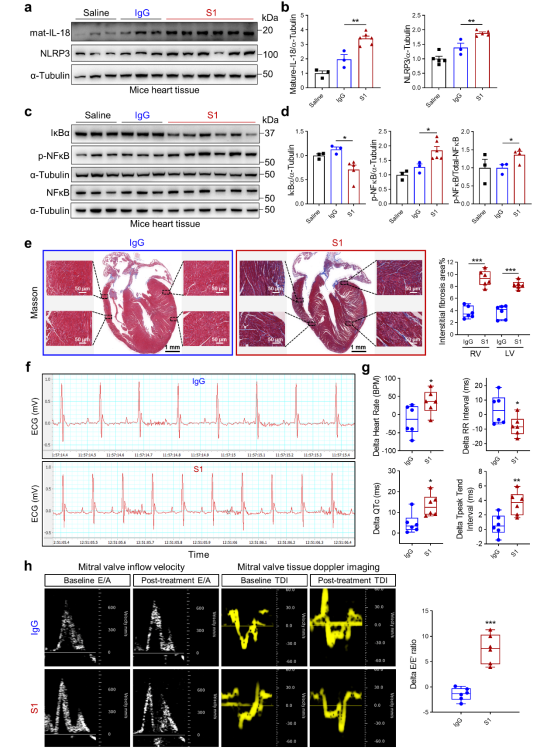
Spike蛋白引起hACE2-KI小鼠心臟IL-18表達、纖維化和心臟功能障礙的結果[1]
為了驗證IL-18在心臟損傷中的直接作用,研究者利用IL-18的誘餌受體IL-18BP注射COVID-19動物模型,發現IL-18BP可以抑制心臟組織中NF-κB激活,改善心肌膠原沉積和左心室舒張功能。
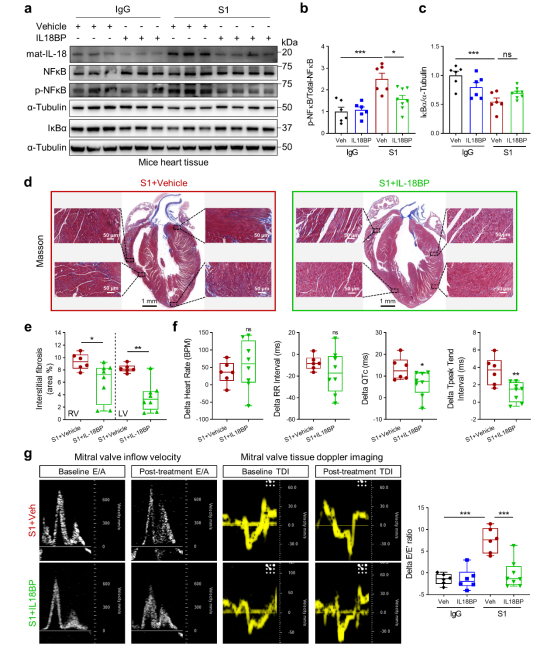
IL-18BP可減少經Spike蛋白處理的hACE2-KI小鼠的纖維化,并改善其功能[1]
眾所周知,線粒體自噬是清除損傷線粒體的重要途徑,其缺乏會導致功能障礙的線粒體積累,進一步釋放線粒體ROS,從而驅動炎性小體激活導致IL-18釋放。為了探究線粒體自噬在COVID-19動物模型IL-18活化中的作用,研究者利用線粒體自噬誘導劑UA和靶向線粒體ROS清除劑MitoQ進行動物實驗,結果表明在hACE2小鼠心肺組織中,UA能夠誘導線粒體自噬,并通過減少Spike蛋白誘導的ROS產生,抑制IL-18表達。同樣地,MitoQ處理后也抑制了IL-18表達。

刺突蛋白通過減少線粒體吞噬和增加線粒體ROS的產生來誘導IL-18的表達[1]
研究者在體外實驗中進一步驗證了線粒體自噬在IL-18活化中的作用。通過透射電子顯微鏡和免疫印跡實驗顯示,在人心血管內皮細胞和肺血管內皮細胞中,Spike蛋白同樣能夠誘導IL-18和線粒體ROS產生,抑制線粒體自噬的發生。CCCP和MitoQ刺激均可減少IL-18的表達。此外,IL-18BP可以抑制Spike蛋白誘導的血管通透性增加。
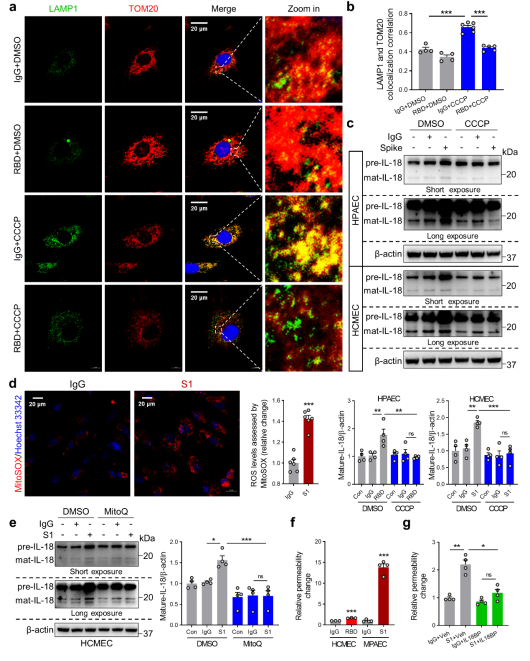
刺突蛋白通過破壞線粒體吞噬來誘導IL-18表達,導致EC通透性[1]
研究結論
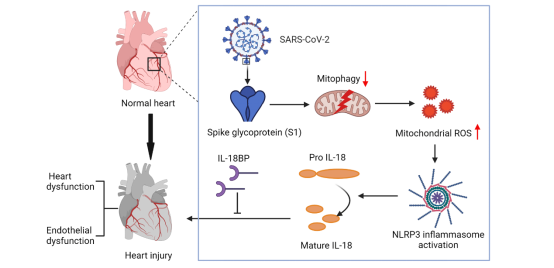
SARS-CoV-2信號通路、線粒體自噬抑制、IL-18激活及心臟損傷之間的關系示意圖[1]
該研究表明線粒體自噬缺乏和炎癥小體激活之間的聯系在COVID-19發病過程中發揮重要作用,并提示IL-18和線粒體自噬是潛在的治療靶點。
原文檢索:
[1] Liang S#, Bao C#, Yang Z, Liu S, Sun Y, Cao W, Wang T, Schwantes-An TH, Choy JS, Naidu S, Luo A, Yin W, Black SM, Wang J, Ran P, Desai AA*, Tang H*. SARS-CoV-2 spike protein induces IL-18-mediated cardiopulmonary inflammation via reduced mitophagy. Signal Transduct Target Ther, 2023 Mar 9;8(1):108.