免疫缺陷小鼠的選擇指南
免疫缺陷小鼠是指一種或多種免疫系統組成成分缺陷的小鼠。隨著基因編輯技術的不斷發展,越來越多的免疫缺陷小鼠品系被研發出來,在免疫學,傳染病學,腫瘤學,干細胞生物學等研究領域中發揮著越來越重要的作用。
品系繁多的免疫缺陷小鼠,到底應該如何選擇呢?

比較免疫缺陷小鼠時,
我們可以從以下這些方面考量:
1 遺傳背景
小鼠的遺傳背景不同會導致不同的免疫反應與表型,比如不同背景的小鼠H2單體型不同:
| Background | H2 haplotype |
| C57BL/6J | b |
| BALB/c | d |
| NOD/LtSz | g7 |
| nu/nu | q |
不同遺傳背景的Prkdcscid突變小鼠,功能淋巴細胞的泄漏程度也不同:在 C57BL/6J 和 BALB/c 背景上泄漏率高;在C3H背景上較低;在NOD背景上極低。
再例如,Nude裸小鼠就有3種不同的背景:BALB/c Nude、nu/nu、CD-1 Nude。其中BALB/c Nude為近交系,個體差異小,最常用于異種移植瘤模型的建立,成瘤所需腫瘤細胞接種量以及成瘤速度較后兩者也都具有一定的優勢;Nu/Nu和CD-1 Nude為封閉群,個體差異較大。
2 免疫系統缺失成分
不同免疫缺陷小鼠免疫系統缺失的成分不同,有缺失某種淋巴細胞的,也有缺失多種淋巴細胞的:
· T 淋巴細胞功能缺陷
例:Nude裸鼠
· B 淋巴細胞功能缺陷
例如:CBA/N小鼠
· NK細胞功能缺陷
例如:Beige小鼠
· 聯合免疫缺陷
例如:Scid小鼠、M-NSG小鼠等
3 突變基因
在研究過程中,考慮某個或某幾個基因的突變對免疫反應的影響(如NK細胞、巨噬細胞和補體活性等),以及與遺傳背景可能的相互作用。例如,β2微球蛋白(B2m)和穿孔素(Prf1)突變會降低NK細胞活性;白介素2受體γ鏈(Il2rg)突變則使NK細胞完全失活;Prkdcscid突變在NOD小鼠中會抵抗糖尿病的發生等。
免疫缺陷相關靶基因及其功能:
· Foxn1: Foxn1純合突變會導致小鼠無胸腺,無毛,T細胞缺失。因此對胸腺依賴的抗原沒有響應,不排斥同種和異種移植物移植。
· Prkdc: Prkdc(protein kinase, DNA-activated, catalytic polypeptide)基因主要編碼DNA依賴性蛋白激酶(DNA-PK)的催化亞基,是參與雙鏈DNA斷裂修復、免疫球蛋白和T細胞受體可變(V)、多樣性(D)、連接(J)區段重組的重要基因。Prkdcscid突變代表嚴重的聯合免疫缺陷,表現為缺失T、B細胞,無法介導細胞和體液免疫,不排斥同種和異種移植。
· IL2rg: Interleukin-2受體gamma鏈(IL-2Rγc,又稱CD132)是具有重要免疫功能的細胞因子Il2、Il-4、Il-7、Il-9、Il-15和Il-21的共同受體亞基,該基因敲除后的小鼠機體免疫功能嚴重降低,尤其是NK細胞的活性幾乎喪失。
· Rag1: Rag1(recombination activating gene 1)對于在T和B細胞中產生功能性抗原受體的V(D)J重排是必不可少的。Rag1缺失純合子缺乏成熟的功能性T和B細胞。NOD背景上Rag1突變可使NOD小鼠抵抗糖尿病。
· Prf1: Prf1穿孔素(perforin)也稱為成孔蛋白(PFP),在NK細胞和CD8+T細胞上都有表達,是CD8+T細胞和NK細胞通過裂解途徑殺傷靶細胞的主要毒性蛋白。
· B2m: B2m(beta-2 microglobulin)是MHC I類分子正常表達、CD8+ T細胞成熟以及NK細胞發育的必需蛋白。
看完上面的介紹,相信大家對免疫缺陷小鼠的方方面面已經有了一定的了解,那么每種免疫缺陷模型的特點是什么,主要有哪些應用方向呢,我們直接上總結表格:
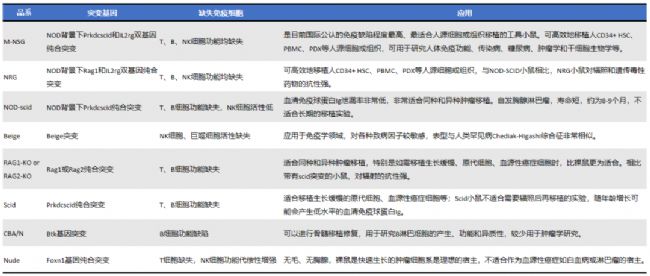
M-NSG重度免疫缺陷小鼠應用示例
我們以當前免疫缺陷程度最高,適用研究領域廣泛的重度免疫缺陷小鼠M-NSG為代表,以具體的研究案例為基礎,給大家介紹一下免疫缺陷小鼠在科研中的實際應用。
1 CDX造模
細胞株移植瘤模型 (Cell Derived Xenograft, CDX) 是將體外傳代培養的腫瘤細胞接種至免疫缺陷小鼠而形成的模型。M-NSG小鼠是CDX模型構建的理想載體,模型構建成功率高;各類人源細胞系,都可以使用 M-NSG小鼠進行皮下或原位瘤模型建立,并開展相應的體內藥理藥效學研究。M-NSG小鼠比NOD-scid和裸鼠有更明顯的CDX建模優勢。
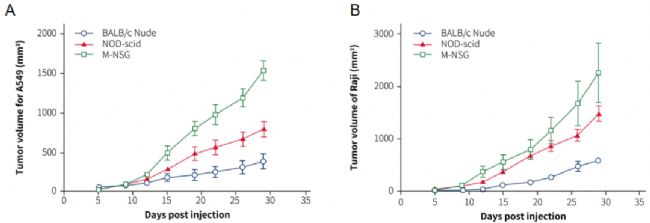
圖2. A549 肺腫瘤細胞(A)或 Raji 淋巴瘤細胞(B)在 M-NSG 小鼠上的成瘤驗證。
如上圖所示,將A549 肺腫瘤細胞系和Raji淋巴瘤細胞系分別接種到不同免疫缺陷小鼠上,在不同的時間點測量腫瘤體積,可以看到M-NSG小鼠的成瘤效果最佳。目前,我們已經驗證了近百種細胞系在M-NSG上的成瘤效果,相關成瘤數據可在南模生物官網搜索細胞系免費查閱。
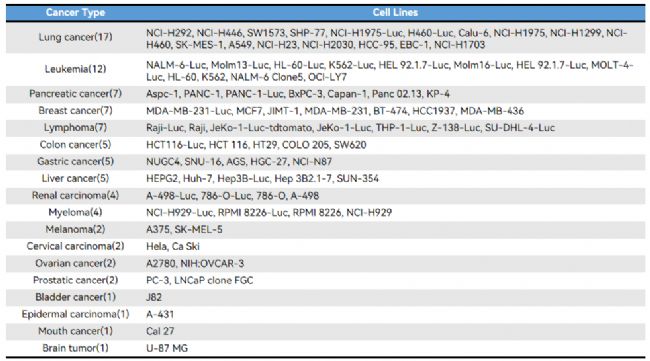
表2. 基于 M-NSG 小鼠成功建立的 CDX 模型
CDX模型可用于抗腫瘤藥物、CAR-T細胞等的藥效驗證,示例如下:
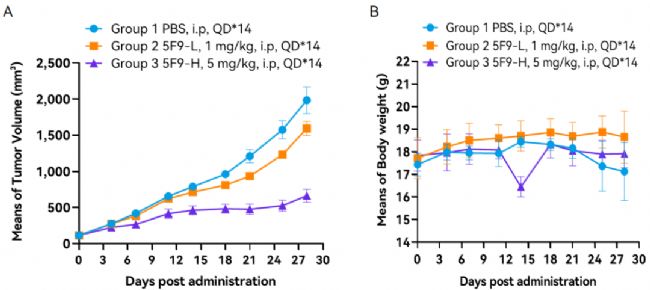
圖3. 淋巴癌(Raji)CDX模型進行抗人CD47抗體藥效驗證實驗。

圖4. 肺癌(A549)CDX模型進行CAR-T藥效驗證實驗。
2 PDX造模
人源性組織異種移植模型(patient-derivedxenografts , PDX)是將腫瘤患者的腫瘤組織移植至重癥免疫缺陷型小鼠體內而形成的模型。PDX模型可以較完整地保持患者腫瘤原有的生物學特征、病理分型、分子標志物表達、基因突變類型等,在臨床前實驗中應用廣泛。PDX模型構建流程大致如下:

圖5 PDX模型構建流程
南模生物已成功建立多個癌種的PDX模型,僅肝癌PDX模型就超過60多種。這些PDX模型可以從各方面復制病人腫瘤的異質性,包括其分子層面, 基因層面和組織層面上的復雜性。我們可以使用PDX快速測試和分析藥物療效,PDX腫瘤模型亦可以用于臨床前測試,通過模擬第二期臨床試驗中癌癥病人的規模,以幫助藥物開發。

圖6. 肝癌PDX模型成瘤驗證
3 Hu-PBMC重建
Hu-PBMC模型,或者被稱為Hu-PBL(perihperal blood lymphocyte, PBL)模型,是一種構建較為簡單和經濟的免疫系統人源化小鼠模型。Hu-PBMC模型的移植方式主要有腹腔注射與尾靜脈注射,通常以4-6周齡的M-NSG小鼠作為移植受體,PBMC移植/接種量通常在5~10*10^6/小鼠。該模型常被用于研究人效應T細胞的活化以及評估免疫抑制藥物。
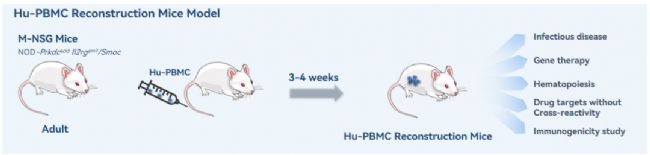
圖7 Hu-PBMC模型的構建示意圖
Hu-PBMC 模型的準備期較短。在移植PBMC后,最快一周就可以檢測到人CD3+ T細胞;大約2周左右,免疫細胞就會快速重建;大約4周左右,小鼠外周血中可檢測到約50%的人CD45+細胞,其中約90%為CD3+T細胞,CD4+: CD8+T細胞比率約為1:1。但是,Hu-PBMC模型會發生致死性的移植物抗宿主病(GvHD),程度與人T細胞的植入直接相關,可以通過小鼠體重的減輕來評估。一般移植后2-3周就會出現GvHD,因此實驗觀察窗較短。
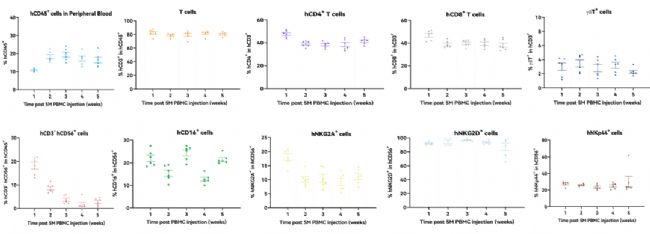
圖8. Hu-PBMC重建模型中外周血淋巴細胞亞群的分析
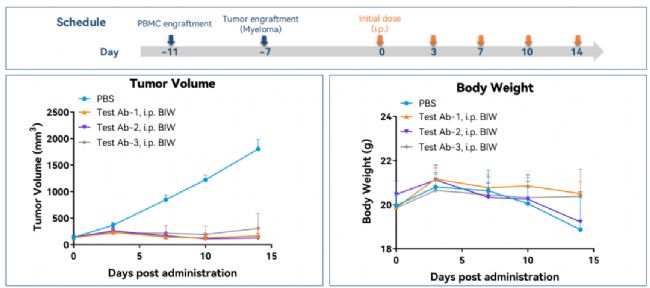
圖9. Hu-PBMC荷瘤小鼠模型抗腫瘤藥效驗證示例
4 Hu-HSC重建
Hu-HSC模型,也叫hu-CD34+,或叫hu-SRC(scid-repopulatingcell),已經被廣泛應用于研究人類造血發育、細胞介導的免疫反應以及HIV和EBV等病毒感染性疾病中。 其構建方式是將來自人臍帶血、骨髓、G-CSF激活的外周血或胎肝的人CD34+ HSCs通過靜脈內(i.v.)或股骨內(i.f.)注射到成年免疫缺陷小鼠M-NSG中,得到的小鼠可以產生多種造血干細胞。
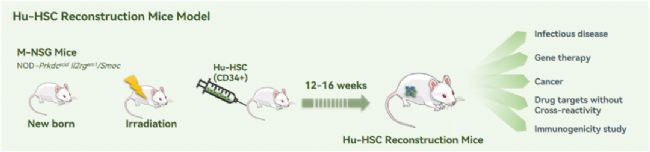
圖10 Hu-HSC模型的構建示意圖
如圖11所示,人造血干細胞 (HSCs) 移植 M-NSG 小鼠重建造血系統后,可以觀察到人源CD45+ 免疫細胞在小鼠外周血水平不斷升高,包括人源T(CD3+ CD4+和CD3+CD8+cells)、B(CD19+cells )、NK淋巴細胞(CD56+CD16+cells )及單核細胞(CD14+CD11b+cells)等。但是因為重建所用的重度免疫缺陷鼠沒有人T細胞發育所必需的人的胸腺,因此重建后的T細胞免疫功能是有缺陷的。
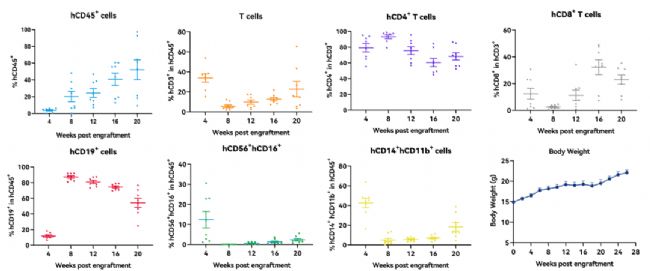
圖11. 人造血干細胞(HSCs)移植入小鼠體內20周時各類造血/免疫細胞的比例
Hu-HSC藥效驗證示例
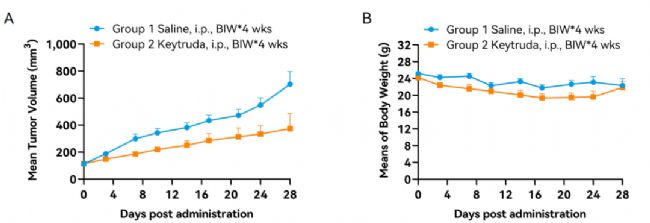
圖12. Hu-HSC荷瘤小鼠模型抗腫瘤藥效驗證示例
5 M-NSG衍生品系
隨著腫瘤免疫的進一步深入,研究者有時發現移植PBMC后,實驗窗口期不夠;髓系細胞無法在重度免疫缺陷鼠體內順利重建;人源化重建后的小鼠無法表達浸潤性巨噬細胞等。為了克服上述困難,我們進一步開發出針對這些挑戰的M-NSG衍生品系,詳見下表!
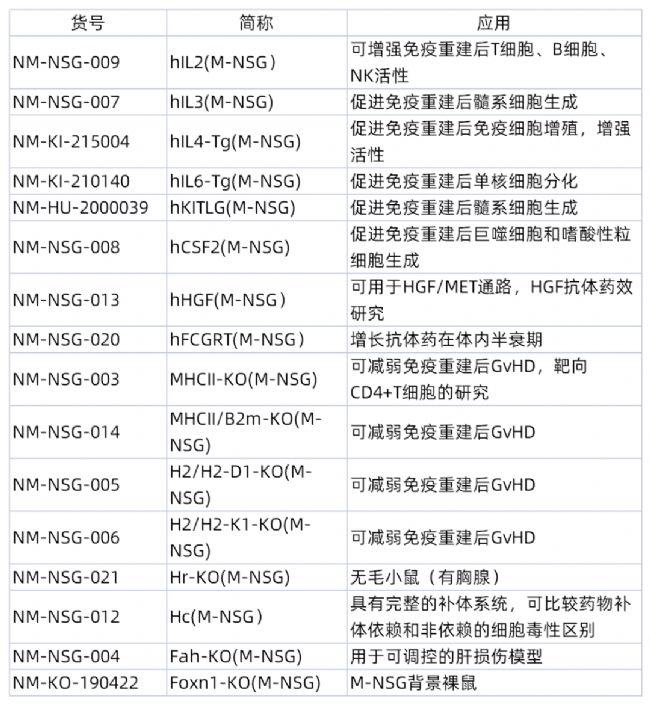
例如在M-NSG小鼠上進一步人源化IL15基因,得到的NVG-hIL15小鼠,在進行免疫系統重建時,可以得到更高比例的NK細胞,用于CAR-NK細胞治療等方面的藥效研究。
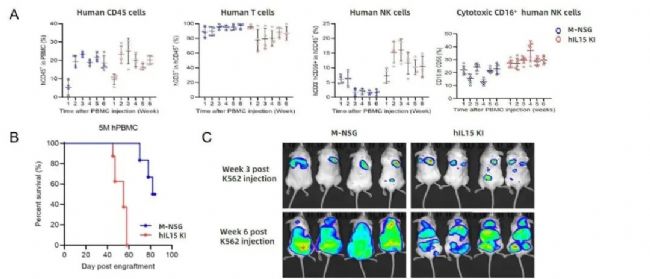
圖13. 人源PBMC來源NK細胞重建小鼠。(A) 實驗流程圖;(B) NVG-hIL15小鼠體內NK細胞比例的變化;(C) K562腫瘤細胞在NVG-hIL15小鼠體內的增殖情況。






