帕金森癥動物模型造模精解及帕金森癥發病機制
我國著名數學家陳景潤因證明哥德巴赫猜想“1+2”享譽全世界,但就在他準備對哥德巴赫猜想頂峰“1+1”發起沖擊時,他的身體卻出現了一些異常的癥狀,全身僵直、手腳顫抖、吞咽困難,病痛的折磨讓他在63歲被迫止步對數學世界的探索,而讓他遺憾折戟的疾病,是被稱為“沉默殺手”的帕金森癥。

陳景潤(1933.5.22-1996.3.19)著名數學家
認識帕金森癥(PD)
帕金森癥(Parkinson’s Disease,PD)最早由英國的醫生詹姆斯帕金森系統描述,是一種影響中樞神經系統的神經退行性疾病,主要影響運動神經系統,臨床癥狀主要包括運動癥狀(靜止性震顫、僵硬、步態異常等)和非運動癥狀(睡眠障礙、認知障礙、抑郁等)[1]。作為世界第二大神經退行性疾病,PD在全球的發病率逐年上升,由PD引起的殘疾和死亡的增長速度也超過了其他任何神經系統疾病。據WHO統計,2019年全世界超過850萬人患有PD,而其中,由PD導致殘疾的人有580萬,該數字與2000年的致殘人數對比增加了81%;由PD導致死亡的人有32.9萬人,對比2000年增加了100%。PD目前還未有針對性的治愈藥物[2]。
PD的發病機制
PD的臨床病理特征主要表現為患者的中腦特定腦區黑質致密區(SNpc)多巴胺(DA)能神經元大量凋亡,且存活的神經元內出現由α-突觸核蛋白(α-Syn)錯誤折疊、聚集所形成的路易小體(Lewy Body,LB),紋狀體DA表達水平降低。據WHO報道,PD的發病由老年化、遺傳因素、環境因素等多種因素共同影響,目前針對PD致病機理的主流學說包括神經炎癥學說、α-Syn蛋白的錯誤折疊及過表達學說、氧化應激學說、線粒體功能障礙學說等[3]。
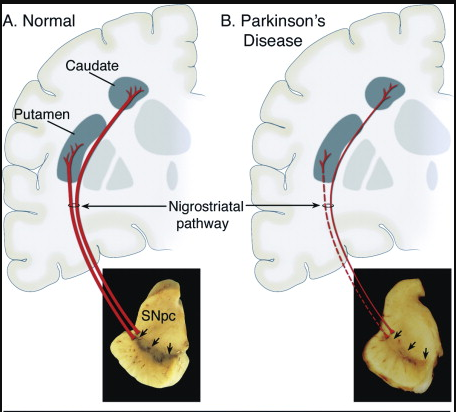
圖2 健康人與PD患者的黑質致密區多巴胺神經元存活狀態對比[4]
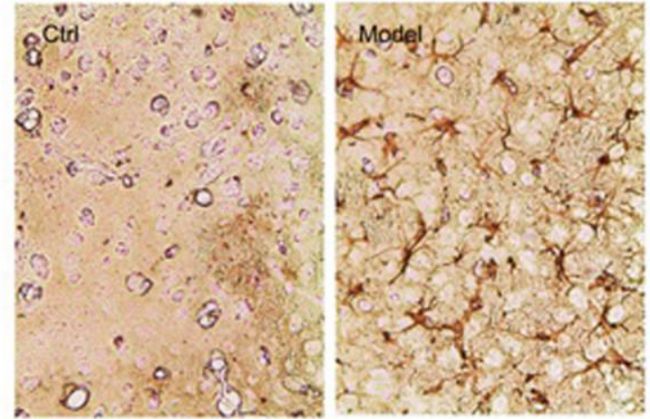
圖3 α-突觸核蛋白的聚集情況對比[5]
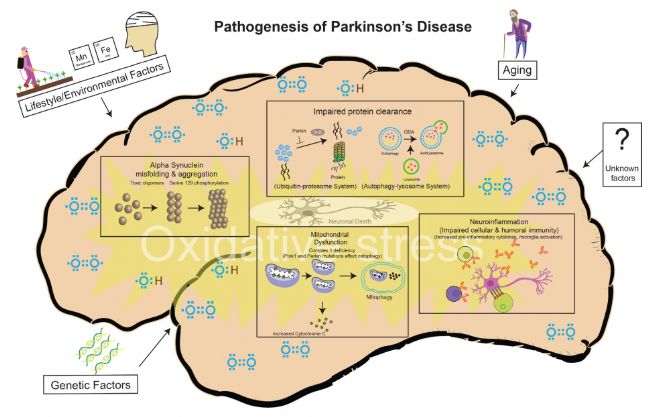
圖4 PD發病因素及致病機理[3]
PD相關動物模型
近年來,人們對帕金森病的神經生物學機制、遺傳及環境因素有了更加深入的了解,但帕金森病的新藥研發之路還是困難重重,可用的生物標志物、良好的藥物靶點及遺傳基礎等因素的探索缺乏均給藥物研發帶來了阻礙。因此,合適的疾病小鼠模型是推動PD機制研究和新藥開發不可或缺的工具。PD的動物模型主要有兩種模型構成:神經毒素模型和基因編輯模型,也有少部分文獻選用神經毒素與基因編輯復合模型,其中神經毒素模型應用最為廣泛[6]。
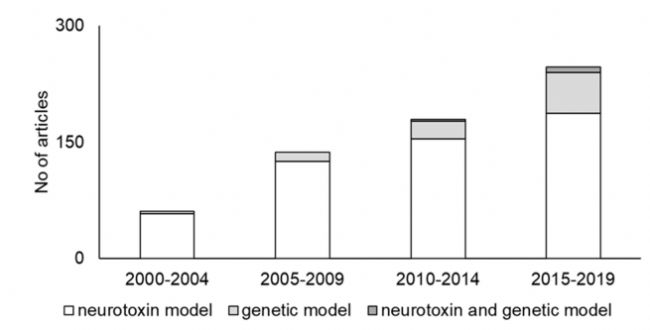
圖5 不同類型PD模型的選擇數量和趨勢[6]
(1)神經毒素模型[7]
在神經毒素模型中,最常使用神經毒素的是6-OHDA和MPTP,神經毒素模型造模手段多為全身性注射神經毒素或腦內注射神經毒素,不同的神經毒素模型,所能模擬的PD病理特征各有不同。
腦內注射6-OHDA誘導PD模型
造模方式:注射部位一般為紋狀體、內側前腦束(MFB)、黑質(SN),3-5天可檢測到注射位置DA神經元凋亡。注射到紋狀體中會破壞紋狀體中的軸突末端,隨后SN中DA神經元緩慢地逆行變性。癥狀相對較輕,進展緩慢。而注射到MFB和SN中將導致快速和大規模的DA神經元變性凋亡。
模型特征:該PD模型對比疾病臨床表型,在行為障礙表型是一致的,同時該模型可產生PD的非運動癥狀,但缺少LB形成的病理學表型。

圖6 6-OHDA在不同物種、劑量、注射部位所誘導的PD模型特征[7]
腦內或外周注射MPTP誘導PD模型
造模方式:MPTP是一種親脂性分子,能夠輕松穿過血腦屏障。全身給藥或腦內給藥后,MPTP可被星形膠質細胞中的單胺氧化酶B(MAOB)氧化成強效多巴胺能神經毒素1-甲基-4-苯基吡啶離子(MPP+)。MPP+是一種有毒代謝物,由于其結構與多巴胺相似,因此很容易被多巴胺能神經元通過多巴胺轉運蛋白(DAT)吸收[8]。隨后,MPP+誘導SN中DA神經元凋亡,同時紋狀體多巴胺水平降低[9]。DA神經元凋亡的機制是由MPP+抑制線粒體呼吸中復合物I誘導的,該過程導致紋狀體和SN中的ATP濃度迅速下降,隨后DA神經元發生凋亡[10]。
模型特征:MPTP的全身性給藥可模擬PD進行性的病理過程,包括紋狀體和黑質區的DA神經元丟失、腦部的氧化應激、線粒體功能障礙,但同樣,該模型也缺少LB形成的病理學表型[7]。在神經毒素模型中,LB形成的這一病理學表型可在魚藤酮誘導的PD模型中可觀察到[11]。
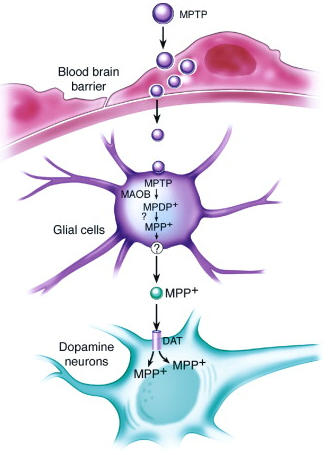
圖7 MPTP誘導DA神經元凋亡機制[4]
(2)基因編輯模型[12]
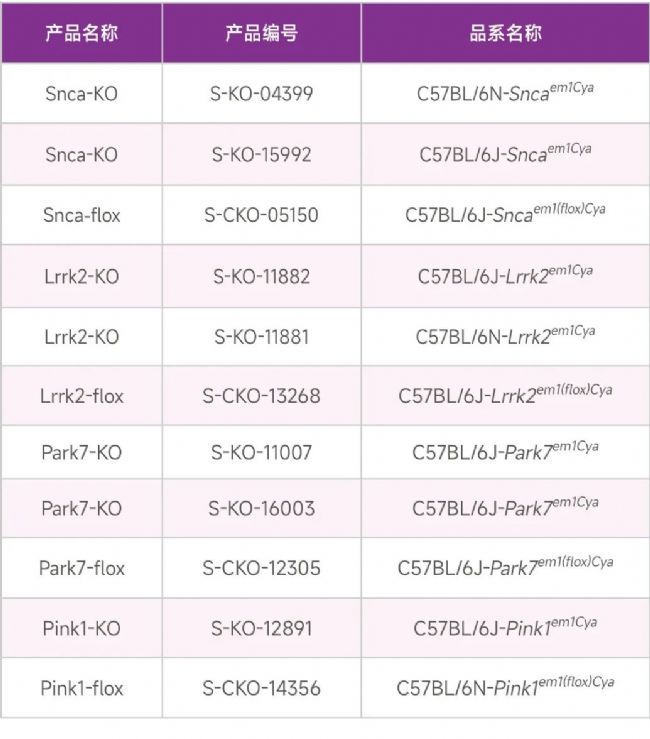
遺傳學在PD發病機制中也發揮著重要作用。通過對家族性PD和特發性PD的分析確定了PD存在以下致病基因:SNCA(表α-Synuclein應為SNCA)、Parkin、DJ-1、PINK1和LRRK2。

對于PD研究,賽業生物“找小鼠,上紅鼠”小鼠資源庫能為科研人員提供包括以上PD相關致病基因在內的KO/CKO品系,只需輸入基因名稱即可快速查詢品系狀態與基因信息,其中還附帶了全新升級的基因敲除技術方案(由大型AI生物信息數據庫RDDC提供支持)。
PD的評價手段主要圍繞神經行為學、分子生物學和免疫組化為主。賽業生物表型分析平臺,擁有專業表型實驗設備及記錄分析系統,可提供標準化的表型分析服務,如神經行為學、影像學分析、生理生化分析、病理學分析、基因與蛋白表達分析、代謝分析、細胞功能檢測等,真正給客戶提供一個完整的系統化服務平臺,做到信息進來、信息出去,中間的模型制作、繁育、表型分析等工作全部由賽業生物承擔。歡迎掃碼或點擊了解詳情,并與我們聯系。





