新冠研究好幫手,小鼠模型的選擇與研究應用
動物模型在幫助快速開發疫苗、藥物預防和治療,以及了解SARS-CoV-2感染的發病機制和宿主免疫反應方面有著重要意義。盡管非人靈長類動物的生理特征和免疫調節等方面與人類高度保守,是SARS-CoV-2病毒研究的首選動物模型。但是隨著研究需求增長,經濟及時間成本不斷攀升,能夠穩定遺傳的定點打靶基因編輯小鼠有望成為一種高普適性的動物研究模型。
血管緊張素轉換酶2(ACE2)是SARS-CoV-2病毒侵入人體最主要的細胞表面受體,但由于物種間的差異,SARS-CoV-2病毒無法與野生型嚙齒動物的ACE2受體結合,但通過基因編輯技術將小鼠Ace2替換為人源ACE2,就可以獲得穩定表達人類ACE2受體的人源化ACE2小鼠(hACE2),相關的研究已經證明了hACE2小鼠的SARS-CoV-2病毒易感性,并且在不同的研究方向上都發揮著作用。
新冠小鼠推薦
賽業生物利用自主研發的TurboKnockout技術和經過優化的CRISPR-Pro技術制備了BALB/c、C57BL/6J、C57BL/6N三種背景品系的ACE2小鼠,并設計了多種基因打靶方案,以滿足客戶在基礎研究和新藥研發的動物模型需求。
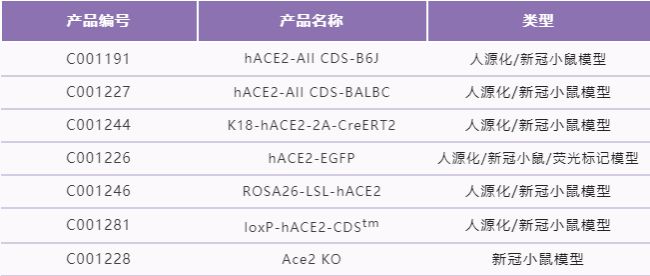
其中,熱門動物模型hACE2-All CDS-B6J和K18-hACE2-2A-CreERT2小鼠品系,即刻訂購,可快至1周發貨!
▶ hACE2-All CDS-B6J活體小鼠
小鼠模型使用人的ACE2 CDS取代小鼠內源性的Ace2序列(保留了小鼠信號肽序列),實現由小鼠內源性Ace2調控元件指導hACE2的表達。基因位于X染色體上,純合子雌性和半合子雄性是可存活且可育的。
▶ K18-hACE2-2A-CreERT2活體小鼠
小鼠模型在人角蛋白K18啟動子的驅動下,在上皮細胞表達人源ACE2,包括開始受感染的氣道上皮細胞。小鼠模型帶有CreERT2元件,可使用Tamoxifen誘導型Cre工具鼠對其進行時間特異性調控表達。
K18-hACE2小鼠可以感染SARS-CoV-2病毒,導致嚴重的疾病,其特征在于體重減輕,呼吸迅速,駝背的姿勢和不活動。這些小鼠以劑量依賴的方式對病毒攻擊作出反應,從而允許研究高病毒滴度攻擊的小鼠的嚴重急性呼吸道疾病以及低劑量輕度感染的長期影響。
精選應用案例
賽業生物的新冠小鼠模型幫助廣大研究人員在SARS-CoV-2相關項目中取得突破性進展,其應用方向包括病毒感染機制研究、疫苗開發評價、預防藥物篩選、并發癥研究、抗體藥物開發驗證等。
▶ 新冠病毒感染機制研究
目前的研究已經證明在SARS-CoV-2感染過程中與ACE2受體的結合部位是病毒的Spike刺突(S)蛋白,但是兩者結合后的分子和細胞機制仍不清楚。研究人員使用了上皮細胞特異性啟動子K18驅動的K18-hACE2-2A-CreERT2小鼠(產品編號:C001244),最終揭示了SARS-CoV-2病毒感染過程中刺突水解產生S2’片段以及該片段在病毒和受體之間的識別、膜融合等過程中發揮的作用[1]
▶ 新冠疫苗開發評價
接種疫苗是控制和預防COVID-19大流行的首選方法,開發長效抗感染的SARS-CoV-2疫苗仍然是十分迫切的。研究人員利用hACE2-All CDS-BALBC小鼠(產品編號:C001227)對新開發的疫苗進行了驗證,證明了基于mSM病毒樣顆粒和Al/CpG佐劑的疫苗是一種在預防COVID-19大流行中極具運用前景的候選疫苗[2]。
▶ 新冠預防藥物篩選
研究顯示將ACE2蛋白水平降低一半就可以顯著降低SARS-CoV-2的感染,提示部分降低ACE2蛋白水平可能是預防SARS-CoV-2感染的新策略之一。研究人員利用hACE2-All CDS-B6J小鼠(產品編號:C001191)進行藥物篩選,發現了天然化合物維生C(VitC)可以降低ACE2蛋白水平以預防SARS-CoV-2感染,并對其作用機制作了進一步研究[3]。
▶ 新冠并發癥研究
SARS-CoV-2主要通過呼吸道感染導致肺部炎癥、發燒等臨床癥狀,但同時也存在嗅覺喪失、緊張性精神分裂癥、消化疾病、血小板減少和睪丸損傷等多種并發癥,了解不同并發癥的發病機制對于患者疾病的治療同樣十分重要。研究人員使用hACE2-All CDS-B6J小鼠(產品編號:C001191)作為驗證模型,確定了SARS-CoV-2 Spike刺激后的腸道中VEGF過量產生的分子機制,證明了ERK/VEGF是COVID-19腸道炎癥和疾病進展的潛在生物標志物和治療靶點[4]。
▶ 抗體藥物開發驗證
在SARS-CoV-2流行過程中,病毒也在不斷的發生變異,Delta和Omicron等多個致病性或傳播力更強的變異株的出現給疾病的預防和治療帶來了相當大的挑戰,迫切需要更多且有效的預防和治療策略,而廣譜性中和抗體則是應對的策略之一。研究人員使用了hACE2-All CDS-B6J小鼠(產品編號:C001191)用于評估R1-32抗體的體內保護效果,證實了R1-32對SARS-CoV-2的感染具有保護活性[5]。
參考文獻:
[1]Yu, Shi., Yu, Shi., Zheng, Xu., Zheng, Xu., and Zhou, Bingjie.. "SARS-CoV-2 spike engagement of ACE2 primes S2' site cleavage and fusion initiation." Proceedings of the National Academy of Sciences of the United States of America 119.1(2022).
[2]Chen, Jing., Chen, Jing., Xu, Wang., Li, Letian., and Yi, Lichao.. "Immunogenicity and protective potential of chimeric virus-like particles containing SARS-CoV-2 spike and H5N1 matrix 1 proteins." Frontiers in cellular and infection microbiology.
[3]Yibo Zuo, Zhijin Zheng, Yingkang Huang, Jiuyi He, Lichao Zang, and Tengfei Ren.. "Vitamin C is an efficient natural product for prevention of SARS-CoV-2 infection by targeting ACE2 in both cell and in vivo mouse models." bioRxiv.
[4]Zeng, Fa-Min., Zeng, Fa-Min., Li, Ying-Wen., Deng, Zhao-Hua., and He, Jian-Zhong.. "SARS-CoV-2 spike spurs intestinal inflammation via VEGF production in enterocytes." EMBO molecular medicine 14.5(2022):e14844.
[5]Xiaoli Xiong, Ping He, Banghui Liu, Xijie Gao, Qihong Yan, and Rongjuan Pei.. "A population antibody response against SARS-CoV-2 with differential neutralization activities towards the Delta and Omicron variants." Research Square.






