文獻解讀:抑郁癥的影響因素及研究模型
抑郁癥是最常見的情感障礙疾病,2020年據世界衛生組織統計,全球預計現有3.5億人患有抑郁癥,但是抑郁癥的發病機制目前尚未完全清楚。因此,了解抑郁癥的影響因素,以此為基礎來研究人類抑郁癥的發生、發展和防治措施舉足輕重。本文節選、翻譯于《The future of rodent models in depression research》,梳理了常見的5個抑郁癥影響因素以及重點介紹了應激因素下的多個動物模型。后續我們將整理抑郁癥模型的檢測方法Protocol和其他情緒類的資料分享,敬請期待。
現已發布:精神分裂、藥物成癮、學習記憶部分Protocol,感興趣的朋友可以上方點擊查看我們往期文章。
影響因素一
應激/壓力(Stress)
生物體對應激暴露的反應,取決于它是否有能力激活有效的應對策略,使其能夠適當地處理應激并保持內在平衡。應激誘導的精神病理狀態,如重度抑郁,主要表現為應對策略的不足或失調。
慢性社交挫敗應激(Chronic social defeat stress,簡稱CSDS):
慢性社交挫敗應激是建立應激誘發抑郁癥模型中最流行的臨床前范式之一,能在各年齡段雄性和雌性嚙齒類動物中模擬,且這一模型與人類生活具有高度的轉化相關性(Pryce et al., 2017)。模型建立原理是將受試的嚙齒動物與具有攻擊性的嚙齒動物放一起,使其感受社交挫敗應激。這一模型下的動物通常會表現出一些類似抑郁的行為(如社交回避行為、蔗糖偏好降低、獎勵閾值增加、懸尾試驗和強迫游泳試驗中不動性狀態增加、認知障礙和快速動眼睡眠期異常等)。 
社交接觸不穩定性(Social instability):
社交接觸不穩定性模型可以在各年齡段雄性和雌性嚙齒類動物中模擬,通過改變籠子里的伴侶或通過將動物在社交隔離和社交擁擠的不同狀態之間輪換來實現。經歷此模擬的嚙齒動物除了表現出各種神經分子表達差異外,還表現出一系列類似焦慮和抑郁的行為(Nowacka- Chmielewska et al., 2017)。 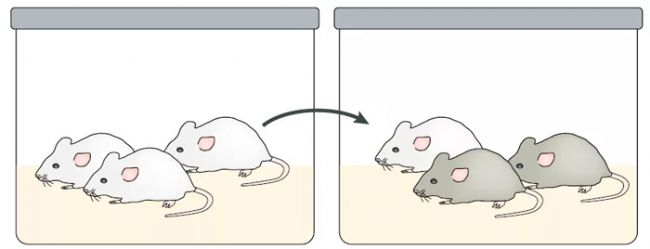
滿足感缺失(Loss of enrichment):
有關研究(Holmes et al., 1967)表明,與所愛的人失去正常聯系(如離婚或監禁)是個人生活中壓力最大的五件事之一,而滿足感缺失模型即用于模擬人類生活中的這種失落感。此模型的建立的原理是將動物前期放在各方面令其滿足的環境中,再隨后將環境改變使得令其滿足的條件都消除,通過識別某些條件的消除能引起動物類似抑郁的表型來明確模型建立的具體方法;在嚙齒類動物中,消除物質滿足感遠比消除社交滿足感的影響大得多。
應激的社交傳遞(Social transmission of stress):
一項臨床研究報告(Wojcicki et al., 2015)稱,目睹母親抑郁的兒童出現神經發育問題的幾率增加。這一現象在抑郁癥研究中稱之為應激的社交傳遞。在嚙齒動物模型中,會通過以下方法來模擬這一現象:將一只未受應激的動物與一只受過應激的同類動物放在一起,或者讓這只未受過應激的動物見證另一個同類動物受應激的過程,這些影響會導致原本未受應激的動物出現抑郁類癥狀。需要注意的是,這一模型在嚙齒類動物中存在性別差異:雌性個體之間會緩沖這種應激的社交傳遞的影響,而雄性個體之間則加劇這種影響。 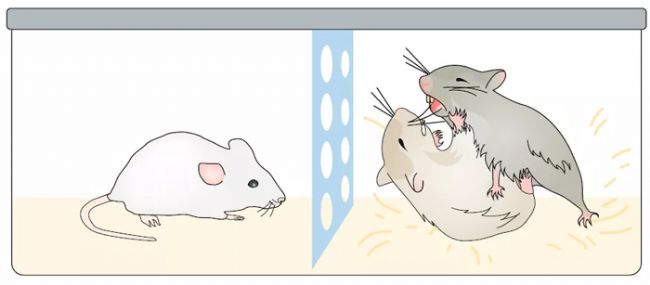
早期經歷應激(Early life stress):
不利的早期生活經歷,如童年被忽視,是發展精神障礙(如抑郁癥)的重要風險因素(Infurna et al., 2016)。在抑郁癥的動物模型研究中,母系分離是這一模型最好的模擬方法,即在動物的幼年期將其與母本分離。這一模型并不適用于所有動物類型,也存在性別差異,目前僅在雌性小鼠的模型研究中發現類似抑郁的行為,且這種抑郁行為在動物幼年期即出現,在成年期更為嚴重。 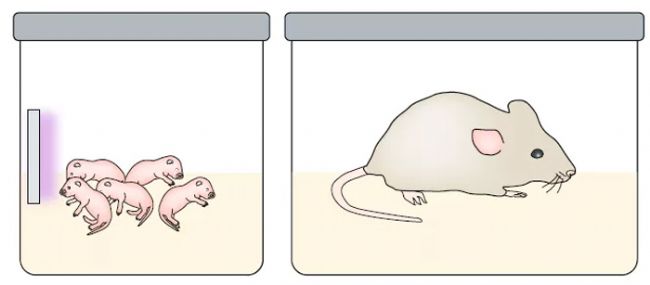
皮質酮增多(Corticosterone supplementation.):
抑郁癥的主要臨床特征之一是下丘腦-垂體-腎上腺軸(HPA)異常活動,且這種活動受抑郁癥的臨床亞型的影響。HPA高活性發生在憂郁型抑郁癥中,這與外周血管皮質醇水平的增加有關;而HPA低活性或正常的皮質醇水平則出現在非典型抑郁癥中。HPA軸失調與負反饋系統障礙相關,負反饋系統障礙之后調節應激誘導的皮質醇(嚙齒類動物中的皮質酮)釋放到外周循環中,由此產生的下游效應造成抑郁癥的神經分子和行為表型(Anacker et al., 2011)。
在臨床前研究中,通過在嚙齒類動物模型中注射、皮下埋植、微型滲透微型泵等方法實現皮質酮給藥,或將皮質酮添加到動物的飲用水中,從而來模擬HPA亢進的模型。然而,此模型很難控制皮質酮輸送速率和血漿水平的一致性,可通過單獨飼養(但這本身就是一個應激條件)、植入跟蹤芯片或建立閾值等方法改善。 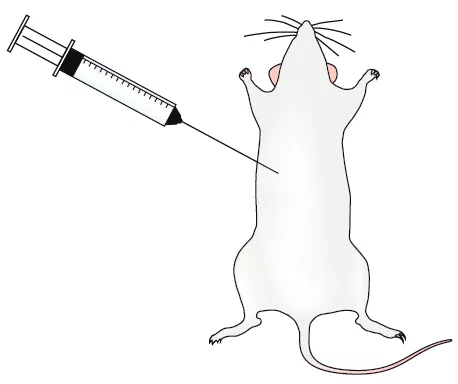
習得性無助(Learned helplessness):
習得性無助是一種狀態:個體認為他們既無法逃脫也無法控制他們所處的壓力環境;這種狀態進一步增加了它們對所處環境的厭惡。在嚙齒類動物模型中,習得性無助誘發抑郁行為的兩個重要特征(Maier et al., 2016)是,它們源于厭惡體驗(如電擊)的不可控或不可避免的性質,而不是體驗本身;且這一體驗獨立于環境。常見的造模方式有通過穿梭箱等設備連續給予動物無法控制或預知的厭惡性刺激(如電擊)。習得性無助通常是短暫的,但可以通過將動物再次放于原始應激源的環境中(即使不再給電擊)來延長這種情緒。 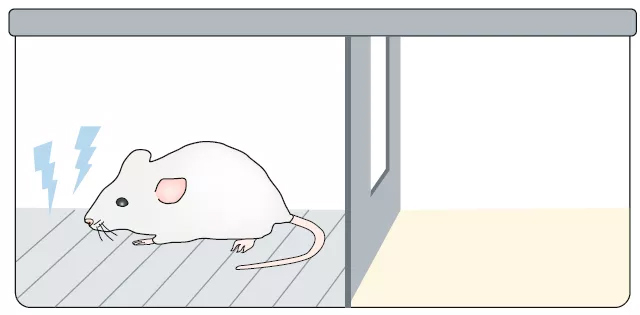
影響因素二

【原文獻】
Gururajan A., Reif A., Cryan J. F., et al., The future of rodent models in depression research[J]. Nat Rev Neurosci. 20. 686-701(2019).
【參考文獻】
1.Pryce, C. R. & Fuchs, E. Chronic psychosocial stressors in adulthood: studies in mice, rats and tree shrews. Neurobiol. Stress 6, 94–103 (2017).
2.Nowacka- Chmielewska, M. M., Kasprowska-Liskiewicz, D., Barski, J. J., Obuchowicz, E. & Malecki, A. The behavioral and molecular evaluation of effects of social instability stress as a model of stress- related disorders in adult female rats. Stress 20, 549–561 (2017).
3.Holmes, T. H. & Rahe, R. H. The social readjustment rating scale. J. Psychosom. Res. 11, 213–218 (1967).
4.Wojcicki, J. M. et al. Telomere length is associated with oppositional defiant behavior and maternal clinical depression in Latino preschool children. Transl Psychiatry 5, e581 (2015).
5.Infurna, M. R. et al. Associations between depression and specific childhood experiences of abuse and neglect: a meta- analysis. J. Affect. Disord. 190, 47–55 (2016).
6.Anacker, C., Zunszain, P. A., Carvalho, L. A. & Pariante, C. M. The glucocorticoid receptor: pivot of depression and of antidepressant treatment? Psychoneuroendocrinology 36, 415–425 (2011).
7.Maier, S. F. & Seligman, M. E. Learned helplessness at fifty: insights from neuroscience. Psychol. Rev. 123, 349–367 (2016).
8.Barr, A. M. & Markou, A. Psychostimulant withdrawal as an inducing condition in animal models of depression. Neurosci. Biobehav. Rev. 29, 675–706 (2005).
9.Maes, M. et al. Immune disturbances during major depression: upregulated expression of interleukin-2 receptors. Neuropsychobiology 24, 115–120 (1990).
10.Otte, C. et al. Major depressive disorder. Nat. Rev. Dis. Prim. 2, 16065 (2016).
11.Bowers, M. E. & Yehuda, R. Intergenerational transmission of stress in humans. Neuropsychopharmacology 41, 232–244 (2016).
現已發布:精神分裂、藥物成癮、學習記憶部分Protocol,感興趣的朋友可以上方點擊查看我們往期文章。
影響因素一
應激/壓力(Stress)
慢性社交挫敗應激(Chronic social defeat stress,簡稱CSDS):
慢性社交挫敗應激是建立應激誘發抑郁癥模型中最流行的臨床前范式之一,能在各年齡段雄性和雌性嚙齒類動物中模擬,且這一模型與人類生活具有高度的轉化相關性(Pryce et al., 2017)。模型建立原理是將受試的嚙齒動物與具有攻擊性的嚙齒動物放一起,使其感受社交挫敗應激。這一模型下的動物通常會表現出一些類似抑郁的行為(如社交回避行為、蔗糖偏好降低、獎勵閾值增加、懸尾試驗和強迫游泳試驗中不動性狀態增加、認知障礙和快速動眼睡眠期異常等)。

社交接觸不穩定性(Social instability):
社交接觸不穩定性模型可以在各年齡段雄性和雌性嚙齒類動物中模擬,通過改變籠子里的伴侶或通過將動物在社交隔離和社交擁擠的不同狀態之間輪換來實現。經歷此模擬的嚙齒動物除了表現出各種神經分子表達差異外,還表現出一系列類似焦慮和抑郁的行為(Nowacka- Chmielewska et al., 2017)。

滿足感缺失(Loss of enrichment):
有關研究(Holmes et al., 1967)表明,與所愛的人失去正常聯系(如離婚或監禁)是個人生活中壓力最大的五件事之一,而滿足感缺失模型即用于模擬人類生活中的這種失落感。此模型的建立的原理是將動物前期放在各方面令其滿足的環境中,再隨后將環境改變使得令其滿足的條件都消除,通過識別某些條件的消除能引起動物類似抑郁的表型來明確模型建立的具體方法;在嚙齒類動物中,消除物質滿足感遠比消除社交滿足感的影響大得多。
應激的社交傳遞(Social transmission of stress):
一項臨床研究報告(Wojcicki et al., 2015)稱,目睹母親抑郁的兒童出現神經發育問題的幾率增加。這一現象在抑郁癥研究中稱之為應激的社交傳遞。在嚙齒動物模型中,會通過以下方法來模擬這一現象:將一只未受應激的動物與一只受過應激的同類動物放在一起,或者讓這只未受過應激的動物見證另一個同類動物受應激的過程,這些影響會導致原本未受應激的動物出現抑郁類癥狀。需要注意的是,這一模型在嚙齒類動物中存在性別差異:雌性個體之間會緩沖這種應激的社交傳遞的影響,而雄性個體之間則加劇這種影響。

早期經歷應激(Early life stress):
不利的早期生活經歷,如童年被忽視,是發展精神障礙(如抑郁癥)的重要風險因素(Infurna et al., 2016)。在抑郁癥的動物模型研究中,母系分離是這一模型最好的模擬方法,即在動物的幼年期將其與母本分離。這一模型并不適用于所有動物類型,也存在性別差異,目前僅在雌性小鼠的模型研究中發現類似抑郁的行為,且這種抑郁行為在動物幼年期即出現,在成年期更為嚴重。

皮質酮增多(Corticosterone supplementation.):
抑郁癥的主要臨床特征之一是下丘腦-垂體-腎上腺軸(HPA)異常活動,且這種活動受抑郁癥的臨床亞型的影響。HPA高活性發生在憂郁型抑郁癥中,這與外周血管皮質醇水平的增加有關;而HPA低活性或正常的皮質醇水平則出現在非典型抑郁癥中。HPA軸失調與負反饋系統障礙相關,負反饋系統障礙之后調節應激誘導的皮質醇(嚙齒類動物中的皮質酮)釋放到外周循環中,由此產生的下游效應造成抑郁癥的神經分子和行為表型(Anacker et al., 2011)。
在臨床前研究中,通過在嚙齒類動物模型中注射、皮下埋植、微型滲透微型泵等方法實現皮質酮給藥,或將皮質酮添加到動物的飲用水中,從而來模擬HPA亢進的模型。然而,此模型很難控制皮質酮輸送速率和血漿水平的一致性,可通過單獨飼養(但這本身就是一個應激條件)、植入跟蹤芯片或建立閾值等方法改善。

習得性無助(Learned helplessness):
習得性無助是一種狀態:個體認為他們既無法逃脫也無法控制他們所處的壓力環境;這種狀態進一步增加了它們對所處環境的厭惡。在嚙齒類動物模型中,習得性無助誘發抑郁行為的兩個重要特征(Maier et al., 2016)是,它們源于厭惡體驗(如電擊)的不可控或不可避免的性質,而不是體驗本身;且這一體驗獨立于環境。常見的造模方式有通過穿梭箱等設備連續給予動物無法控制或預知的厭惡性刺激(如電擊)。習得性無助通常是短暫的,但可以通過將動物再次放于原始應激源的環境中(即使不再給電擊)來延長這種情緒。

影響因素二
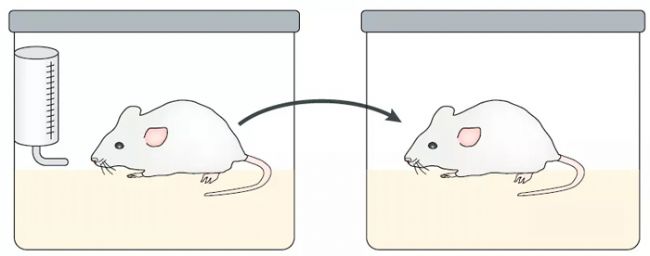
藥物誘導的戒斷反應(Drug- induced withdrawal)
有數據支持,抑郁癥和藥物戒斷在癥狀和病理生理學上表現出高度的相關性和重疊性(Barr et al., 2005)。相關研究標明,抑郁癥不僅與可卡因和安非他明等精神刺激劑的戒斷相關,也與包括阿片類、尼古丁和酒精等在內的其他物質的戒斷有關。研究這一動物模型有助于研究藥物濫用與抑郁癥共病的臨床癥狀。通常,用一套操作箱設備讓動物實現自我給藥或顱內自我刺激,給動物制定遞增劑量或恒定劑量的習慣化給藥方案之后停藥,停藥期間,動物自我刺激的閾值升高,提示快感減退,隨即出現抑郁行為。

影響因素三
免疫系統相關的模型(Immune system- based models)
自1990年的研究表明抑郁癥與炎癥與T細胞活化相關(Maes et al., 1990)以來,近30年里關于抑郁癥與炎癥之間的聯系被大眾廣泛接受與研究。目前已經開發了許多基于免疫系統的模型來研究重度抑郁癥和其他精神疾病,例如母體免疫激活和脂多糖內毒素(如脂多糖S)或促炎細胞因子(如干擾素-α)的給藥等模型。另一方面,大量文獻表明嚙齒類動物應對社會應激時會導致與多種神經遞質和神經肽系統改變相關的持續性神經炎癥,而這些改變和炎癥可能是動物面對應激后觀察到抑郁行為表型的基礎。免疫系統相關的模型(Immune system- based models)
影響因素四
性別差異(Sex differences)
在現實生活中,抑郁癥的群體分布以及一些抗抑郁藥物的治療上存在性別差異。盡管抑郁癥在女性中比男性更普遍(幾乎是2:1)(Otte et al., 2016),但絕大多數臨床前和臨床研究都是在男性個體中進行的。最初,這種方法產生的原因是人們認為,在動物發情周期的不同階段,雌性獲得的數據比雄性的數據更不穩定。然而,對臨床前數據的meta分析表明,在一系列行為、生理或分子特征方面,處于發情階段的雌性嚙齒動物與雄性嚙齒動物在數據上沒有差異,而事實上,影響該數據的最大因素是動物的飼養環境。盡管如此,生活中男性和女性個體在情緒的基礎水平以及對外界刺激(如壓力或藥物)的反應上通常是不同的。目前雖尚無明確機制闡明性別因素在抑郁癥發生發展中的差異,但在動物模型中的一些見解有望提供關于情緒障礙性別差異的致病機制和當前抗抑郁治療反應的重要信息。性別差異(Sex differences)
影響因素五
代際/隔代遺傳的應激(Inter- and transgenerational stress)
越來越多的流行病學證據引發出一個理論:壓力誘發的精神病理學(如抑郁癥)可通過代際和隔代遺傳的方式傳遞(Bowers et al., 2016)。為了研究這個現象,雄性動物在受孕前和雌性動物在妊娠期或產后都可能受到應激的影響,然后觀察其后代是否出現類似的抑郁行為,旨在理解遺傳譜系對抑郁癥發病風險的影響。但是這一方法同時也備受爭議,主要是因為實驗結果的穩定性值得懷疑,以及在人類中一些能產生多重效應的現實因素(如環境和文化傳承的作用等)在研究中沒有被考慮到。
代際/隔代遺傳的應激(Inter- and transgenerational stress)

想要了解更多干貨內容,添加客服微信吧~

Gururajan A., Reif A., Cryan J. F., et al., The future of rodent models in depression research[J]. Nat Rev Neurosci. 20. 686-701(2019).
【參考文獻】
1.Pryce, C. R. & Fuchs, E. Chronic psychosocial stressors in adulthood: studies in mice, rats and tree shrews. Neurobiol. Stress 6, 94–103 (2017).
2.Nowacka- Chmielewska, M. M., Kasprowska-Liskiewicz, D., Barski, J. J., Obuchowicz, E. & Malecki, A. The behavioral and molecular evaluation of effects of social instability stress as a model of stress- related disorders in adult female rats. Stress 20, 549–561 (2017).
3.Holmes, T. H. & Rahe, R. H. The social readjustment rating scale. J. Psychosom. Res. 11, 213–218 (1967).
4.Wojcicki, J. M. et al. Telomere length is associated with oppositional defiant behavior and maternal clinical depression in Latino preschool children. Transl Psychiatry 5, e581 (2015).
5.Infurna, M. R. et al. Associations between depression and specific childhood experiences of abuse and neglect: a meta- analysis. J. Affect. Disord. 190, 47–55 (2016).
6.Anacker, C., Zunszain, P. A., Carvalho, L. A. & Pariante, C. M. The glucocorticoid receptor: pivot of depression and of antidepressant treatment? Psychoneuroendocrinology 36, 415–425 (2011).
7.Maier, S. F. & Seligman, M. E. Learned helplessness at fifty: insights from neuroscience. Psychol. Rev. 123, 349–367 (2016).
8.Barr, A. M. & Markou, A. Psychostimulant withdrawal as an inducing condition in animal models of depression. Neurosci. Biobehav. Rev. 29, 675–706 (2005).
9.Maes, M. et al. Immune disturbances during major depression: upregulated expression of interleukin-2 receptors. Neuropsychobiology 24, 115–120 (1990).
10.Otte, C. et al. Major depressive disorder. Nat. Rev. Dis. Prim. 2, 16065 (2016).
11.Bowers, M. E. & Yehuda, R. Intergenerational transmission of stress in humans. Neuropsychopharmacology 41, 232–244 (2016).
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





