基因編輯技術在小分子藥物研發中的應用

小分子藥物研發現狀
藥物研發是一個跨學科整合板塊,隨著各學科基礎研究和科學技術的進步,對安全有效藥物的需求也日益增加。從2015年-2020年,FDA共批準了245款新藥物,其中小分子藥物有164種,占到62%。批準小分子藥物涵蓋了抗腫瘤、抗感染、神經系統、自身免疫、代謝等范疇,是藥物研發重點方向[1](1. U.S. FDA Approved Drugs from 2015-June 2020: A Perspective)。一個小分子藥物的發現需要化學、生物學、臨床醫學學科的精耕細作,從候選分子篩選到臨床上市,大約需要10年時間。藥物研發宗旨是安全有效,具有高投入、低產出特征,每年僅有屈指可數的藥物分子通過審批,從Phase I階段到批準上市成功率約為9.5%,尤其是抗腫瘤小分子靶向藥物成功率僅為5.1%,排名最靠后[2],如圖1(Clinical Development Success Rates 2006-2015)。小分子藥物成功率低主要受限于以下因素:
(1)缺乏新靶點的發現;
(2)缺乏合理和針對性的臨床前評價體系和模型;
(3)易出現耐藥性。
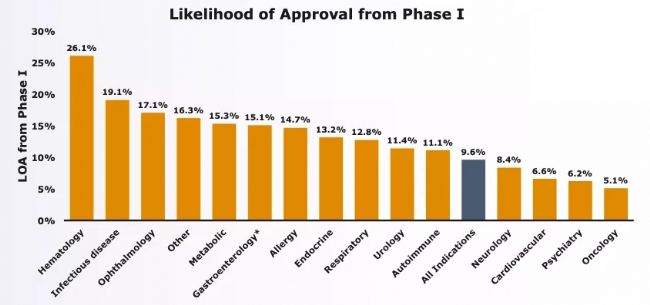
圖1. 各類疾病藥物研發的成功率
近年來,小分子藥物發展更是受到了抗體藥物、基因療法、細胞療法、ADC藥物、溶瘤病毒的強勢競爭,因此急需解決以上技術難題,提高小分子藥物研發效率、成功率與競爭力。
基因編輯技術簡介與原理
基因編輯技術為經典和常用的分子生物學技術,在藥物研發、基因治療、基礎研究、診斷技術開發等方面廣泛應用。對于小分子藥物研發,基因編輯可以通過基因敲入、基因敲除、堿基轉換、染色重排,順利解決上述臨床前評價體系、新靶點發現、耐藥性問題。
基因編輯技術的核心是通過程序化的人工核酸酶,定點對基因組DNA進行改造。到目前為止,總共有3款基因編輯技術實現了應用,第一代鋅指核酸酶 (zinc-finger nuclease, ZFN)技術、第二代轉錄激活因子樣效應物核酸酶(transcription activator-like effector nuclease, TALEN)技術、第三代CRISPR/Cas9 技術,在藥物研發、基因療法、細胞療法方面應用廣泛[3](基因編輯技術的原理及其在癌癥研究中的應用),如圖2所示。
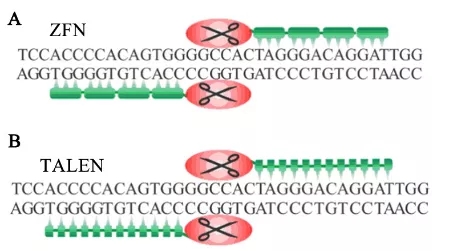
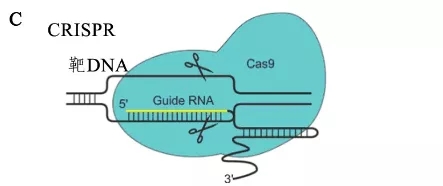
圖2. ZEN,TALEN,CRISPR基因編輯原理
三代基因編輯技術各有優劣勢,ZFN技術易脫靶、效率低、時間周期長;TALEN技術通量小、難以做到多基因敲除,都極大的限制了技術的應用,而第三代技術兼備通量、技術壁壘降低、成本時間耗用少優勢,得到大規模應用和推廣,更是獲得了2020年諾貝爾化學獎,本文將以第三代CRISPR/Cas9基因編輯技術為例,詳細介紹其在小分子藥物研發中的應用,如表1所示。

表1. 三種基因編輯技術優劣勢比較
基因編輯技術在小分子藥物研發中應用
CRISPR/Cas9本身為原核生物免疫系統抵御外來病原體的一部分,將其引入基因編輯領域,可以高效準確的進行目的基因缺失、插入、堿基替換等工作,豐富了生物科學家的技術手段。以小分子靶向藥物治療為主的肺癌、乳腺癌、血液瘤為例,該類疾病基因分型完善,標準臨床治療方案為結合分子病理分型選取相應小分子藥物加以治療,如EGFR T790M突變采用三代EGFR抑制劑奧西替尼,BRCA1/2同源重組修復缺陷變化采用PARP抑制劑,BCR-ABL融合使用伊馬替尼。
構建點突變模型
基因編輯技術可以為這類型的小分子藥物研發提供臨床前篩選平臺。藥物研發,前期都需在特異性體內外模型中進行候選分子篩選和驗證。傳統方法構建篩選驗證平臺難以模擬發病機制,建模耗時長、成功率低,而基因編輯技術可以從基因組水平編輯目的基因,可高度模擬疾病機制和進展狀態,極大簡化了建模流程、縮短建模周期。目前常用的EGFR常見突變、罕見突變、外顯子插入細胞模型,都是根據基因編輯技術在細胞層面進行改造,如EGFR T790M、C797S、L858R、G719X、L861Q、S768I、20號外顯子插入(exon20ins)等。Mi-Young Park等人[4](Generation of lung cancer cell lines harboring EGFR T790M mutation by CRISPR/Cas9-mediated genome editing)通過CRISPR/Cas9技術構建了PC9 T790M突變增強型細胞株,在PC9原有基礎上提高了T790M突變比例,并且在等量吉非替尼暴露下,PC9 T790M突變細胞株耐藥性更強,但對奧西替尼敏感性更強。因此利用CRISPR/Cas9構建的點突變細胞株效率更高,更適用于三代EGFR小分子抑制劑篩選。
構建基因融合模型
此外,基因編輯技術可進行染色體重排,為血液瘤提供疾病模型。許多血液瘤發病起源于染色體上基因重排或融合,如CML/AML(慢性粒細胞白血病/急性粒細胞白血病)與BCR-ABL基因融合相關,PDGRFα重排與CEL(慢性嗜酸性粒細胞白血病)相關,并且由于血液瘤發病進程長,疾病分子變化復雜,構建難度和疾病模擬度都需要更加成熟的技術手段。Icahn Mount Sinai大學的研究者們[5]利用CRISPR/Cas9基因編輯技術,以多能干細胞(iPS)為載體,將AML疾病相關基因ASXL1/SRSF2/NRAS按照順序編輯導入多能干細胞中,創建一個突變不斷增加的腫瘤疾病細胞模型,可模擬AML發病全程,從早期異常血象開始,到骨髓異常增生,到后期演變為AML,便于觀察各階段轉換機制。由此可見,基因編輯技術可為小分子藥物研發提供更貼合實際的細胞與動物模型。該類型例子更是在代謝疾病、中樞神經系統有廣泛應用。
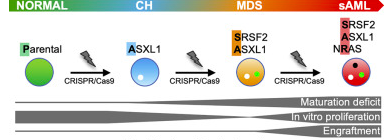
圖3. 模擬AML疾病進程轉換

圖4. AML與CRISPR/Cas9實驗設計方案
發現新藥物靶點
CRISPR/Cas9技術可大規模篩選藥物靶點,發現新藥物靶點。目前人類基因組編碼的蛋白質中,約75%的靶點被認為與疾病治療無關,而剩余25%的靶點中又有60%的靶點無法成藥。目前已知的約5000個疾病分子基礎中,只有250中疾病有治療方案,因此發現藥物新作用靶點對藥物研發至關重要。實驗人員[6]利用CRISPR/Cas9基因編輯技術靶向編碼蛋白功能性區域的外顯子序列,對小鼠急性髓系白血病細胞系中192個染色質功能調節區域進行了篩選,證實了6個已在研的藥物靶點,19個潛在藥物作用新靶點,DOT1L, EZH2, EHMT1/2、KDM1A做為MLL-AF9白血病藥物靶點開發了相關抑制劑(Discovery of cancer drug targets by CRISPR/Cas9 screening of protein domains)。由此可見,利用基因編輯技術可發現全新藥物作用靶點,豐富小分子藥物產品管線。
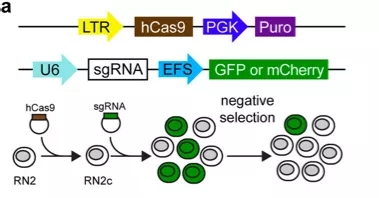
圖5. CRISPR/Cas9靶向編碼蛋白外顯子序列原理
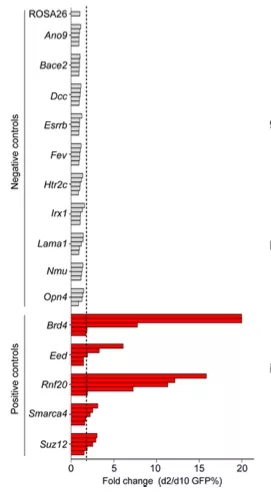
圖6. 差異基因篩選
協同致死研究
CRISPR/Cas9技術可作為協同致死研究手段,大規模驗證基因互做關系,為小分子藥物找到效應組合,達到擴增適應癥、增加臨床獲益目的。John Paul Shen等人[7]利用CRISPR/Cas9技術編輯HeLa,A549和293T細胞系,通過測試兩個靶向基因對細胞生長的影響判斷兩者間作用關系。研究者們共分析了73個基因,進行了141,912次交互作用分析,最后發現這73個癌基因之間的遺傳關系,存在著152對協同致死效應組合。包括BRCA1/2同源重組修復缺陷指導PARP抑制劑用藥,CCND1與CDK4/6抑制劑,PTEN與mTOR抑制劑。
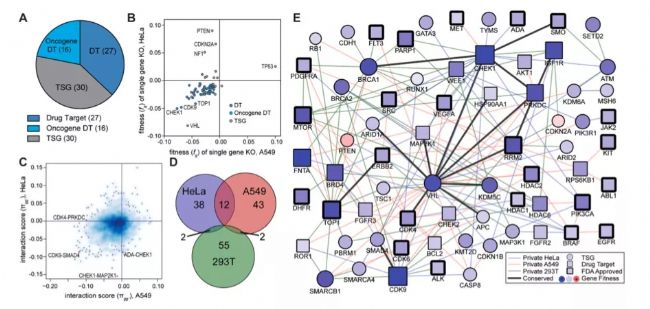
圖7. CRISPR/Cas9篩選協同致死組合
基因編輯技術在小分子藥物研發中應用廣泛,涵蓋小分子藥物研發全流程。從候選分子篩選、藥理學研究、毒理研究到轉化醫學都可借助基因編輯。隨著技術發展,更是滲透到臨床診療。張力教授團隊在肺癌中發現新ALK融合位點,使用基因編輯技術驗證了新融合組合功能和對ALK抑制劑敏感性,最后輔助患者臨床用藥,并獲得較好臨床藥效。因此,伴隨醫學與生物學的完善,基因編輯技術在小分子藥物研發中應用將在基因敲入、敲除、堿基轉換基礎上向外拓展,獲得更多樣化發展。
賽業生物基因編輯技術服務平臺
助力小分子藥物研發
賽業生物成熟穩定的基因編輯技術平臺每年構建各類基因敲除載體、基因敲除細胞模型、基因敲除大小鼠模型上萬例。從“敲除載體”、“敲除細胞模型”到“敲除大小鼠模型”,賽業生物經驗豐富的技術團隊可為您提供專業的一站式服務。
參考文獻:
[1] Bhutani, P., et al., U.S. FDA Approved Drugs from 2015–June 2020: A Perspective. Journal of Medicinal Chemistry, 2021. 64(5).
[2] Mullard, A., Parsing clinical success rates. Nature Reviews Drug Discovery, 2016. 15(7): p. 447.
[3] 謝一方, et al., 基因編輯技術的原理及其在癌癥研究中的應用. 中國腫瘤生物治療雜志, 2017. 08(v.24;No.119): p. 6-18.
[4] Park, M.Y., et al., Generation of lung cancer cell lines harboring EGFR T790M mutation by CRISPR/Cas9-mediated genome editing. Oncotarget, 2017. 8(22).
[5] Wang, T., et al., Sequential CRISPR gene editing in human iPSCs charts the clonal evolution of leukemia. 2020.
[6] Junwei, et al., Discovery of cancer drug targets by CRISPR-Cas9 screening of protein domains.