FAO通路通過抑制失巢凋亡促進結腸直腸癌細胞遠端轉移
中山大學附屬腫瘤醫院腫瘤研究所徐瑞華教授長期從事消化道腫瘤個體化治療及抗癌藥物研究。該課題組利用NuRNA™ Human Central Metabolism PCR Array研究發現在非貼壁的結直腸癌細胞中,脂肪酸氧化(FAO)通路被激活。而在轉移的腫瘤中,CPT1A表達上調,由CPT1A介導的FAO通路激活,通過調控氧化還原穩態抑制其失巢凋亡,促進非粘附的CRC細胞增殖存活。該研究成果發表在學術期刊Oncogene(IF:6.854)。
研究背景
結直腸癌(CRC)是最常見的腸胃腫瘤,由于其容易發生遠端轉移,使之成為腫瘤相關死亡的主要原因。遠端轉移是一個復雜的過程,具有侵襲性的癌細胞從原發腫瘤中脫離,進入血液和淋巴管,只有其中一些細胞可以從血管滲出,并定居在新的器官,形成遠端轉移。轉移過程中大部分細胞,由于脫離原發灶,失去與胞外基質的粘附,導致細胞失巢凋亡。
FAO也稱為β-氧化,是脂肪酸分解產生乙酰輔酶A的過程,同時生成ATP,NADPH,MADH和FADH2。肉毒堿棕櫚酰轉移酶1A(CPT1A)定位在線粒體膜上,是FAO中最主要的限速酶。已有文章報道,CPT1A與多種腫瘤進程相關。考慮到FAO參與了非粘附腫瘤細胞的代謝過程,作者猜測CPT1A在腫瘤細胞能量代謝調節和轉移抑制中會是好的靶標。
研究思路:
該研究著重于CPT1A介導的FAO通路激活,通過維持氧化還原穩態,保護結直腸癌細胞免受失巢凋亡的影響。作者運用NuRNA™ Human Central Metabolism PCR Array分析了超低粘附生長的及正常貼壁生長的HCT15和HCT116兩種細胞中代謝相關基因的表達。基因富集分析結果顯示,兩種細胞中FAO通路被明顯激活。由于CPT1A是FAO通路的關鍵基因,作者因此集中于研究CPT1A在CRC轉移中的作用。qRT-PCR結果顯示,在懸浮的CRC細胞中,FAO通路中的關鍵基因明顯上調。其后作者分析了臨床病人中原位腫瘤和轉移灶的樣本,發現CPT1A在轉移灶中表達上調。
為了進一步研究CPT1A在非粘附CRC細胞中的功能,作者建立了CPT1A敲低的穩定株,發現在細胞非粘附生長時,敲低CPT1A可明顯抑制了細胞成活與克隆形成,也可以檢測到細胞失巢凋亡明顯升高。在培養基中添加油酸鹽,可以促進CRC細胞克隆形成,此過程可以被etomoxir抑制,意味著CPT1A介導的FAO激活促進非粘附的CRC細胞增殖存活。
CPT1A敲低的CRC細胞中,無法維持NADPH/NADP+和GSH/GSSG的平衡,導致很高的活性氧水平。所以CTP1A誘導的FAO通過促進活性氧清除是抑制失巢凋亡的主要因素。在體內實驗中,敲低CPT1A可以減少CRC細胞的肝轉移和肺轉移,用etomoxir則可抑制CRC的肝轉移和肺轉移,預示著用etomoxir靶向CPT1A可以有效地激活失巢凋亡并減少CRC細胞轉移。
技術路線:
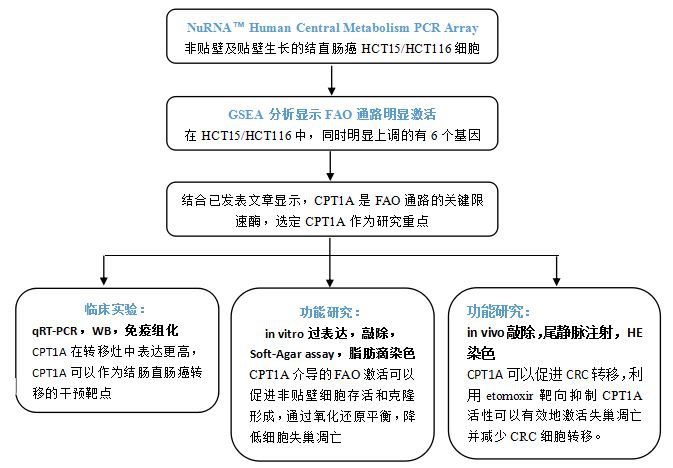
結果展示:
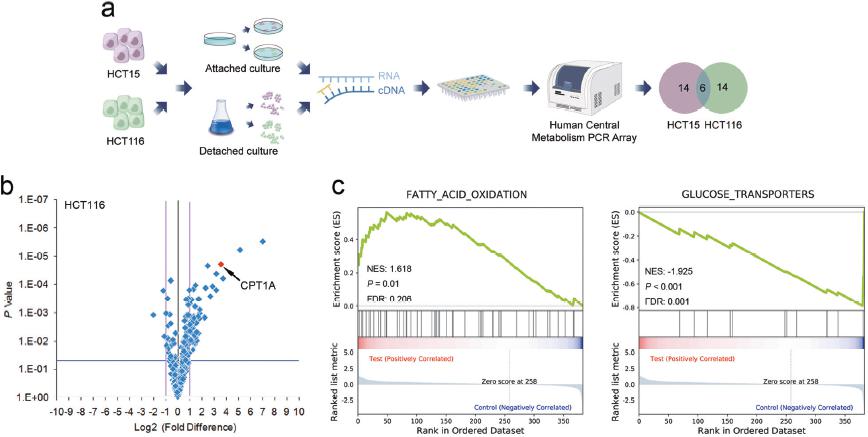
圖1:a實驗流程;b\c NuRNA™ Human Central Metabolism PCR Array分析代謝相關基因轉錄變化的火山圖和基因富集分析;
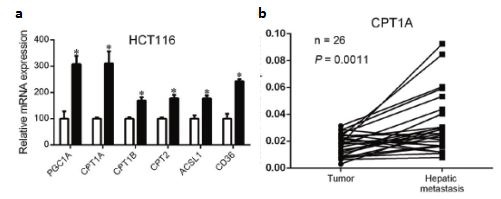
圖2: a qPCR驗證FAO通路相關基因在非粘附的HCT116中高表達,FAO通路被激活;b CPT1A在轉移灶中表達上調
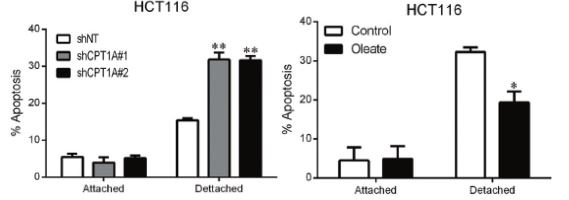
圖3:非粘附HCT116細胞中敲除CPT1A或在培養基中加入油酸鹽,可以促進細胞失巢凋亡
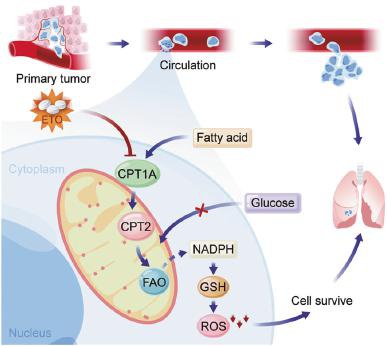
圖4:總結:進入血液的CRC細胞,由于其CPT1A表達上調,FAO信號通路的激活,為轉移的細胞提供了足夠的還原力,使得細胞得以克服活性氧應激,最終能夠在轉移位點存活
研究意義:
該研究通過NuRNA™ Human Central Metabolism PCR Array篩選出非貼壁結直腸癌細胞中高表達的CPT1A,發現了CPT1A介導的脂肪酸氧化通路激活,通過維持氧化還原穩態,使CRC細胞免受失巢凋亡,促進存活。預示著在轉移性的CRC患者中,靶向CPT1A將是一個在臨床上有前景的應用
原文出處:
CPT1A-mediated fatty acid oxidation promotes colorectal cancer cell metastasis by inhibiting anoikis. Oncogene. 2018





