甲基化標記物可預測早期肝癌病人術后復發的模型建立方法
研究背景
在全世界分范圍內,每年因肝癌死亡的病例超過50萬人,是主要的致死惡性腫瘤之一。在過去的十年中,隨著影像學的進步以及健康體檢的普及,越來越多的肝癌病人在患病早期被發現。但由于肝臟捐贈者的短缺,外科肝臟切除術仍然是治療早期肝癌病人的最主要方法。目前對于術后患者缺乏準確預測體系或標志物。本研究建立了一種預測早期肝癌病人術后復發的模型。
研究結果
1. CpG位點選擇
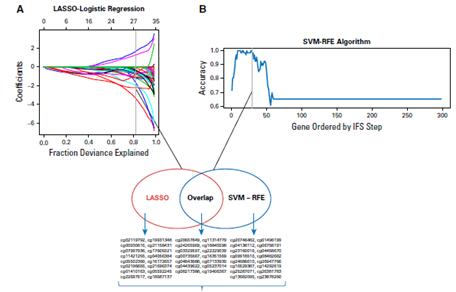
研究者首先對66例病人的樣本采用450K芯片(該研究中Illumina
Methylation 450k Beadchip服務由伯豪生物提供)檢測,過濾得到2550個差異CpG位點。隨后,研究者為了區分高風險和低風險的病人,采用LASSO和SVM-RFE算法分別得到了30個差異最顯著的CpG位點。
2. 探究可預測的標簽
通過比較兩種算法得到的CpG位點,共篩選出46個不同的CpG位點。通過分析46個位點,把66例樣本分成復發和不復發兩個亞類。研究者隨后采用Cox回歸模型在訓練組中進一步縮小了病人的甲基化檢測位點。結果發現,cg20657849(SCAND3), cg19406367(SGIP1), 和 cg19931348(PI3)三個甲基化位點與病人復發高度相關。
隨后研究者采用焦磷酸測序技術,分別在訓練組和鑒定組中量化這一發現。為了更好的研究這三個CpG位點用來預測肝癌患者復發的準確性,在訓練組中設定了一種危險系數評分。
3. 證實這一標簽
為了證實這一模型的穩定性,研究者分別在一組內部樣本和兩組外部樣本進行了檢測。在內部樣本中,該模型成功的分類了68例復發高風險病人,73例低復發風險病人。在外部樣本中,同樣成功分類了高風險和低風險病人。ROC分析發現,預測模型預測早期肝癌病人復發比三個CpG位點單獨檢測更有效。
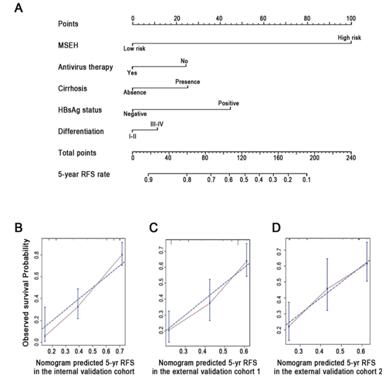
4. 建立可預測的諾模圖
為了建立臨床上適用的用來預測個體復發的模型,綜合考慮了協變量后,研究者用諾模圖建立了可以用來預測的模型。研究者生成了一個諾模圖預測患者的5年生存率,通過三個校正點的檢測均得到理想結果。
本文通過分析早期肝癌患者甲基化芯片結果,得到三個與早期肝癌患者復發相關的CpG位點,并通過訓練組和驗證組優化了這一預測模式。最終,研究者建立了一種諾模圖,用來預測早期肝癌患者的術后復發風險。
原文出處:Qiu JL, Peng BG, Tang YQ, Qian YB, Guo P, Li MF,Luo JH, Chen B, Tang H, Lu CL, Cai MY, Ke ZF, He W, Zheng Y, Xie D, Li BK, Yuan YF. CpG methylation signature predicts recurrence in early-stage hepatocellular carcinoma: results from a multi-center study. journal of clinical oncology.2016.
作者背后故事:
尋找早期肝癌預后模型
在廣州工作的一對堂兄弟,接連半年內相繼發現肝癌,這對一個家庭來說打擊巨大。不幸中的萬幸,腫瘤都小,兄弟兩診斷為早期肝癌。于是托了關系,找到知名教授手術,順利的完成手術。但令人意外的是,同樣接受根治性手術的早期肝癌,哥哥半年不到就復發了,慶幸的是弟弟一直沒有問題。
這樣的情況不僅僅出現在這對兄弟上,國內外研究均顯示即使早期肝癌,根治術后復發率都是接近一半。到底是什么原因導致的兄弟兩如此迥異的結局?這不僅困惑家屬,也同樣困擾著責任心極強的主刀大夫。分子生物學差異可能是背后的元兇,而如何在浩瀚如海的眾多基因中尋找差異,一直制約著轉化醫學進一步發展。
高通量大數據的技術為上述問題的解決提供了有力工具。最近,中山大學等聯合國內數家單位,借助上海國家生物工程中心的伯豪生物芯片有限責任公司平臺,完成全基因組DNA甲基化高通量芯片檢測,篩選出三個與肝癌復發的基因,這些基因能在多中心大樣本良好的區分復發和未復發病人,相關結果發表在國際臨床腫瘤學頂尖雜志journal of clinical oncolgy。該結果有望為早期肝癌患者提前預警,也為肝癌靶向治療提供潛在作用靶點。





