基于脂肽模塊化設計的高效RNA遞送和器官特異性靶向能力的LNPs開發

自新冠之后LNP 進行RNA遞送,一直是一個非常熱門的研究方向。2025年2月初,天津大學王躍飛團隊在 《Advance Materials》期刊上發表《Modular Design of Lipopeptide-Based Organ-Specific Targeting (POST) Lipid Nanoparticles for Highly Efficient RNA Delivery》。該文主要研究了基于脂肽(lipopeptide, LP)的模塊化設計,開發了一種具有高效RNA遞送能力和器官特異性靶向能力的脂質納米顆粒(lipid nanoparticles, LNPs),并命名為POST(Organ-Specific Targeting)LNPs。
1. 研究背景
RNA療法在治療癌癥、傳染病、遺傳性疾病等多種疾病中顯示出巨大潛力。脂質納米顆粒(LNPs)是目前最有前景的RNA遞送系統之一,其典型成分包括可電離脂質、輔助脂質、膽固醇和PEG化脂質。然而,LNPs在應用中面臨的一個關鍵挑戰是其在體內的系統性肝積累,限制了其在肝外器官的靶向能力。近年來,研究者們通過篩選可電離脂質結構、添加主動靶向配體以及調節輔助脂質或膽固醇的性質等方法,取得了一定進展。例如,通過引入第五種選擇性器官靶向(SORT)輔助脂質,實現了對脾臟、肺和骨髓的精準mRNA遞送。
2. 研究目的
本研究旨在開發一種高效的可電離脂質,通過脂肽(LPs)的模塊化設計,構建具有器官特異性靶向能力的LNPs。脂肽結合了肽的生物相容性、可設計性和靶向性,以及脂質的疏水性,有望提升LNPs的RNA遞送效率和靶向性。
3. 研究方法
脂肽(LPs)的設計與合成
研究者設計并合成了一系列基于賴氨酸-組氨酸的脂肽(KH-LPs),其結構包括一個極性頭(KHn,n為氨基酸數量,2-12)和一個非極性尾(Ax或Ex,A表示烷醇,E表示烯醇,x為碳原子數量,10-18)。通過簡單的一步環開反應,合成了25種不同的KH-LPs,并將其與四種輔助脂質(DOTAP、DOPE、DSPC和14PA)組合,構建了包含100種四組分LP-LNPs的篩選庫。
篩選策略
研究者通過體外和體內篩選,評估了這些KH-LP LNPs在遞送mRNA和siRNA方面的能力。體外篩選使用人肺癌細胞A549作為測試細胞,通過流式細胞術檢測mRNA表達效率和siRNA沉默效率。體內篩選則通過在C57BL/6小鼠中注射封裝了熒光素酶mRNA的LNPs,觀察其在不同器官中的生物發光信號,以評估器官靶向性和遞送效率。
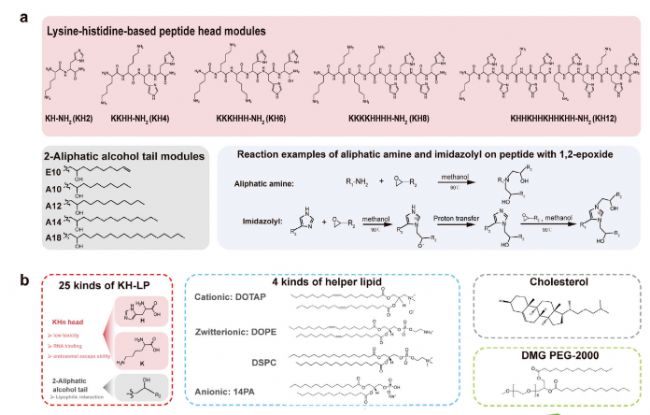
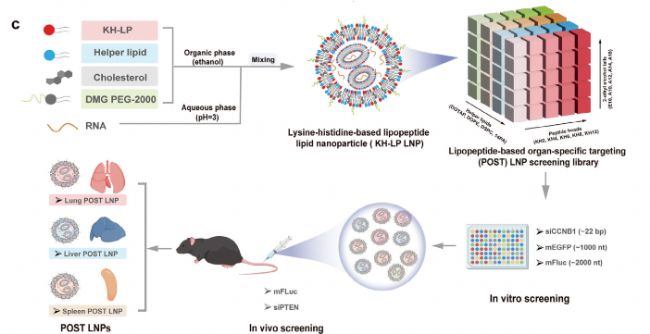
基于賴氨酸-組氨酸的脂肽庫(KH-LP)和基于四組分脂肽的器官特異性靶向(POST)LNP篩選庫的模塊化設計
4. 實驗結果
體外篩選結果
在95種細胞毒性較低(細胞存活率>80%)的KH-LP LNPs中,16種在A549細胞中實現了超過70%的mRNA表達效率,其中A10-KH2/DOTAP表現最佳,達到96.8%。
在siRNA遞送方面,29種KH-LP LNPs實現了低于20%的靶基因mRNA相對表達水平,A10-KH2/DOTAP同樣表現最佳,沉默效率達到97.3%。
進一步測試表明,A10-KH2/DOTAP在多種難以轉染的細胞系中均表現出優異的mRNA和siRNA遞送能力,優于商業轉染試劑和經典的SM-102 LNP。
結構-活性關系(SAR)分析
研究發現,高效的KH-LP LNPs通常具有以下特性:pKa值在6-7之間(有利于RNA遞送)、包封率(ee)>80%、粒徑<120 nm、多分散指數(PDI)<0.2,且在中性條件下zeta電位接近中性。
不同的輔助脂質系統對KH-LPs的選擇性不同。例如,DOTAP(永久正電荷)更適合與短鏈KHn頭結合,而DOPE、DSPC和14PA(弱RNA結合能力)則更適合與長鏈KHn頭結合,以實現高效的RNA結合、細胞攝取和內質網逃逸。
體內篩選結果
在體內實驗中,A10-KH2/DOTAP表現出肺部特異性靶向能力,其生物發光信號強度高于經典的肺部靶向LNP(如SORT MC3/DOTAP LNP)。
A10-KH4/DOPE和A18-KH4/DOPE分別在肝臟和脾臟中表現出高效遞送能力,且優于或至少與經典的肝臟靶向LNP和脾臟靶向LNP相當。
通過冷凍透射電子顯微鏡(cryo-TEM)觀察,POST LNPs呈球形,具有多層外殼和非晶態核心。
siRNA遞送能力
在體內siRNA遞送實驗中,POST LNPs在靶向器官中表現出更高的特異性和沉默效率,優于對應的SORT LNPs
在劑量依賴性實驗中,肺和肝臟POST LNPs在0.1 mg/kg劑量下仍能實現超過50%的沉默效率,而脾臟POST LNP在0.01 mg/kg劑量下即可達到超過50%的沉默效率
穩定性和生物相容性
POST LNPs在4°C下儲存9天后,其mRNA遞送能力、粒徑、PDI和包封率均保持穩定。
在重復給藥實驗中,小鼠在連續三次給藥后,靶向器官中PTEN基因水平持續保持低水平,且小鼠體重呈上升趨勢,表明POST LNPs具有良好的生物相容性。
5. 結論
本研究通過模塊化設計的KH-LPs和輔助脂質,成功開發了一系列具有高效RNA遞送能力和器官特異性靶向能力的POST LNPs。這些LNPs在體外和體內實驗中均表現出優異的性能,具有簡單組成、良好穩定性和生物相容性,顯示出巨大的臨床應用潛力。此外,SAR分析結果表明,通過精確調節LP的結構和功能,可以為不同的靶向脂質系統開發出最優的可電離成分,為未來的RNA療法提供了新的策略。
這項研究不僅為RNA遞送系統的設計提供了新的思路,還為開發具有器官特異性靶向能力的納米藥物提供了重要的理論依據。通過模塊化設計和篩選策略,可以針對不同的疾病和靶器官開發出個性化的RNA遞送系統,有望推動RNA療法在臨床中的應用。
S-RMab®單克隆抗體
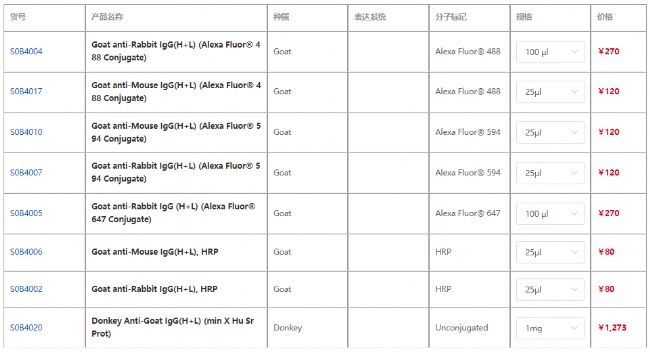
文中使用斯達特熒光標簽偶聯抗體Goat anti-Rabbit IgG(H+L) (Alexa Fluor® 594 Conjugate) (貨號S0B4007)和Goat anti-mouse IgG H&L (Alexa Fluor 488 Conjugate)(貨號S0B4017)進行免疫熒光實驗。實驗流程如下:
1.裝載mEGFP的POST LNP通過靜脈注射于C57BL/6小鼠(劑量為0.75mgkg−1)
2.48 h后,分離相應的靶向組織(肝、脾、肺),制備冷凍切片(8 μm),用95%乙醇固定10 min
3.切片用PBS洗滌3次,用0.1% Triton X100滲透30 min,用5%正常山羊血清封閉1h
4.使用一抗在4°C下孵育過夜
5.清洗載玻片,使用斯達特二抗(1:500 dilution )在室溫下孵育1小時
6.洗滌,用4′,6-diamidino-2-phenylindole孵育5 min,并封片
7.采用奧林巴斯IX73顯微鏡進行成像
8.以1xPBS為陰性對照。
杭州斯達特(www.starter-bio.com)志在為全球生命科學行業提供優質的抗體、蛋白、試劑盒等產品及研發服務。依托多個開發平臺:重組兔單抗、重組鼠單抗、快速鼠單抗,重組蛋白開發平臺(E.coli,CHO,HEK293,Insect Cells),已正式通過歐盟98/79/EC認證、ISO9001認證ISO13485。