小鼠眼球注射實驗操作和方法與技巧
背景:
目前在全球范圍內因為眼部疾病致盲人數約有4000萬,這其中有相當一部分屬于遺傳性視神經病變,如老年黃斑變性、Leber先天性黑朦、Leber遺傳視神經病變等等[1]。
隨著基因療法的興起,通過腺相關病毒(AAV)、慢病毒(LV)等作為藥物遞送載體,對遺傳性眼部疾病進行基因修正已經取得許多重大進展,越來越多的基因藥物被開發出來,而小鼠作為常用的藥物篩選模型,在基因治療的臨床前研究中占據重要地位。
眼球作為相對獨立的器官,球內注射是最有效的藥物遞送方式。眼球注射可突破血眼屏障,使藥物迅速濃集于眼內, 繼而在眼內擴散到達作用部位。具有代表性的眼內注射給藥途徑有視網膜下(subretinal)注射和玻璃體腔(Intravitreal)注射,玻璃體內注射能夠使基因藥物可以較快擴散至視網膜或脈絡膜部位,如臨床上常用于老年性黃斑變性的藥物輸送;視網膜下注射可將藥物直接傳遞到視網膜和視網膜色素上皮細胞(RPE)之間的潛在空間,是將藥物直接遞送至RPE細胞的最佳方法。
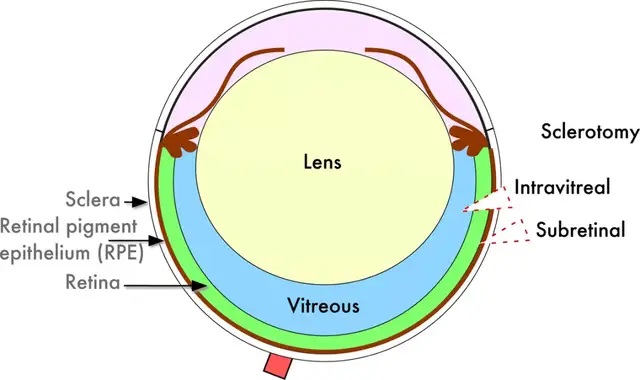
玻璃體注射和視網膜下注射示意圖[2]
一、視網膜下注射
實驗儀器耗材:
手術器械、吸入式麻醉機、Hamilton注射器(30G、33G)、托品酰胺、去氧腎上腺素、手術顯微鏡
實驗步驟:
1. 動物麻醉
1) 小鼠置于誘導盒內進行吸入式異氟烷麻醉,捏合小鼠腳指確認是否麻醉完全
2) 將老鼠轉移到解剖顯微鏡下,連接鼻錐持續給予異氟烷
3) 待注射眼睛滴加一滴丙美卡因(或類似的表面麻醉劑)防止注射引起局部反射,輕觸結膜確定麻醉深度。
2. 擴瞳
1) 傾斜鼠標頭部,使待注射眼睛在視野范圍內,用棉簽擦去任何多余的液體
2) 向待注射眼球滴加1-2滴1%托品酰胺和0.5%去氧腎上腺素用于擴大瞳孔
3. 鞏膜切口
1) 使用鑷子在上下眼瞼之間滑動,使眼球從眼窩中伸出,暴露鞏膜
2) 采用30G針頭在角鞏膜緣后面做一個小的鞏膜預切口,如果液體從切口處流出,則針頭穿刺過深而進入玻璃體腔,之后注射過程中的液體可能進入玻璃體腔
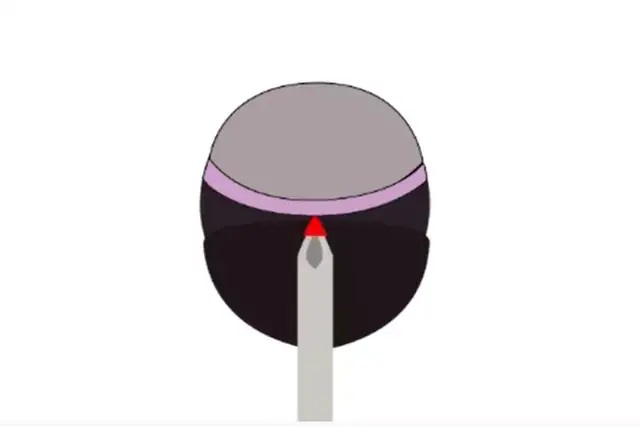
角鞏膜緣稍后處切口示意圖
4. 注射
1) 用鑷子輕輕捏緊緣下約1mm處的結膜保持眼球固定
2) 將裝好注射液的33G注射針插入預切口,針與眼球表面相切,沿鞏膜內表面穿過,尖端進入約1mm,穿過鞏膜和脈絡膜,到達視網膜下間隙
3) 操作注射器平穩注入適量液體,注意注射過程避免晃動引起額外的組織損傷
4) 注射后,停留針頭約30秒,以防漏液,然后將針頭慢慢抽出
5) 取出鑷子,重新放置結膜,輕輕將眼睛放回眼窩,閉上眼瞼
6) 如果需要雙側眼球注射,將另一面眼球轉到顯微鏡視野下重復上述步驟

視網膜下注射進針示意圖[3]
R480玻璃電極注射泵搭配顯微操縱器可滿足大小鼠眼球精準注射實驗,采用更細的玻璃毛細管代替常規33g注射針頭保證更小的注射損傷

5. 恢復
1) 可在角膜和注射區域涂抹抗生素眼藥膏防止感染
2) 將動物放在加熱墊上使其完全恢復(2-3分鐘),然后將其轉移回籠子繼續飼養
二、玻璃體內注射
玻璃體內注射與視網膜下注射類似,在用鑷子保持眼球穩定的同時,將裝好藥物的針頭,相對視神經約60度角,從角鞏膜緣(Limbus)后預切口,插入約1mm進行玻璃體腔注射。需要注意晶狀體占據玻璃體腔的大部分,應小心避免刺穿晶狀體。
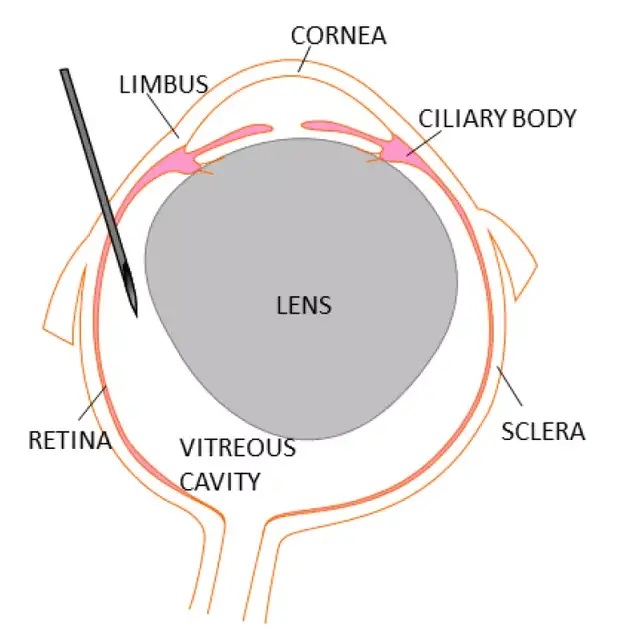
玻璃體腔注射進針示意圖[4]
注意事項:
1)眼球注射過程應確保動物眼睛一直濕潤,避免角膜干燥,可根據需要多次使用潤滑滴眼液。
2)注射過程應緩慢進行,避免速度過快造成液體從注射部位回流
3)眼球注射前應充分擴瞳,瞳孔過小不易看清眼底,會降低注射成功率,同時瞳孔過小也是虹膜出血的主要原因
4)角膜穿刺點靠近角鞏緣處為好,以免形成角膜白斑而影響后續動物實驗
5)視網膜下注射,注射針插入切口部位,應平行于眼外壁推進,保證準確進入視網膜下空間,如果太靠近外壁或太深,將會導致注射針進入錯誤位置。
【參考文獻】
1.Bourne R, et al. Magnitude, temporal trends, and projections of the global prevalence of blindness and distance and near vision impairment:a syste-matic review and meta-analysis.Lancet Glob Health.2017;5:e888–e897
2.Katherine JW,et al.Subretinal injection of gene therapy vectors and stem cells in the perinatal mouse eye.J Vis Exp.2012;(69):4286
3.Bennett J,et al.Cross-species comparison of in vivo reporter gene expression after rAAV-mediated retinal transduction.Methods Enzymol.2000;316:777–789.
4.Cameron EG,et al.Optic Nerve Crush in Mice to Study Retinal Ganglion Cell Survival and Regeneration. Bio Protoc.2020;10(6):e3559





