層析填料壽命研究的法規(guī)要求、影響因素及研究策略
層析工藝已日漸成為生物制品生產(chǎn)工藝中不可或缺的工藝步驟。通常,一個生產(chǎn)工藝需要設(shè)計多個正交的層析步驟來達到較高的目標純度水平,最大限度地減少殘留雜質(zhì)水平,并滿足與外源性物質(zhì)有關(guān)的安全標準。
工藝的操作成本很大程度上是由層析填料的成本驅(qū)動的,因此層析填料可使用的批次或循環(huán)次數(shù)(層析填料壽命)對生產(chǎn)成本的控制至關(guān)重要。
各國監(jiān)管部門出于對藥品安全性和有效性的考量,其法規(guī)文件明確規(guī)定了對“層析填料的使用壽命及可接受限度”的要求。
Table 1. 層析填料壽命研究的法規(guī)指南要求

此外,2021年,PDA發(fā)布了技術(shù)報告60-3《工藝驗證:生命周期方法 附件2:生物制藥原料藥生產(chǎn)》,報告中明確提出提高層析介質(zhì)的相關(guān)驗證是工藝驗證的重要部分。
層析填料在使用過程中,會有很多影響其壽命的因素,主要包括以下幾點:
(1) 該步驟在純化工藝中的位置和來料的性質(zhì)。(一般而言,捕獲粗純階段填料壽命衰減得更快,精純階段填料壽命衰減得慢)
(2) 層析填料的再生、清潔和保存程序。
(3) 層析柱裝填和損耗。
層析填料壽命研究策略必須能夠完全反映商業(yè)化生產(chǎn)規(guī)模的性能,或者必須能體現(xiàn)與商業(yè)化生產(chǎn)規(guī)模之間的相關(guān)性。
Table 2. 層析填料壽命研究策略

注:監(jiān)控頻率(N)可根據(jù)對工藝的理解和實際情況做適應性調(diào)整。
• 縮小模型(Scale Down)壽命驗證前瞻性研究需要使用縮小模型來進行。該縮小模型采用線性縮小的原則,即維持柱床高度、線性流速、上樣載量(可采用最差條件)、緩沖液用量(CV)和洗脫收集標準不變,縮小層析柱的柱直徑、體積流速和樣品體積,同時關(guān)注層析柱壓力、樣品擴散、系統(tǒng)死體積和柱效等因素。
一般可使用工藝表征期間建立和確認的縮小模型,因為已經(jīng)確認了它可以代表商業(yè)化規(guī)模的工藝。
• 空白運行(Carryover)層析填料壽命研究的實驗設(shè)計需要考慮空白運行(Carryover)。周期性地進行空白運行可以用于評估清潔程序效果和產(chǎn)品殘留程度。在空白運行中,層析柱按照常規(guī)的步驟操作,不同之處在于,用水或者緩沖液代替來料上樣。
層析介質(zhì)的使用壽命根據(jù)檢測指標的標準來定義。檢測指標的標準可以設(shè)定為一個具體的截止標準,比如收率>80%,SEC-HPLC 純度>95%等,也可以通過檢測循環(huán)次數(shù)間的一致性來定義,此時就不再設(shè)置具體數(shù)值標準。
Table 3. 壽命研究的評價指標及其可接受標準(舉例)

層析填料壽命研究的終點判定可以選擇達到檢測標準的循環(huán)次數(shù)數(shù)值,或者出現(xiàn)批間異常的循環(huán)次數(shù)數(shù)值。通常較為保守的做法是將確定的循環(huán)次數(shù)數(shù)值乘以一個安全系數(shù),來定義最終的層析填料壽命次數(shù)。
Novo-A Diamond親和填料是博格隆自主研發(fā)的新一代高耐堿Protein A抗體親和填料,可耐受0.5M~1.0M NaOH進行CIP,填料的載量更高、壓力流速性能更好。
本案例使用含有單克隆抗體的細胞培養(yǎng)上清,對Novo-A Diamond親和填料進行了188個循環(huán)的測試,用0.1M NaOH和0.5M NaOH進行CIP,同時檢測洗脫收率、HCP、HCD、Protein A、SEC指標。
測試數(shù)據(jù)表明Novo-A Diamond具有較高的載量(初始10%DBC為67 mg/mL),運行156個循壞后依然高于初始10%DBC的80%;所有循環(huán)的收率穩(wěn)定,洗脫樣品純度穩(wěn)定,HCP、HCD和蛋白A的殘留始終處于較低的水平。
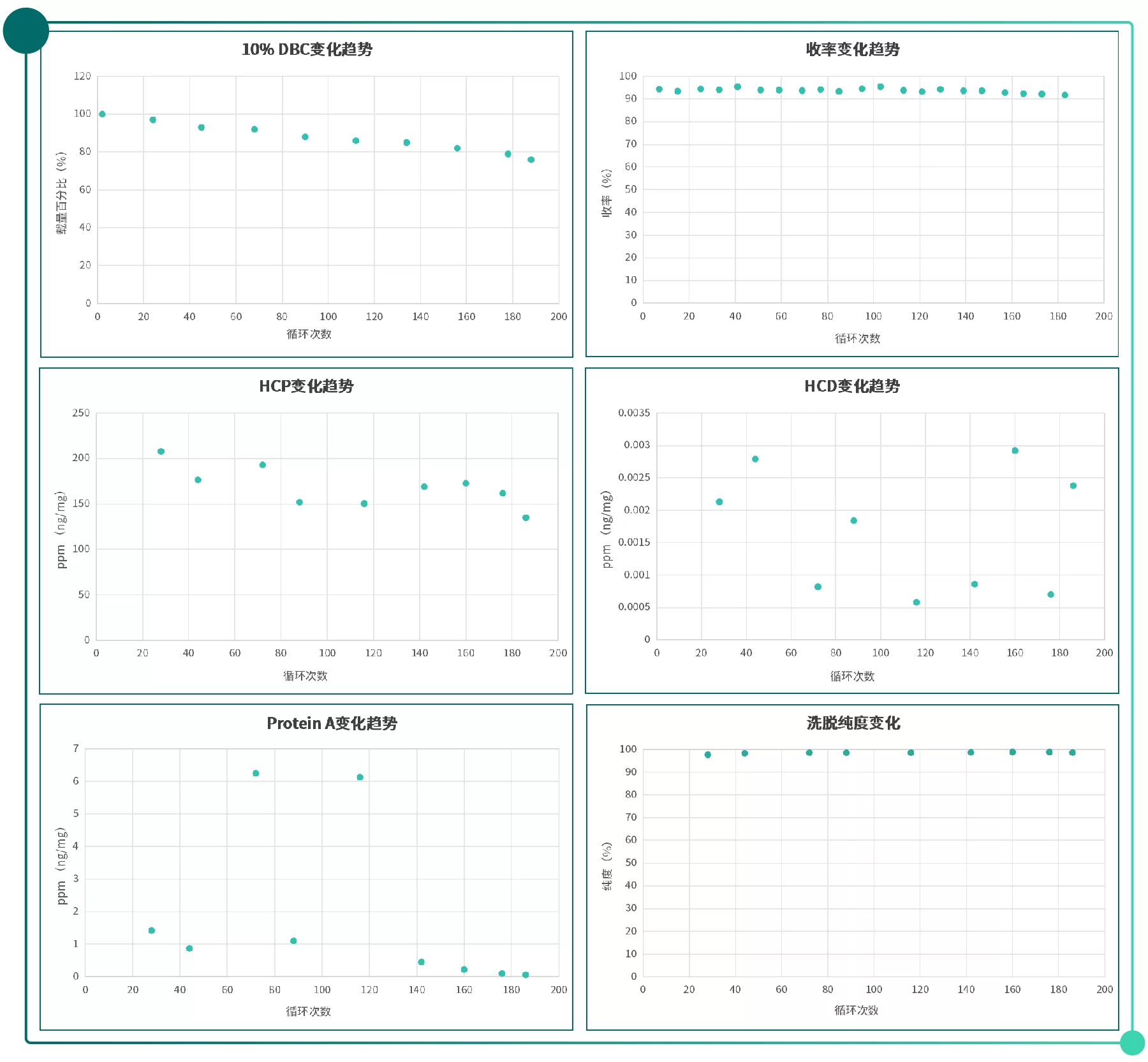
Fig.1 Novo-A Diamond 壽命研究各項數(shù)據(jù)檢測結(jié)果圖譜
層析填料作為生物制藥下游純化工藝中至關(guān)重要的原材料,其性能與生物藥物的產(chǎn)品質(zhì)量密切相關(guān)。通過填料壽命研究實驗,不僅僅提高了生產(chǎn)工藝的可控性與經(jīng)濟性,也為商業(yè)化生產(chǎn)提供可靠保證。
參考資料
[1] 2020 版《中國藥典》三部“人用重組單克隆抗體制品總論”.
[2] FDA “Guidance for Industry:Process Validation: General Principles and Practices”.
[3] FDA “Points to Consider in the Manufacture and Testing ofMonoclonal Antibody Products for Human Use”.
[4] EMA “Guideline on process validation for the manufacture of biotechnology-derived active substances and data to be provided in the regulatory submission”.
[5] EMA “CPMP Position Statement on DNA and Host Cell Proteins (HCP) Impurities, Routine Testing Versus Validation Studies,” CPMP/BWP/382/97.
[6] PDA Technical Report No.60-3: Process validation: A lifecycle approach Annex 2: biopharmaceutical drug substances manufacturing. Parenteral Drug Association: 2021.





