應用指南:如何構建高效的瞬轉平臺
細胞轉染是指將外源分子(如DNA,RNA等)導入(真核)細胞的實驗技術。隨著分子生物學和細胞生物學研究的不斷發展,轉染已應用于研究基因功能、調控基因表達、突變分析和蛋白質生產等生物學實驗中。
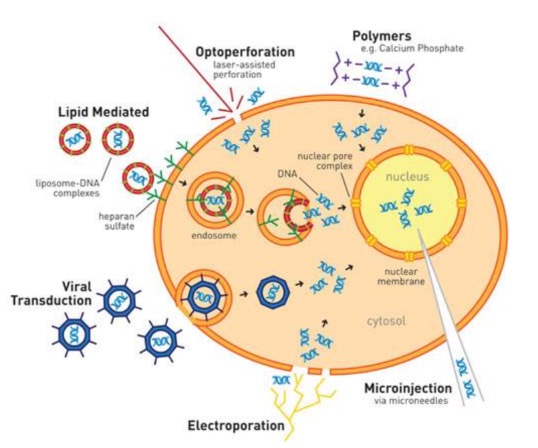
瞬轉的基本原理
瞬時轉染是將DNA導入宿主細胞的技術,其特點是載體基因不整合到細胞基因組上,而是隨著細胞分裂而逐漸丟失。瞬時轉染可在短時間內獲取目的基因的表達產物,目前常用的瞬轉方法有化學試劑轉染,脂質體轉染,病毒載體轉染和電轉等。
PEI(聚乙烯亞胺)為化轉試劑之一,其原理是帶正電的PEI能將帶負電的DNA包裹成為帶正電的PEI-DNA復合物,PEI-DNA復合物可結合細胞表面通過胞吞作用進入細胞,PEI相比于其他轉染試劑有著成本低廉的優勢,因此被廣泛應用。 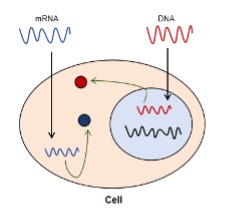
瞬時轉染示意圖
瞬轉的表達系統
細胞在導入表達載體后不經選擇培養,載體DNA隨細胞分裂而逐漸丟失,目的蛋白的表達時間較短,相對于穩定表達系統,瞬時表達系統無需將外源基因整合到基因組上,避免了外源基因整合過程中位置效應的影響。瞬時轉染一般用于基因產物的短期表達,進行蛋白質小規模合成。
那么如何能快速地搭建瞬轉平臺呢?
主要分五步:載體構建→質粒抽提→細胞準備→瞬時轉染及細胞培養→純化及質量檢測
載體構建
首先要選擇合適的載體,為了使質粒能夠在細胞中進行自我復制,提高瞬轉的表達量,需要選擇與宿主細胞匹配的表達載體,另外,為了提升表達量,表達載體通常選擇含強啟動子的。
如果表達的蛋白含有多條鏈,可以將兩條或兩條以上的鏈構建到一個載體或者多個載體進行表達。在構建時需要注意的點是,目標基因前面加上信號肽和 kozak 序列,構建的過程中盡量使用同源重組的方法防止移碼突變,目的基因最后必須加終止密碼子。
抽提的質粒通過跑分子膠鑒定大小及純度,OD260/OD280 以及 OD260/OD230 確定質粒的質量。百林科質粒純化平臺三步法:分子篩(Chromstar® 6FF)+親和(MaXtar® Plasmidcap HR)+陰離子(MaXtar® Q HR) 能協助客戶解決大規模質粒純化制備的問題。
CHO 細胞為鼠源細胞,比 HEK293 細胞生長更快,外源蛋白分泌更少,分離純化更簡便,且 CHO 細胞在放大生產方面相比于 HEK293 細胞更為穩定,因此大多數研究者選擇用 CHO 細胞作為抗體類藥物的瞬轉表達宿主。
轉染完成后進行細胞培養,添加 Enhancer 和補料,培養周期根據蛋白的累計效果及穩定性來確定。培養結束后用 SEC-HPLC,Biacore 或者 Elisa 的方法檢測表達量。


瞬時轉染由于不需要質粒穩定整合到基因組形成細胞株,運用這種方法能在短時間內制備出蛋白樣品,用于蛋白功能和穩定性的檢測。這一方法被廣泛運用于藥物研發的早期階段。同時在威脅公共衛生的突發傳染病的預防和治療方面可以在短期內完成臨床前藥物開發,大大縮短藥物的研發周期。搭建高效的瞬轉平臺對項目的快速推進影響深遠。

細胞轉染原理圖
瞬轉的基本原理
PEI(聚乙烯亞胺)為化轉試劑之一,其原理是帶正電的PEI能將帶負電的DNA包裹成為帶正電的PEI-DNA復合物,PEI-DNA復合物可結合細胞表面通過胞吞作用進入細胞,PEI相比于其他轉染試劑有著成本低廉的優勢,因此被廣泛應用。

瞬時轉染示意圖
瞬轉的表達系統
那么如何能快速地搭建瞬轉平臺呢?
主要分五步:載體構建→質粒抽提→細胞準備→瞬時轉染及細胞培養→純化及質量檢測
載體構建
如果表達的蛋白含有多條鏈,可以將兩條或兩條以上的鏈構建到一個載體或者多個載體進行表達。在構建時需要注意的點是,目標基因前面加上信號肽和 kozak 序列,構建的過程中盡量使用同源重組的方法防止移碼突變,目的基因最后必須加終止密碼子。
質粒抽提
對于少量的質粒抽提,可以選用控內毒的質粒抽提試劑盒,現在一些國產的試劑盒完全可以滿足實驗的需要。對于大量的質粒抽提,可以使用層析的方式,百林科擁有完善的質粒純化平臺,可以針對不同的實驗要求,提供差異化的質粒純化解決方案。抽提的質粒通過跑分子膠鑒定大小及純度,OD260/OD280 以及 OD260/OD230 確定質粒的質量。百林科質粒純化平臺三步法:分子篩(Chromstar® 6FF)+親和(MaXtar® Plasmidcap HR)+陰離子(MaXtar® Q HR) 能協助客戶解決大規模質粒純化制備的問題。

細胞準備
目前常用的瞬轉表達宿主為 CHO 細胞和 HEK293 細胞,均有耐受較高剪切力和滲透壓,表達水平較高,支持懸浮培養的優點。HEK293 細胞相對于 CHO 細胞在轉染效率方面更有優勢,由于 HEK293 為人源細胞,適用于表達翻譯后修飾要求更高的重組蛋白。CHO 細胞為鼠源細胞,比 HEK293 細胞生長更快,外源蛋白分泌更少,分離純化更簡便,且 CHO 細胞在放大生產方面相比于 HEK293 細胞更為穩定,因此大多數研究者選擇用 CHO 細胞作為抗體類藥物的瞬轉表達宿主。
瞬時轉染及細胞培養
瞬時轉染的方法有很多,現在最常用的方法為 PEI 轉染。選用轉染效率高的 PEI 很關鍵。使用 DOE 的方法確定轉染細胞的密度,質粒和 PEI 的用量,確定質粒和 PEI 孵育的時間。轉染完成后進行細胞培養,添加 Enhancer 和補料,培養周期根據蛋白的累計效果及穩定性來確定。培養結束后用 SEC-HPLC,Biacore 或者 Elisa 的方法檢測表達量。
純化及質量檢測
帶標簽的蛋白可以通過親和填料純化得到目標蛋白,不帶標簽的可以通過離子交換,復合模式,或者疏水填料分離得到目標蛋白。得到目標蛋白后進行質量分析,通過 SDS-PAGE 和 SEC-HPLC 初步分析蛋白的質量。

搭建瞬轉平臺時使用 GFP 質粒測試轉染效率

瞬時轉染由于不需要質粒穩定整合到基因組形成細胞株,運用這種方法能在短時間內制備出蛋白樣品,用于蛋白功能和穩定性的檢測。這一方法被廣泛運用于藥物研發的早期階段。同時在威脅公共衛生的突發傳染病的預防和治療方面可以在短期內完成臨床前藥物開發,大大縮短藥物的研發周期。搭建高效的瞬轉平臺對項目的快速推進影響深遠。
點擊鏈接,立刻查看層析填料選擇指南
👇👇👇
層析填料篩選策略助力生物制品下游純化工藝開發
層析填料篩選策略助力生物制品下游純化工藝開發
掃碼二維碼,立刻聯系銷售申請試用
👇👇👇


👇👇👇


標簽:
層析填料
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





