ADC藥物的深度表征
抗體偶聯藥物(antibody-drug conjugate,ADC)是一類通過特定的連接子將靶向單克隆抗體與高殺傷性的細胞毒性小分子藥物偶聯起來的生物藥,以單克隆抗體為載體將小分子細胞毒性藥物高效地運輸至目標腫瘤細胞中,起到治療的目的。
與傳統抗體藥相比,ADC藥物的結構復雜度和異質性更高,因為添加了多變的有效載荷和連接子1。為確保藥物安全性和有效性,ADC的深度表征在其開發過程中至關重要。這不僅包括對mAb的翻譯后修飾(PTM)的鑒定和定位,還包括藥物偶聯的鑒定。由于質譜技術的飛速發展,質譜已經成為ADC藥物表征中最廣泛使用的方法。完整質量分析是用于確定小分子藥物與抗體比率(DAR)的常規方法,而對結合位點的深入表征,通常依賴于bottom-up的方法。
現在最廣泛采用的碰撞誘導解離(CID)技術能夠提供氨基酸序列確認,但是這種能量比較大的碎裂技術也將有效載荷碎裂為更小的片段,從這種方法獲得的高度復雜的譜圖可能很難解析。而能量更柔和的碎裂方法可以促進此類復雜樣品的解析,一種基于電子活化裂解(EAD)2,3的創新、高度可重復的碎裂方法用于分析來自商業化ADC藥物的偶聯肽。使用10 Hz快速非靶向的數據依賴采集(DDA)方法采集數據,通過此工作流程,一次進樣就可以應用基于EAD的碎片進行常規和高級表征。
曲妥珠單抗美坦新偶聯物(T-DM1)是最早的ADC治療藥物之一,于2013年獲得FDA批準用于治療人表皮生長因子受體2(HER2)陽性轉移性乳腺癌。T-DM1是由單克隆抗體曲妥珠單抗和細胞毒素美坦新(DM1)通過不可裂解連接子共價偶聯而成(圖1)。將單克隆抗體(mAb)的靶標特異性與細胞毒性藥物的高效率相結合,可充分利用兩個方面的優勢,最大限度地減少副作用3。T-DM1是與氨基連接,如連接在曲妥珠單抗的賴氨酸殘基的側鏈中。先前的完整質量研究表明,T-DM1的平均DAR約為3.5.1,4。但是曲妥珠單抗中有88個賴氨酸殘基和4個N端基團,可能會出現450萬個以上的不同分子形式1。有效載荷的位點和結構將直接影響藥物的功效和安全性,因此將其歸類為關鍵質量屬性(CQA),并且需要在開發過程中進行全面表征和嚴格監控。
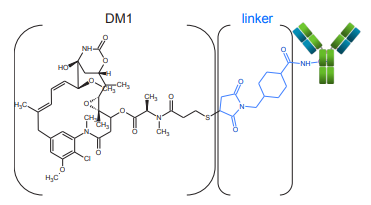
圖1. 細胞毒藥物有效載荷和連接子與mAb偶聯的示意圖。T-DM1由DM1(黑色),靶向連接氨基殘基的MCC連接子(linker,藍色)和單克隆抗體組成。
本研究選擇了與Zeno™ EAD相結合的DDA方法。采用這種方法,不僅可以執行常規的肽圖分析,而且EAD可以在同一針分析中進行高級表征。此外,Zeno EAD增強了碎片離子的檢測能力,從而正確鑒定了低豐度物質。圖2展示了在偶聯肽SCDK [DM1]THTCPPCPAPELLGGPSVFLFPPKPK上觀察到的碎裂模式的例子。在分析中未觀察到沒有連接子和藥物或其部分的肽,表明其完全偶聯。獲得了此肽段高質量的MS / MS譜圖,從而使該特定肽段的MS / MS序列覆蓋率達到96.6%。一個更占優勢的碎片從 m/z大于500的有效載荷產生(請見圖2中的標記)。觀察到的有效載荷結構的主要裂解位點是DM1的COO-C鍵,這種碎裂模式與先前利用CID技術產生的一系列小碎片的數據不同1。較大分子量的藥物碎片可以用作特征碎片,以更具體地確認有效載荷的存在,并可以用來確認有效載荷的結構。
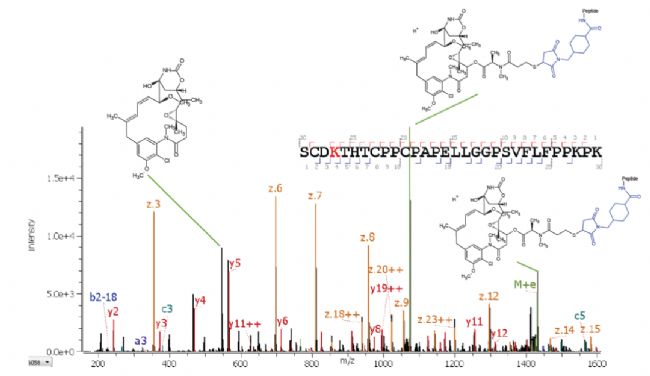
圖2. 應用Zeno EAD得到的偶聯肽SCDK [DM1] THTCPPCPAPELLGGPSVFLFPPKPK(z =+4)的碎片數據。來自肽段主鏈指定偶聯肽段離子的全掃描MS / MS數據,以及有效載荷中的碎離子信息。
此外,通過將Zeno EAD技術用于增強的碎片離子檢測,還可以很好地檢測到來自肽段主鏈的片段信息,從而提供有關肽段的分子完整性的信息。由于酶的空間位阻,抗體上偶聯藥物的存在會導致樣品制備酶解過程中的更多漏切位點。另外,賴氨酸殘基和有效載荷之間的結合過程是隨機反應,偶聯的比率并不總是100%,這導致了多樣性和低豐度物質存在。當一個肽段中存在多個潛在連接形式時,鑒定正確的連接位點可能是一個挑戰。
肽段ASQDVNTAVAWYQQKPGKAPK是這種具有挑戰性的另一個例子(圖3)。它包含一個漏切位點和一個脯氨酸相鄰的N端賴氨酸,導致偶聯位點的多種選擇。但是,有了從EAD技術碎裂得到豐富、高質量的MS / MS質譜圖,就可以實現藥物定位的自動匹配(圖3A)。由于有效載荷靠近肽的C端,因此檢測到的C離子比Z離子豐富(圖3A),而未結合的肽顯示出來自C端和N端的豐富片段(圖3B)。眾所周知因為電子活化解離技術不會解離脯氨酸的N端,我們還檢測到了除了C15以外的從C3到C17的全系列C片段7。這提供了確鑿的證據表明K15未與細胞毒藥物偶聯。此外,z4,z5和z7表明K18(而非K21)是藥物偶聯的正確位點。
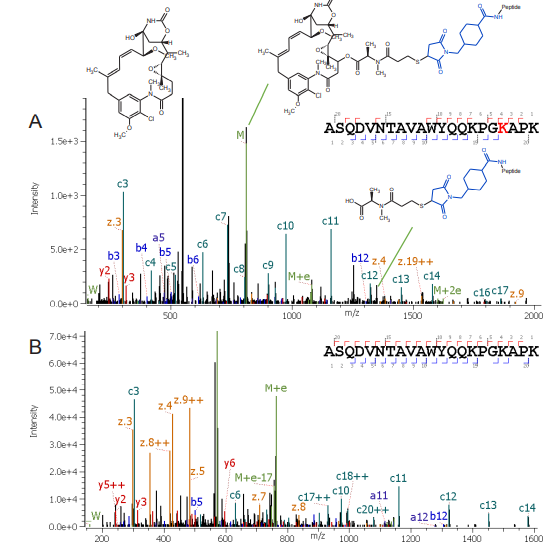
圖3. 應用Zeno EAD得到的來自偶聯/非偶聯肽ASQDVNTAVAWYQQKPGK [DM1] APK(z =+3)的碎片的數據。A:來自肽段主鏈指定偶聯肽段離子的全掃描MS / MS數據,以及有效載荷中的碎離子信息。B:來自肽段主鏈指定非偶聯肽的全掃描MS / MS數據。 連接子顯示為藍色,DM1藥物顯示為黑色。
結論:
-
通過EAD的新型碎裂模式,實現了具有多個潛在位點的多肽中藥物偶聯的準確定位
-
與傳統的MS / MS分析相比,EAD技術獲得更豐富的MS/MS碎片信息。應用Zeno EAD技術,即使對于中等強度或極低強度的母離子(例如低豐度的偶聯肽),也能獲得令人信服的二級碎片和出色的數據質量
-
SCIEX ZenoTOF™ 7600系統強大、高重現性且易于使用的多重碎裂技術,使用戶能夠以簡單的方式解決具有挑戰性的分析問題
應用電子活化解離(EAD)技術
進行抗體-藥物偶聯物(ADC)表征





