基因治療-創新多重技術組合嚴控腺相關病毒(AAV)質量
--基因治療與AAV--
基因治療是指將外源正常基因導入靶細胞,以糾正或補償缺陷和異常基因引起的疾病,從而達到治療目的。所有基因療法都利用病毒或非病毒載體將DNA或RNA輸送到宿主細胞中。與非病毒載體(如陽離子脂質或化學載體)相比,病毒載體感染宿主細胞的效率更高,但同時它們可能具有免疫原性副作用。因此,在開發藥物時,選擇合適的病毒載體是至關重要的組成部分。腺病毒相關病毒(Adenovirus Associated Virus,AAV)AAV是一類單鏈線狀DNA缺陷型病毒。其基因組DNA小于5kb,無包膜,外形為裸露的20面體顆粒。AAV不能獨立復制,只有在輔助病毒(如腺病毒、單純皰疹病毒、痘苗病毒)存在時,才能進行復制和溶細胞性感染。腺相關病毒(AAV)作為一種安全有效的載體,目前已應用于多個臨床試驗。
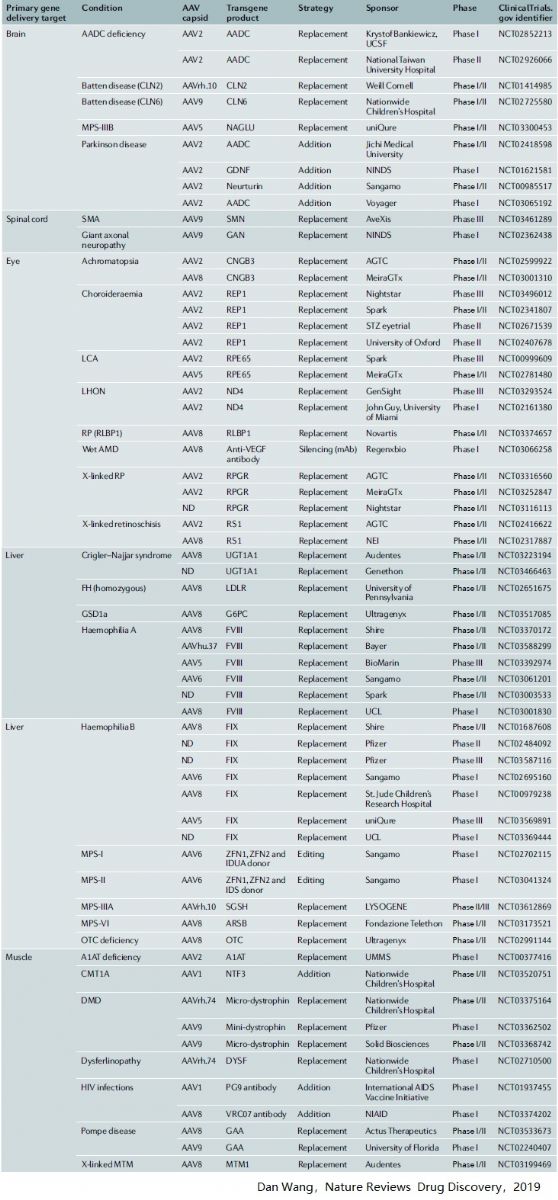
臨床研究項目中AAV1和AAV2約占50%
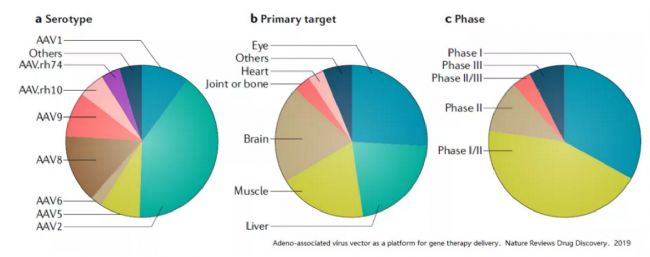
-質量控制--
Wes全自動定量Western Blot
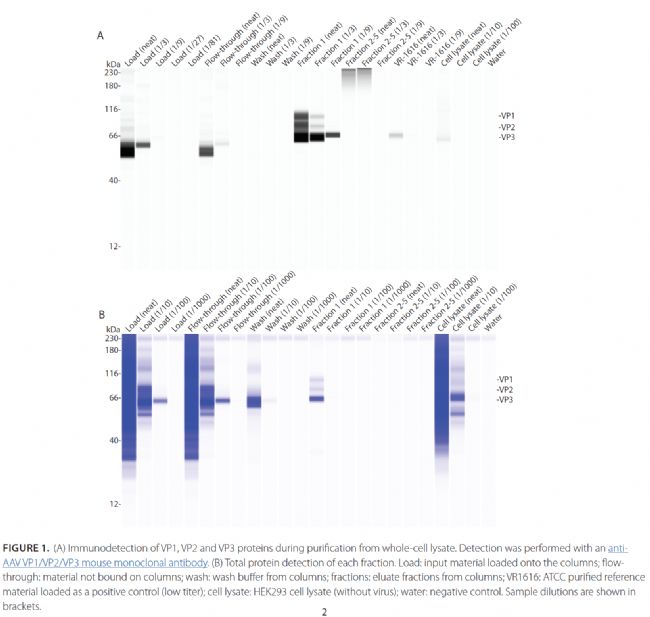
在AAV生產過程中,使用SDS-PAGE通過Western Blot來鑒定蛋白。然而,傳統的Western Blot手動操作繁瑣,重復性差,并且僅是半定量,不宜用于工業產品質量控制。Wes全自動定量western以其獨特優勢逐漸替換傳統western blot,可用于新型AAV衣殼的表達到下游制造全程質量控制中。
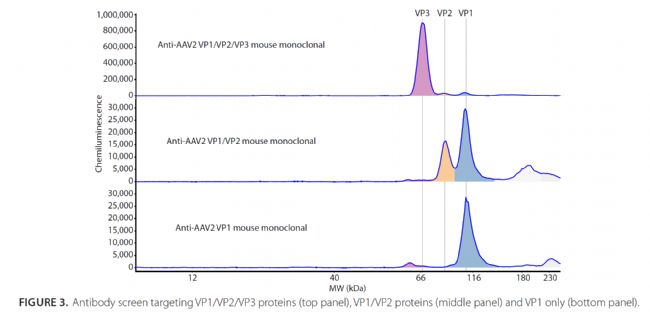
鑒定衣殼蛋白VP1/2/3
篩選抗體
檢測動態范圍

將市售AAV2(1x1013 GC/mL,33.8μg/mL)進行從1:8至1:256的2X倍比稀釋,Wes檢測VP1/VP2/VP3。
Maurice表征AAV電荷異質性與所有治療藥物一樣,基因療法,需要表征包裝藥物的遞送載體電荷等。使用全柱成像毛細管等電聚焦電泳法(icIEF)來表征AAV的電荷異質性,可以確保產品的穩定性和一致性。
Maurice兼具CE-SDS和iCIEF雙功能。兩種功能均入選國家藥典。
自發熒光和紫外吸光度比較
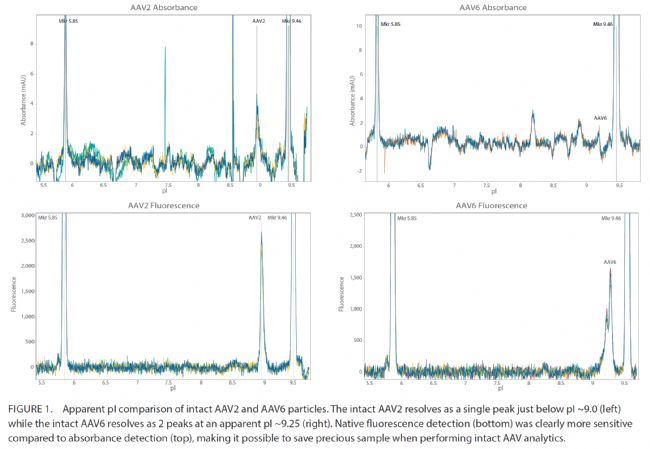
Maurice同時兼具紫外吸光度和自發熒光檢測通道。與吸收檢測相比,自發熒光的靈敏度高3-5倍,可以更好檢測出AAV特征性異構體峰。因而自發熒光模式更適合AAV病毒電荷表征。
Intra-assay CV
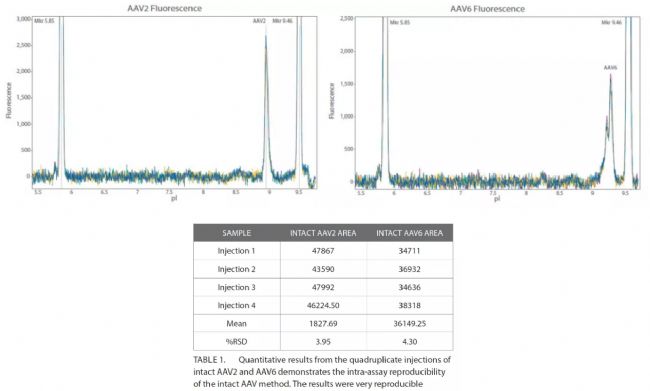 AAV2和AAV6樣品一式四份進樣,檢測Intra-assay重現性(圖2)。結果顯示其高重現性:AAV2和AAV6的%RSD分別為3.95%和4.30%(表1)。
AAV2和AAV6樣品一式四份進樣,檢測Intra-assay重現性(圖2)。結果顯示其高重現性:AAV2和AAV6的%RSD分別為3.95%和4.30%(表1)。
Inter-assay CV
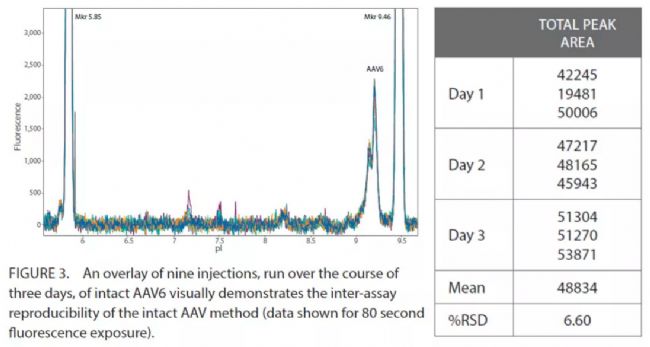
AAV6樣品三次獨立實驗,每次實驗三次重復,來檢測Inter-assay重現性(圖3)。%RSD為6.6%(表2)。
變性AAV蛋白電荷表征

AAV病毒蛋白會進行幾種翻譯后修飾,包括糖基化和脫酰胺作用。應激引起的病毒蛋白脫酰胺作用可能導致載體活性,衣殼裝配和轉導效率降低1。icIEF方法通常用于監測由唾液酸化,糖基化和脫酰胺作用誘導的單克隆抗體的電荷異質性,因此對AAV病毒蛋白也進行類似的評估。使用一式三份電泳圖疊加使用吸光度和自發熒光檢測法進行評估,AAV2電荷變異體可以清晰分辨和重現(圖4)。
靈敏度及線性

將變性的AAV2從〜3 x 1012 GC/mL連續滴定至〜3 x 1011 GC/mL(圖6)以建立方法的靈敏度。該滴定范圍內觀察到很強的線性相關性,R2為0.9956。
監測AAV顆粒穩定性

對完整的AAV樣品進行溫度壓力測試,以確定是否可以使用Maurice監測病毒載體的穩定性或衣殼蛋白脫酰胺。
AAV6顆粒非常穩定,在37°C或50°C下保持10分鐘完整無缺。但是,當AAV6顆粒在60°C下10分鐘時,不穩定。監控AAV批間差
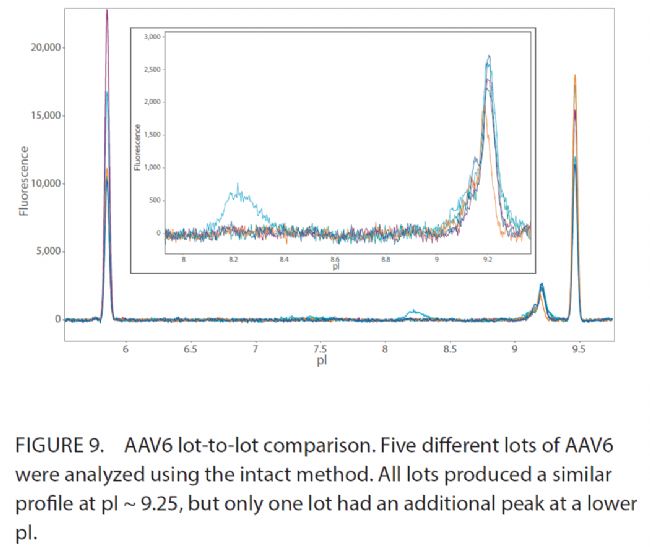
利用Maurice icIEF天然熒光監測批次間變異,以鑒別病毒載體批間差別。五批不同的AAV6,每批具有不同的基因組含量/mL(GC/mL),Maurice icIEF自發熒光分析(圖9)。結果顯示,所有五個批次在pI〜9.25左右均產生相似的峰形。但是,在一批中觀察到了一個較低pI的附加峰,表明該樣品與其他四批樣品不同。
主要參考資料1. Deamidation of amino acids on the surface of adeno-associated virus capsids leads to charge heterogeneity and altered vector function, AR Giles, JJ Sims, KB Turner, L Govindasamy, MR Alvira, M Lock, JM Wilson, Mol Ther, 2018; 26(12):2848-2862.
2.Dan Wang, Phillip W. L. Tai and Guangping Gao,Adeno-associated virus vector as a platform for gene therapy delivery,Nature Reviews Drug Discovery, 2019
.





