南模助力揭示心臟流出道血管平滑肌細胞發育新模式
心臟流出道發育異常是造成先天性心臟病的一種重要原因,其參與形成許多復雜性心血管畸形,約占復雜畸形發生率的25%。在流出道發育過程中,一系列不同類型的細胞群體(包括心肌細胞、間充質細胞、平滑肌細胞等)之間將會有復雜的相互影響及轉換,但具體模式鮮有系統性研究。
2019年7月30日,國際學術期刊Cell Reports在線發表了中國醫學科學院阜外醫院周洲課題組的最新科研成果“Single-Cell RNA-Seq of the Developing Cardiac Outflow Tract Reveals Convergent Development of the Vascular Smooth Muscle Cells”。
該研究系統分析了小鼠心臟流出道5萬多個細胞(來自3個連續發育時期)的單細胞轉錄組,并結合單分子熒光原位雜交和譜系示蹤技術,發現在心臟流出道發育過程中存在心肌細胞向血管平滑肌細胞轉換的情況,進而首次提出了大動脈基部平滑肌匯聚發育的概念。
南模生物為該研究提供了Tnnt2-Dre;CAG-RSR-tdTomato小鼠模型。
研究人員首先通過單細胞測序數據分析發現心臟流出道發育過程涉及6種類型的細胞,并可進一步細分為17個亞群(Fig.1)。
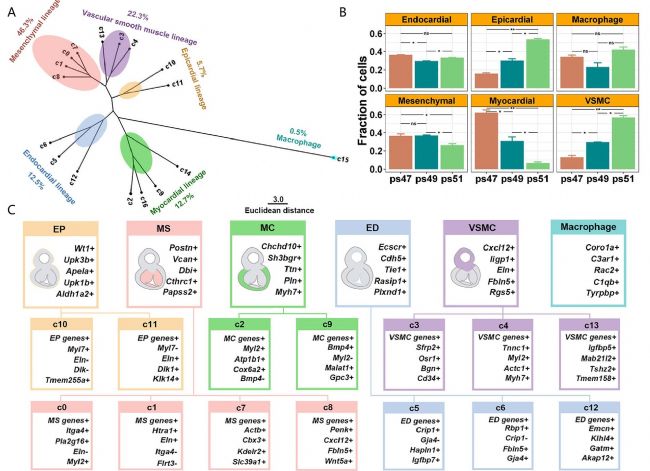
為了搞清細胞亞群之間的關系,研究人員構建了力導向的KNN圖(Fig.2),分析細胞亞群在3個連續發育時期的動態變化,發現除了間充質細胞以外,還有一類心肌細胞(C9亞群)也同時向平滑肌細胞進行轉變。因此作者提出一種假說,心臟流出道的平滑肌存在一種稱為“匯聚發育”的模式。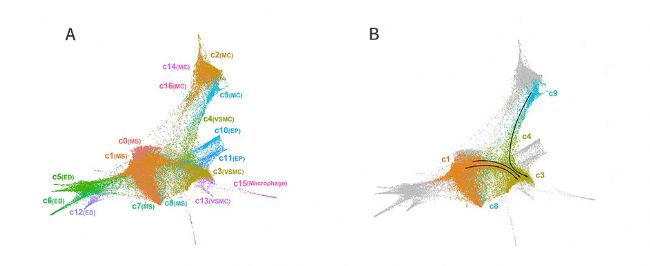
通過單分子熒光原位雜交技術(Fig.3),研究人員對心臟流出道連續橫切面(從近端到遠端)進行觀察,發現了其從心肌細胞表型向平滑肌細胞逐漸過渡的現象,并且觀察到表達Myh7(心肌細胞標志物)的細胞也同時表達Cxcl12(血管平滑肌標志物),驗證了在心臟流出道發育過程中心肌細胞向平滑肌細胞轉變的推論。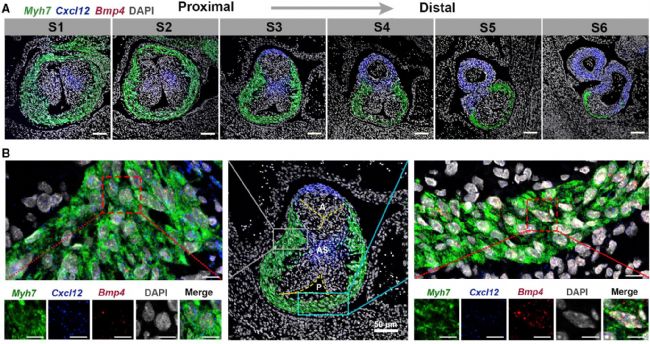
最后研究人員利用Dre-rox譜系示蹤技術(即構建Tnnt2-Dre; CAG-RSR-tdTomato小鼠模型,Fig.4),特異性地標記心肌細胞后代,通過觀察到tdTomato與Myh11基因(血管平滑肌標志物)的共表達再次驗證了流出道發育過程中心肌細胞向平滑肌細胞轉變的結論。
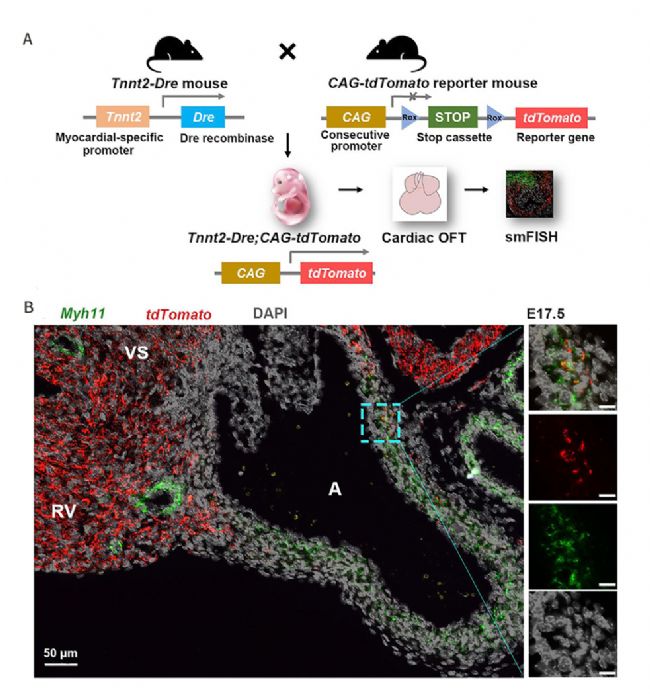 Fig4 譜系示蹤結果驗證流出道發育過程中心肌細胞向平滑肌轉變
Fig4 譜系示蹤結果驗證流出道發育過程中心肌細胞向平滑肌轉變大動脈基部平滑肌匯聚發育理論的出現,為心臟發育研究增添了新的維度,對了解先天性心臟病的發病機制、尋找新的治療方法提供了重要的理論依據和參考資料。
更多文獻解讀,關注南模生物公眾號吧!

- 慧榮和作為代表出席首屆專精特新小巨人企業生態大會
- 瑞孚迪與西湖維泰達成戰略合作共拓產前篩查新時代
- 碩果累累!谷豐光電與高校、科研機構合作成果盤點
- 復納亮相西交大分析測試論壇,深入剖析離子研磨技術
- 易科泰與法國 YellowScan 共探激光雷達市場新機遇
- 第十個中國航天日,回顧維拓啟創與中國航天的十年
- 10x Genomics技術方案更新(3月),新手冊邀您下載
- 易科泰受邀參加“十百千萬”農業新質人才培養工程
- 湘儀與重慶東暉簽約戰略合作伙伴
- Cytiva思拓凡:揚帆計劃-走入鼎康生物活動圓滿舉行
- 國儀量子EPR交流會福州大學站成功舉行
- 諾澤流體科技與德國Miccados GmbH正式達成戰略合作
- 蔡司ZEN core 軟件現可適配蔡司全系列掃描電鏡產品
- 明美光電2025年論文獎勵計劃正式發布
- 投稿有禮-2025 MCE中國生命科學研究促進獎正式啟動
- 重慶葆光全國招募植物遺傳轉化與基因編輯服務經銷商
- 葆光生物推出基因編輯載體構建與植物遺傳轉化服務
- 百趣生物,QPCR檢測低價來襲,贏“0元引物合成”
- Esco Ventures X “基因治療罕見病”網上論壇
- 課程預告,南模生物實驗室小鼠應用及操作系列講座
- 南方模式生物誠聘多地區科研銷售精英
- 南模生物Cre-loxP系統介紹及使用問題講座邀請
- 賽業生物成功完成2.85億人民幣B輪融資
- 南模生物TIGIT人源化小鼠助力新藥 IBI939 獲批臨床
- 南模生物公開課:基因修飾小鼠解鎖疾病研究新思路
- 云序生物5周年慶測序免費送,發SCI有獎勵
- 南模生物助力肝纖維化機制的研究
- 南模助力揭示心臟流出道血管平滑肌細胞發育新模式
- 南模生物助力發現NLRC3在樹突狀細胞中發揮關鍵作用
- 百奧賽圖邀您共同探討——生物醫藥研發的未來方向






