SPRm 200表面等離子體共振顯微鏡應用于細胞結合異質性的研究
癌癥等動態疾病在疾病過程中變得更加異質。由于異質性,惡性腫瘤可能包含具有不同分子特征的細胞。這可能導致疾病部位細胞亞群分布不均勻(空間異質性)或同一群體內細胞的分子組成發生變化(時間異質性)。準確評估異質性惡性細胞對于開發有效的治療方法至關重要。藥物開發的關鍵步驟是通過確定它們對細胞靶標的親和力以及異質天然環境中相互作用的動力學來篩選各種候選藥物。深入了解二維受體-配體結合動力學對于理解許多生理和病理過程很有幫助,從而為藥物設計和發現提供新的策略。
大多數細胞群中都存在一定程度的細胞異質性。此外,細胞間的差異可以顯著改變受體-配體結合反應,并且群體的整體行為可能不代表任何單個細胞的行為。這種細胞異質性主要由于基因變化、環境變化和細胞特性變化而產生。
本應用報告重點介紹了 Dong 等人最近研究細胞異質性對結合動力學的影響以及使用 SPRm 200(一種表面等離子體共振顯微鏡 (SPRM) 儀器)來測量細胞異質性對群體的影響的研究。SPRM 以其獨特的無標記測量每個細胞的結合動力學和表型的能力來解決細胞異質性問題。通過這種方式,可以對細胞群體進行統計分析,以確定結合相互作用的異質范圍(圖 1)并確定結合相互作用的主要模式。
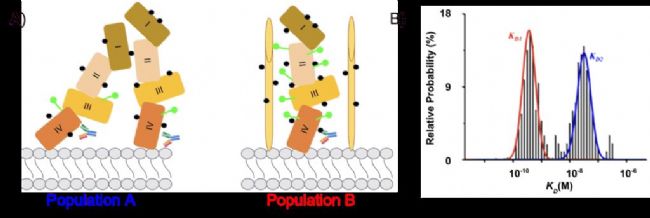
圖 1 (A) 抗 HER2 抗體與異質 HER2 分子(群體 A - 非糖基化 HER2 和群體 B - 糖基化 HER2)結合的示意圖。HER2 上包含一級胺基團的殘基表示為黑點,N 連接聚糖表示為綠色珠串。已識別 HER2 細胞外片段上的四個域。在群體 B 中,粘蛋白分子用于表示所有 HER2 鄰近蛋白,例如表皮和胰島素樣生長因子受體。(B) 使用 SPRm 200 對異質群體進行結合動力學測量。
本研究檢查了人表皮生長因子受體 2 (HER2) 蛋白中發生異常蛋白質糖基化所導致的異質性,HER2 是酪氨酸激酶受體家族的成員,如圖 1 所示。HER2 在 25–30% 的乳腺癌中過度表達,可以形成同二聚體或異二聚體(與 HER1、HER3 或 HER4),從而觸發一系列激酶/AKT 通路。過去,HER2 一直是單克隆抗體藥物赫賽汀和其他抗 HER2 抗體的靶向藥物。一些癌癥患者由于 HER2 受體被聚糖或大型糖蛋白(如 MUC4)掩蓋或物理阻斷而產生赫賽汀耐藥性。據報道,糖基化的 HER2 與其非糖基化(天然)對應物交聯。粘蛋白 4 (MUC4) 是一種大型且高度糖基化的跨膜蛋白,是可以與 HER2 共定位的幾種蛋白之一。研究表明,像 MUC4 這樣的蛋白的存在會阻礙赫賽汀與 HER2 的結合。根據 MUC4 和其他表皮和胰島素樣生長因子受體的相對位置,結合動力學因細胞而異。因此,HER2 和糖基化的 HER2 分子相對于其他類型的鄰近蛋白的排列方式可能千差萬別。所有這些都導致了動力學值的細胞間差異(異質性)甚至亞細胞位置之間的差異。雖然純化蛋白的動力學值可以作為藥物開發的良好指導,但很明顯,使用基于細胞的方法獲得的結果更具生物學意義和藥理學相關性,因為它們深入解決了細胞間差異。
表 1 通過抗 HER2 和天然細胞內形式的 HER2 結合相互作用測量的動力學參數
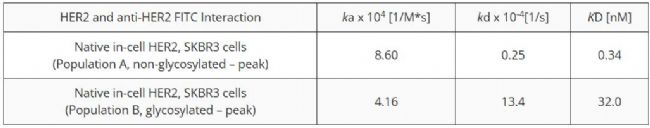
美國Biosensing Instrument Inc. 的 ImageSPR™ 軟件用于模擬 SPRM 傳感圖和細胞異質性的統計分析。天然 HER2 分子(本研究中也包括糖基化)的動力學值在不同細胞之間的差異相對較大。研究表明,細胞表面蛋白通常被嚴重糖基化,并且推測這種糖基化可能會影響表位的可及性和藥物與受體蛋白的結合。本研究中的結合相互作用遵循典型的 1:2 型動力學模型,其中與天然受體的相互作用更強,與糖基化受體的結合較弱(圖 2)。非糖基化細胞的結合速率常數 (ka) 更快,這表明糖基化 HER2 上的聚糖阻礙了抗體與結構域 IV 的結合。
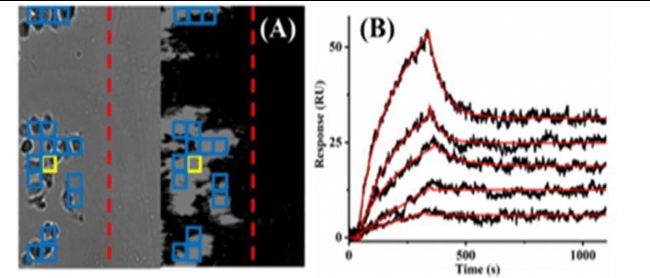
圖 2 (A) SKBR 細胞的明場 (左) 和 SPRM (右) 圖像顯示了分隔參考區域和細胞覆蓋區域的屏障 (紅色虛線) 以及用于獲取 (B) 中代表性傳感圖的 ROI (加粗黃色框)。注入的溶液含有 1.00、5.00、10.0、20.0 和 50.0 nM 抗體,紅色曲線是基于 1:2 結合模型的模擬傳感圖。
異質性是細胞系統的基本特性,但由于生物體的許多尺度(從單個分子到整個群體)的總體平均值,信息可能會丟失。因此,了解異質性是關鍵,因為它可以作為群體生理學的有用讀數和對擾動反應的預測指標。此外,了解由于細胞異質性而導致的細胞動力學差異(會影響動力學值的保真度)對于指導藥物發現過程以及在臨床環境中評估藥物功效和相關副作用非常重要。
SPRM 200介紹

應用:小分子藥物或抗體藥物與細胞膜蛋白(受體、離子通道等)原位結合分析;細胞精度統計學分布分析,研究細胞異質性差異;抗體藥物與單細胞或多細胞結合的篩選;細菌或病毒與抗菌性藥物的相互作用;其他分子細胞/活細胞層面原位研究。
功能:親和力測定;動力學分析;同步于SPR測量的光學成像;藥物對多細胞或單細胞作用的研究;細菌或病毒與抗性藥物相互作用的納米級別觀察。
特點:
- 無標記
- 實時定量
- 細胞膜蛋白原位分析
- 細胞膜上指定區域分析
- 電化學分析





