癌癥中的cfDNA羥甲基化檢測方法及臨床應用
在精準腫瘤學時代,異常的遺傳和表觀遺傳學變化鑒定促進了癌癥診斷、管理和治療方式的改變。DNA羥甲基化(5-羥甲基胞嘧啶,5hmC)是一種新興的表觀遺傳修飾,由TET酶通過氧化5-甲基胞嘧啶(5mC)形成。DNA羥甲基化表現出組織和癌癥特異性模式,在DNA去甲基化和基因調控中至關重要。5hmC檢測方法的最新進展,以及在游離細胞DNA(Cell-Free DNA,cfDNA)中鑒定5hmC,表明了游離細胞5hmC作為癌癥生物標志物的潛力。本文探討了DNA(尤其是cfDNA)羥甲基化在癌癥中的當前和新興技術及應用。

5hmC是一種在正常發育和基因調控等生物過程中發揮著重要作用的表觀遺傳修飾。5hmC失調會介導各種疾病(如癌癥)發展,這表明了其生物學過程中重要作用。液體活檢為獲得基因組和表觀基因組數據提供了無創方法,徹底改變了癌癥的篩查和治療方式。通過研究來自血漿等體液中的cfDNA,特別是循環腫瘤DNA(circulating tumour DNA,ctDNA)為捕捉腫瘤的異質性、監測遺傳和表觀遺傳動態以及檢測癌癥或復發的早期跡象提供了機會。以下內容從DNA羥甲基化的生物學角色和機制進行概述,并為DNA羥甲基化作為癌癥生物標志物的最新進展介紹了更新視角。最后討論了在5hmC研究中使用cfDNA和綜合多組學分析,并討論其在臨床應用中的機遇和挑戰。
DNA羥甲基化的生物學功能和機制
DNA去甲基化通路中的羥甲基化
DNA甲基化(5-甲基胞嘧啶,5mC)是哺乳動物DNA中研究最為深入的表觀遺傳標記,對基因調控至關重要。5mC可以通過DNA甲基轉移酶(DNMT)從S-腺苷甲硫氨酸(SAM)向胞嘧啶的5位共價轉移甲基基團來酶促產生。在主動去甲基化通路中,DNA 5hmC通過TET雙加氧酶(例如TET1、TET2和TET3)氧化5mC產生(圖1)。這一反應需要α-酮戊二酸(α-KG)和氧氣,在鐵和抗壞血酸(維生素C)下產生5hmC、琥珀酸和二氧化碳。TET酶進一步氧化5hmC產生5-甲酰胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),盡管這些中間體的存在于5hmC的頻率要低得多。與5hmC不同,5fC和5caC不穩定,分別被胸腺嘧啶DNA糖基化酶(TDG)和基礎切除修復(BER)機制切除和修復,恢復為未修飾的胞嘧啶形式。5hmC也可以通過激活誘導的胞嘧啶脫氨酶(AID)/載脂蛋白B mRNA編輯酶,催化多肽類(APOBEC)脫氨成5-羥甲基尿嘧啶(5mU),然后通過BER去甲基化。通過復制稀釋也可以發生胞嘧啶修飾的被動去甲基化。

與5mC、5fC和5caC相比,TET酶和TDG-BER耦聯機制對5hmC的親和力較低,表明5hmC是穩定的,并不容易去甲基化。此外,5hmC可以在多次細胞分裂中持續存在,表明它可能在去甲基化通路之外具有重要的生物學功能。
DNA 羥甲基化的生物學功能和分布
5hmC在胚胎發育、干細胞多能性、T淋巴細胞(T細胞)的缺失和分化、以及不同疾病的病因學等多種生物過程中發揮重要作用,并在活躍的基因調控中扮演著關鍵角色。5hmC主要在轉錄活躍區域中富集,如基因體、增強子以及啟動子周圍(圖2)。富含5hmC區域通常位于活躍的組蛋白修飾(例如H3K4me2和H3K4me3)和組蛋白標記的增強子(例如H3K4me1和H3K27ac)附近,表明它可能參與調節活躍的基因表達(圖2)。許多研究表明5hmC水平與基因表達之間存在正相關。

圖2:全基因組和位點特異性DNA羥甲基化模式。
盡管全基因組5hmC水平較低,但其在不同細胞類型、組織和疾病狀態下的分布差異很大。一般來說,5hmC在腦組織(約占所有胞嘧啶的0.67%)和胚胎干細胞中最普遍。5hmC豐度似乎與細胞增殖呈負相關,后有絲分裂細胞通常具有較高的5hmC水平。由于這些細胞往往具有高度的增殖性,導致在細胞系和腫瘤組織中檢測到的5hmC水平較低。
游離DNA和羥甲基化組
對游離細胞羥甲基化的研究開啟于2017年,song等人開發了一種高度敏感的化學標記檢測方法,能夠檢測到少量cfDNA輸入中的低水平5hmC。從那時起開始在各種臨床應用中被研究,包括早期癌癥檢測和預測癌癥結果。盡管與組織相比,cfDNA中的5hmC水平通常較低,但先前的研究表明cfDNA 5hmC模式和動態反映了組織中發生變化。此外,由于5hmC相對穩定,基因組DNA上的5hmC標記可以在cfDNA片段中重現,表明它有潛力作為一種微創的癌癥生物標志物。
癌癥中的DNA羥甲基化模式
DNA羥甲基化模式可以在全局(全基因組)或局部(位點特異性基因組,圖2)范圍內進行評估。在各種類型的癌癥中,包括膀胱、腦部、胰腺和乳腺癌,都檢測到全基因組5hmC丟失。在某些情況下,5hmC水平更大降低與更侵襲性腫瘤和更差預后相關。在皮膚T細胞淋巴瘤(CTCL)細胞系中,Qiu等人(2018年)觀察到隨著腫瘤侵襲性增加,5hmC逐漸丟失,其中大細胞轉化的CTCL細胞系顯示出最大的5hmC百分比降低,其次是未轉化的CTCL和前CTCL斑塊和補丁。同樣,Song等人(2017年)發現在非小細胞肺癌(NSCLC)中,cfDNA中的5hmC呈現階段依賴性缺失,其中轉移性NSCLC顯示出與非轉移性NSCLC和健康個體相比,歸一化羥甲基化區域的最低水平。但這些發現可能因所研究的組織類型和人群而異。例如,與Song等人(2017年)的研究不同,其他在中國人群中進行的NSCLC研究報告稱,與健康對照組相比,癌癥中的5hmC水平全基因組增加。盡管如此,整體5hmC模式在癌癥和非癌癥對照之間顯示出不同的特征。
癌癥中也在轉錄活躍區域描述了特定基因位點的5hmC增加。在結直腸癌的cfDNA研究中,Li等人(2017年)報告了5hmC在基因體、開放染色質區域(DNaseI高敏感位點)以及帶有活躍組蛋白修飾(H3K27ac,H3K4me1,H3K9me1)的區域富集。在另一項研究中,Sjöstrom等人(2022年)揭示了前列腺癌驅動基因的增強子或轉錄起始位點上游的局部5hmC富集,尤其是雄激素受體(AR)和叉頭盒蛋白A1(FOXA1),與其基因表達相關。表明5hmC失調可能導致疾病狀態,即使在驅動基因上沒有遺傳突變。
總的來說,這些研究表明整體和局部5hmC模式是強大的標記物,能夠區分癌癥和非癌癥樣本,暗示了5hmC作為癌癥生物標志物的潛力,盡管還需要進一步研究。
羥甲基化檢測方法的演變
在過去十年中,對羥甲基化組的定量和分析取得了顯著進展。早期5hmC分析研究主要通過質譜、薄層色譜、高效液相色譜(HPLC)、免疫檢測和光譜技術等定量方法。雖然這些方法能夠準確定量5hmC水平,但其樣本制備復雜性、高昂的設備和試劑成本以及低分辨率使得它們在臨床環境中難以實施。自那以后,科學家們開發出了基于測序的方法,用于全基因組和單堿基分辨率的分析。表1總結了最常見的5hmC分析技術。
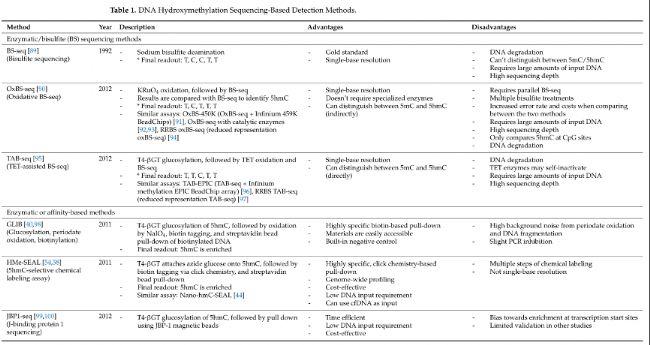
亞硫酸鹽測序方法
亞硫酸鹽測序(BS-seq)是DNA甲基化分析的黃金標準方法,能夠提供全基因組范圍內的單堿基分辨率評估。傳統的BS-seq用亞硫酸鈉處理DNA,將未修飾的胞嘧啶(C)、5fC和5caC脫氨基成尿嘧啶(U),并將5hmC轉化為胞嘧啶-5-甲磺酸(CMS),而5mC保持不變。由于5mC和CMS的最終讀數(readout)都是胞嘧啶,BS-seq的一個限制是無法區分5mC和5hmC。為了克服這一障礙,可以在亞硫酸鹽處理前添加化學物質來保護或修飾堿基,從而實現對甲基化狀態的更精確區分。 氧化亞硫酸鹽測序(OxBS-seq)和TET輔助亞硫酸鹽測序(TAB-seq)是改良亞硫酸鹽技術的示例。OxBS-seq利用高碘酸鉀(KRuO4)將5hmC氧化成5fC。由于5fC是一種不穩定的中間體,TDG和BER機制會將其再轉化為胞嘧啶,使其在亞硫酸鹽處理下發生脫氨基。與傳統亞硫酸鹽測序讀數比較,可以識別5hmC(BS-seq中的“C”和OxBS-seq中的“T”)。TAB-seq依賴于T4噬菌體β-葡萄糖基轉移酶(T4-βGT)將葡萄糖基團轉移到5hmC上,保護其不受TET1氧化。經過氧化和亞硫酸鹽處理后,最終讀數(readout)允許直接識別5hmC(5hmC讀作“C”,而胞嘧啶、5mC和其他氧化衍生物讀作“T”)。
酶促和親和方法
為了克服基于亞硫酸鹽方法的局限性,非亞硫酸鹽技術使用化學物質、酶和抗體來葡萄糖基化、脫氨基、氧化或選擇性地拉下5hmC,以捕獲其全基因組分布。這些策略反過來提高了5hmC分析技術的靈敏度、特異性和可行性,為臨床應用的過渡提供了便利。
5hmC選擇性化學標記(HMe-SEAL)是另一種基于葡萄糖基化的技術,它利用T4-βGT將修飾的疊氮葡萄糖分子轉移到5hmC上。隨后通過點擊化學添加生物素標簽,以及隨后的鏈霉親和素珠子拉下生物素化片段。目前,HMe-SEAL優化版本廣泛用于稀有細胞群體(Nano-hmC-Seal)和游離細胞DNA的5hmC分析。然而,像其他富集技術一樣,HMe-SEAL無法對5hmC位點進行單堿基分辨率分析,限制其定量5hmC水平。盡管如此,HMe-SEAL為cfDNA研究提供了一個機會,因為它需要的DNA起始量低,并且可以有效地富集含有5hmC的片段,從而實現更具成本效益的測序。
同樣,J結合蛋白1測序(JBP1-seq)也依賴于T4-βGT來葡萄糖基化5hmC。J結合蛋白1是葡萄糖基化5hmC的天然抗體。在一項比較JBP1-seq與HMe-SEAL和其他基于親和性的5hmC分析方法的研究中,JBP1-seq顯示出顯著不同的5hmC譜圖,并且無法將染色質狀態與5hmC模式相關聯。此外,它可能偏向于轉錄起始位點,導致5hmC的富集度降低。然而,優化的JBP1-seq工作流程已經展示了改進的5hmC富集能力,更快的性能(4.5小時)和降低的DNA起始量要求。需要進一步驗證以全面評估這種優化工作流程的性能。
其他葡萄糖基化方法包括Jump-seq和5hmC連接寡核苷酸引導測序(hmTOP-seq)。Jump-seq和hmTOP-seq都使用T4-βGT將疊氮葡萄糖附著在5hmC上,然后通過點擊化學標記帶有發夾或連接的寡核苷酸,并延伸引物以定位5hmC。最近,hmTOP-seq也被用于檢測cfDNA中的5hmC。盡管研究圍繞母血cfDNA的產前檢測展開,hmTOP-seq在極低測序深度下檢測胎兒唐氏綜合癥的準確性達到了100%。表明它有潛力成為分析游離細胞羥甲基化組的工具。然而,需要注意的是,Jump-seq和hmTOP-seq都依賴于間接方法來定量5hmC,可能會在測序后引入偏差和假象。此外,Jump-seq往往對高CpG密度區域有偏倚,如果5hmC峰太接近可能會表現不佳。
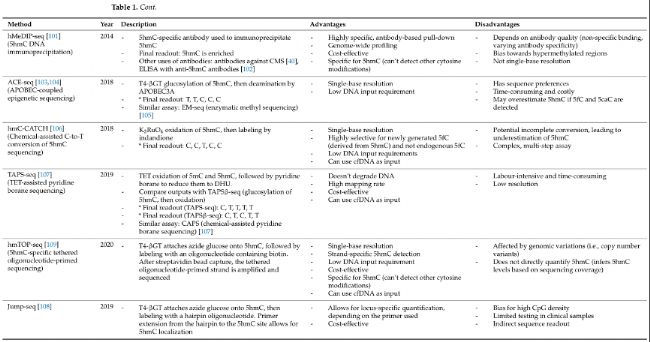
② DNA脫氨方法
AID/APOBEC酶是一種替代的DNA脫氨方法,無需亞硫酸鹽處理過程中產生的不穩定的磺化中間體。這一反應使用鋅輔因子來脫氨基單鏈DNA上的胞嘧啶。第一個采用這種策略的技術是APOBEC偶聯表觀遺傳測序(ACE-seq)。在ACE-seq中,5hmC首先通過T4-βGT葡萄糖基化以保護其不受隨后APOBEC3A脫氨基的影響。另一方面,5mC和其他未修飾的胞嘧啶將在APOBEC3A處理下被脫氨基。ACE-seq的一個主要優勢是,ACE-seq可以實現5hmC的單堿基分辨率比對,所需的DNA 起始量比BS-seq少1000倍。酶促甲基測序(EM-seq)遵循與ACE-seq相同的工作流程,但在葡萄糖基化之前使用TET2氧化5mC和5hmC。
單步脫氨基測序(SSD-seq)是另一種脫氨基技術,它利用特別設計的蛋白eA3A-v10來脫氨基胞嘧啶和5mC,但不脫氨基5hmC。這種方法消除了脫氨基前額外的葡萄糖基化或氧化步驟的需要。此外,eA3A-v10的脫氨基使用溫和的脫氨基反應,克服了亞硫酸鹽處理對DNA損傷的限制。像ACE-seq一樣,需要注意的是5hmC的reads可能包括5fC和5caC的痕跡,這可能會高估5hmC水平。然而,由于它們的普遍性和穩定性遠低于5hmC,可能不會對最終結果產生顯著影響。
新的脫氨基方法將脫氨基與現有的分析技術相結合,以提高全基因組5hmC檢測的分辨率。DNA免疫沉淀偶聯化學修飾輔助亞硫酸鹽測序(DIP-CAB-seq)是一種三步策略:(1)葡萄糖基化、點擊化學和生物素-鏈霉親和素互作,如HMe-SEAL,(2)APOBEC脫氨基,以及(3)單鏈測序。盡管DIP-CAB-Seq工作量大,但它展示了與HMe-SEAL相當的5hmC富集能力,同時實現了改進的單堿基分辨率檢測。同樣,基于富集的單堿基分辨率5hmC測序(EBS-seq)遵循類似的工作流程,其中APOBEC脫氨基發生在鏈霉親和素珠子拉下之前。即使在5hmC含量低的樣本中,如人類癌細胞系和組織,也能有效地檢測到5hmC。
④ 基于抗體方法
特異性靶向5hmC或其衍生物的抗體也可以用來捕獲羥甲基化DNA片段。羥甲基化DNA免疫沉淀(hmeDIP)利用單克隆抗5hmC抗體來捕獲和拉下羥甲基化DNA,已廣泛用于癌癥組織和細胞系中5hmC的局部和全基因組分析。盡管基于抗體的分析技術受到抗體結合效率的變異性限制,可能偏向于高羥甲基化區域,但它們具有成本效益、易于實施,并且可以對5hmC具有高度特異性。
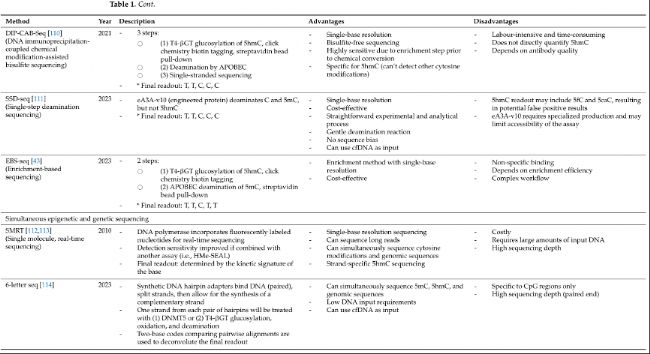
DNA羥甲基化及其臨床應用
5hmC作為一種有前途的癌癥生物標志物,展現出獨特的全局和局部模式,能夠區分癌癥和非癌癥樣本。以往的研究已經探索了它作為癌癥的診斷、預后和預測生物標志物的潛力,強調了它在癌癥管理中的實用性。圖3和表2突出了5hmC作為癌癥生物標志物的臨床應用示例。
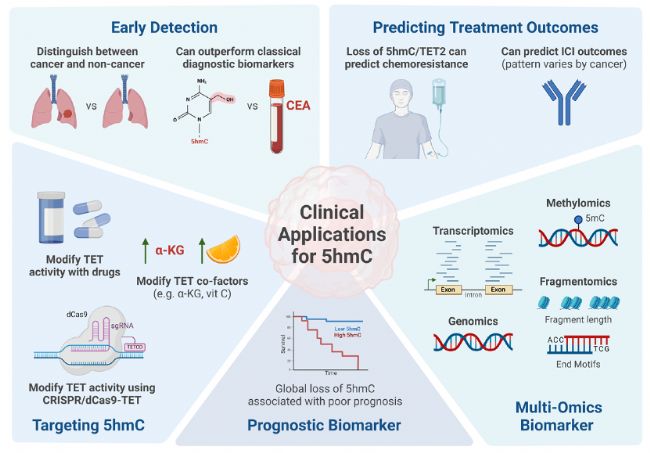
圖3:DNA羥甲基化在癌癥中的臨床應用。
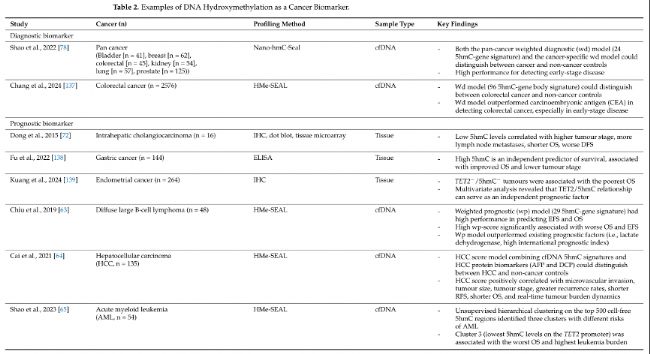
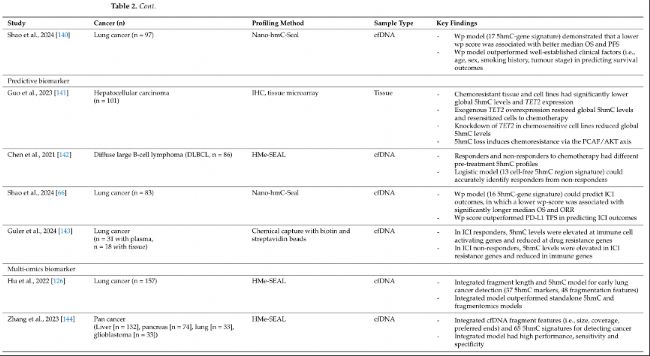

表2:DNA羥甲基化作為癌癥生物標志物示例。
DNA羥甲基化作為癌癥檢測的生物標志物
早期發現癌癥可以使得治療更加有效,預后更好,因此擁有可靠的診斷生物標志物至關重要。然而,由于早期腫瘤含量極低,尤其是循環腫瘤DNA(ctDNA),這使得檢測變得具有挑戰性。整體和特定基因位點的5hmC模式是很有前景的診斷生物標志物。
在一項泛癌研究中,Shao等人(2022年)利用健康個體和患有膀胱、乳腺、結直腸、腎臟、肺或前列腺癌患者的cfDNA建立了一個24個5hmC基因模型。他們的模型在驗證隊列中成功地區分了癌癥和健康個體(AUC=91%,靈敏度=68.6%,特異性=96.6%)。當單獨考慮每種癌癥時,他們的癌癥特異性加權診斷(wd)模型實現了從94%到99.8%的AUC,靈敏度從80%到96%,特異性從96%到100%。對于早期疾病的檢測性能也很高,泛癌靈敏度在71.4%和81.3%之間,癌癥特異性標志物在I期和II期疾病中分別為89.3%和94.1%。
在一項多中心研究METHOD-2(NCT03676075)中,Chang等人(2024年)還開發了一個能夠區分I-III期結直腸癌患者和非癌癥對照的cfDNA 5hmC分類器。他們基于96個5hmC基因體的模型在內部驗證中實現了94.3%的AUC,在外部驗證中實現了90.7%的AUC。他們的cfDNA 5hmC基礎分類器的性能超過了經典的結直腸癌生物標志物癌胚抗原(CEA),后者在內部和外部驗證隊列中的AUC分別為77.1%和73.2%。在90%的特異性下,基于5hmC的評分在I期和II/III期結直腸癌中的靈敏度為73.5%和85.3%,而CEA在同一階段的靈敏度分別為29.4%和47.2%。在肝細胞癌、肺癌和結直腸癌的研究也表明,基于5hmC的模型可以超越傳統的診斷生物標志物,突顯了5hmC在癌癥檢測中的潛力。
盡管全局和基因特異性的cfDNA 5hmC模式作為癌癥的診斷生物標志物具有潛力,甚至是對于早期疾病,但在這些模型可以轉化為臨床實踐之前,仍有幾個問題需要解決。首先,當前的診斷模型往往只關注基因特異性的5hmC標記,而其他富含5hmC的調控因子,如增強子,往往被忽視。將其他調控因子納入這些模型可以提高性能并改善我們對觀察到的5hmC模式背后的生物學的理解。其次,未來的研究應該優先驗證現有的基因標記模型,特別是在不同的地理和種族群體中,以評估這些模型的普適性。
DNA羥甲基化在癌癥中的預后價值
除了早期檢測,有證據支持5hmC分析在癌癥預后中的價值。例如,在肝內膽管癌(ICC)中,Dong等人(2015年)表明,與高/陽性5hmC水平相比,組織中低或陰性5hmC水平與更高的腫瘤階段、更多的淋巴結轉移、更短的總生存期和更差的無病生存期相關。同樣,Kuang等人(2024年)揭示了TET2/5hmC子宮內膜腺癌與其他TET2和5hmC表達組合相比,與最差的總生存期相關(p<0.001)。相比之下,TET2/5hmC子宮內膜癌與分化良好的細胞、最小的肌層侵襲、陰性淋巴結轉移和較低的腫瘤階段顯著相關。多變量分析進一步表明,TET2/5hmC關系可以作為子宮內膜癌的獨立預后因子(HR:2.84,95%CI 1.23–3.61,p=0.007)。同樣,在胃癌中,Fu等人(2022年)證明高5hmC是OS(風險比[HR]=0.61,95%CI0.38–0.98,p=0.04)和較低腫瘤階段(HR=0.32,95%CI0.13–0.77,p=0.011)的獨立、有利預測因子。
游離細胞5hmC標記也可用于癌癥預后或患者風險分層。在彌漫性大B細胞淋巴瘤(DLBCL)中,Chiu等人(2019年)創建了一個基于29個5hmC基因的加權預后(wp)模型,該模型在預測無進展生存期(EFS)和OS方面實現了96%的準確性、86%的靈敏度和100%的特異性。高加權預后(wp-score)的患者與低wp-score的患者相比,OS和EFS顯著更差。5hmC模型的靈敏度、特異性和準確性超過了現有的DLBCL預后因子,如乳酸脫氫酶水平升高、激活的B細胞型DLCBL和高國際預后指數(準確性=36–81%,靈敏度=56–80%,特異性=29–89%)。
在肝細胞癌(HCC)中,Cai等人(2021年)使用cfDNA 5hmC標記和兩個HCC蛋白生物標志物(甲胎蛋白[AFP]和去γ-羧基凝血酶原[DCP],表2)開發了一個HCC評分。高HCC評分與HCC的臨床病理預后因子,如微血管侵犯(MVI)、腫瘤大小和腫瘤階段,呈正相關,并且與更高的復發率、更短的無復發生存期和更短的OS顯著相關。同時,HCC評分也與實時腫瘤負擔動態正相關,表明其預測疾病復發的潛力。然而,這一發現受到研究樣本量小的限制。
在另一項研究中,Shao等人(2023年)使用基于H3K4me3標記的前500個最可變cfDNA 5hmC區域的無監督分層聚類,將54名急性髓系白血病(AML)患者分為三個聚類。第三聚類在TET2啟動子中表現出最低的5hmC水平,最短的OS和最高的白血病負擔。第三聚類和第一聚類之間的差異性羥甲基化區域(DhMR)富集在與不良預后相關的細胞生存/增殖通路中(例如,mTOR、ERK/MAPK和胰島素受體信號通路)。
同樣,在非小細胞肺癌(NSCLC)中,Shao等人(2024年)使用17個5hmC基因標記構建一個預后模型。低wp-score患者與高wp-score患者相比,平均OS(18.8vs.5.2個月,p=0.0006;HR0.22,95%CI0.09–0.57)和平均PFS(8.8vs.3.3個月,p=0.054;HR0.45;95%CI0.20–1.00)顯著更長。預后評分在預測生存結果方面比已知的臨床因子(如年齡、性別、吸煙史和腫瘤階段)更準確。
總的來說,這些研究表明游離細胞和基于組織的5hmC模式可以作為癌癥的預后生物標志物。對這些5hmC模式背后的基因和通路進行進一步的研究,將為導致不良預后風險因子提供更深入的見解。
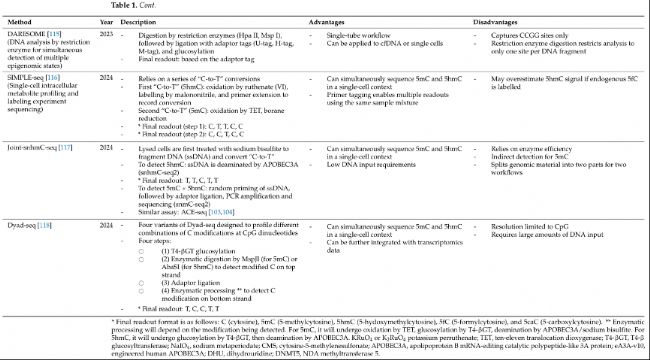
DNA羥甲基化整合的多組學分析
癌癥是幾個潛在生物網絡的總和,而不僅僅是個體現象。因此,研究DNA 5hmC與其他生物學層面(如甲基化組學、片段組學和轉錄組學)的整合和互作日益增加。特別是研究cfDNA片段特征(片段組學),如大小、末端基序、鋸齒末端、核小體定位和覆蓋范圍,可以揭示腫瘤和非腫瘤DNA之間的差異。例如,ctDNA片段長度通常比cfDNA片段短(ctDNA中約145bp,cfDNA中約166bp)。在非小細胞肺癌(NSCLC)中,Hu等人(2022年)開發了一個整合了5hmC和片段組學模型的早期檢測模型。他們使用37個cfDNA 5hmC標記和48個片段特征(在不同窗口中短片段與長片段的比例),該模型能夠區分NSCLC患者和非癌癥對照組,并在兩個驗證隊列中實現了86-94%的AUC值,83-88%的靈敏度和78-90%的特異性。此外,這個整合模型的表現優于單獨的5hmC和片段模型,突出了將片段組學長度與cfDNA 5hmC結合用于癌癥檢測的價值。在一項泛癌研究中,Zhang等人(2023年)使用5hmC標記和多個cfDNA片段特征(包括大小、覆蓋范圍和優選末端)建立了一個診斷模型。該模型實現了高AUC值、靈敏度和特異性,展示了整合5hmC和片段特征用于癌癥診斷的潛力。整合的5hmC和片段組學模型也已在其他癌癥的早期檢測中進行了研究。
以前的研究小組還探索了5mC、5hmC和基因表達之間的互作,以更深入地理解癌癥背后的遺傳和表觀遺傳模式。Shi等人(2023年)結合了基因組、轉錄組、甲基化組和羥甲基化組的數據,以更好地理解膀胱癌復發的發展。他們證明盡管膀胱癌沒有已知的驅動突變,但5hmC或5mC誘導的轉錄變化與膀胱癌復發和腫瘤免疫逃逸相關通路有關。表明表觀遺傳改變在膀胱癌復發中可能比基因組突變發揮更顯著的作用。在兒童中樞神經系統(CNS)癌癥中,Lee等人(2024年)整合了5mC、5hmC和單核RNA-seq數據,以研究細胞類型組成對表觀遺傳學的影響。作者發現5mC和5hmC的豐度和變化受到腫瘤組成和異質性的強烈影響。他們還觀察到在腫瘤組織中5mC和5hmC的全基因組失調的普遍性,盡管5hmC在基因組中的豐度明顯低于5mC,這表明5hmC在腫瘤發生中具有獨立且至關重要的作用。
因此,將5hmC與其他組學數據集整合為增強當前癌癥生物標志物提供了機會,并加深了對5hmC模式和癌癥病理生理學的理解。
DNA羥甲基化靶點作為癌癥潛在治療策略
盡管已有多項研究報道了癌癥中5hmC的全局和局部模式,但推動這些變化的具體機制仍然難以捉摸。5hmC水平的降低與TET活性受損有關,這可能是由于TET基因的失活突變、TET表達下調以及TET輔因子和底物抑制。先前的研究表明,過表達TET可以顯著抑制細胞增殖、遷移和侵襲,而敲低TET則表現出相反的表型。因此,靶向TET可能為癌癥治療提供一種潛在策略。目前還沒有批準的藥物專門靶向TET蛋白進行癌癥治療。然而,先前的急性髓系白血病(AML)藥物篩選研究揭示了如NSC-311068和NSC-370284等化合物,它們可以抑制TET1表達,進而降低5hmC水平,以抑制體外和體內的細胞活力和腫瘤進展。另一種新興策略涉及使用CRISPR/cas9表觀基因組編輯工具,其中去活化的cas9(dcas9)與TET蛋白(TETCD)的催化域融合,以靶向并去甲基化由引導RNA(sgRNA)指定基因區域的DNA。Choudhury等人(2016年)使用CRISPR/dCas9-TET1CD系統進行的初步工作展示了體外BRCA1啟動子的成功去甲基化,從而恢復BRCA1表達,并抑制了多種癌細胞系的細胞生長。同樣,Xu等人(2018年)使用與TET3CD耦合的高保真度dcas9去甲基化腎臟纖維化中的高甲基化抗纖維化基因,展示了體外和體內抗纖維化基因Rasal1和Klotho的成功基因特異性重新激活。未來的研究方向,如優化sgRNA結合位點相對于目標的位置和研究脫靶效應,將提高這種CRISPR/Cas9技術的廣度和實用性。TET也可以通過改變其底物和輔因子的可用性間接修飾。例如,α-酮戊二酸(α-KG)是三羧酸循環(TCA)中的關鍵中間體,也是TET在去甲基化途徑中的底物。Liu等人(2023年)的研究表明,α-KG補充增加了黑色素瘤中TET2/3的活性,導致PD-L1啟動子處5hmC水平升高,提高了ICI的療效。異檸檬酸脫氫酶(IDH)基因IDH1和IDH2的突變也可能影響TET活性,因為突變酶將α-KG轉化為2-羥基戊二酸,這是TET催化位點的競爭性抑制劑。然而,IDH突變是否是癌癥中5hmC耗竭的主要原因仍不確定。維生素C是另一種可以增強TET活性的輔因子,從而增加5hmC水平。Peng等人(2018年)證明,維生素C處理可以以時間和濃度依賴性的方式恢復5hmC水平,同時抑制膀胱和腎臟癌細胞系的細胞增殖并誘導凋亡。盡管TET活性增加,但TET1/2/3的表達水平并沒有顯著變化,表明維生素C增強了TET活性,而不是表達水平。在其他癌癥中也觀察到了類似的發現,表明維生素C治療可能是癌癥的潛在選擇。 盡管α-KG和維生素C在改變TET活性方面顯示出潛力,但這些輔因子也參與多種細胞過程,因此可能導致意想不到的副作用。需要進一步研究這些輔因子改變的確切機制和后果。
挑戰和未來方向
選擇正確的5hmC檢測方法
5hmC檢測方法進步導致了研究羥甲基化組的全基因組分析策略的改進。目前的技術現在可以區分各種胞嘧啶修飾(表1),從而可以單獨評估每種修飾在腫瘤發生中的作用。同時對基因組和表觀基因組進行測序的新方法具有巨大的前景,為使用單一工作流程進行多組學分析提供了機會。然而,DNA輸入要求和測序成本等挑戰依然存在。此外,隨著cfDNA輸入的使用不斷增長,即使在低濃度下,也必須有能夠檢測5hmC的靈敏檢測方法。盡管如此,基于液體活檢技術的發展正在出現,可以提高cfDNA檢測的靈敏度和特異性。方法的選擇可能會受到分析解決這些障礙的程度或所選方法所需試劑的可用性的影響。
cfDNA羥甲基化的多組學分析
對癌癥檢測、預后和預測治療結果的cfDNA羥甲基化組進行分析正在取得進展。將5hmC數據與其他組學相結合,不僅可以補充當前的生物標志物模型,還可以更全面地了解癌癥生物學。然而,在臨床實施可行之前,需要解決幾個挑戰。
首先,每個血漿樣本中ctDNA含量有限(5-10ng/mL),這對多組學研究構成挑戰,因為進行多次檢測時ctDNA含量往往不足。
其次,多組學cfDNA研究的標準化方法仍然缺乏,因為這仍然是一個不斷發展的領域。開源生物信息學管道、ctDNA解卷積方法和合成參考對照(即DNA尖峰)的開發將有助于確保集成數據的可重復性和可比性。
第三,來自腫瘤微環境或外周血白細胞中cfDNA的表觀遺傳信號可能會破壞或稀釋正在研究的ctDNA信號。因此,至關重要的是要有適當的工具來細化腫瘤特異性5hmC信號,同時濾除背景、非腫瘤噪聲。目前的工具包括calling ctDNA變體和過濾外周血白細胞信號。
最后,擁有適當的生物信息學工具和基礎設施對于支持新發現的整合和分析至關重要。
結論
DNA羥甲基化作為癌癥檢測、預后和治療反應預測的生物標志物具有巨大的前景。分析方法的進展,特別是cfDNA方法的進步,使人們能夠開發出高靈敏度和特異性的工具來檢測羥甲基化。通過將5hmC數據與其他多組學數據集整合,可以進一步增強這些發展,提供對癌癥機制的更全面了解,并有助于發現新的生物標志物和治療靶點。然而,在更廣泛地臨床采用5hmC生物標志物之前,仍有幾個挑戰需要解決。這些包括進一步驗證當前的生物標志物,解決測序和輸入相關的問題,以及建立必要的生物信息學工具和分析基礎設施。盡管如此,隨著對5hmC機制和檢測方法的持續研究,5hmC有可能成為改善癌癥治療的有價值的生物標志物。
參考文獻:
Li JJN, Liu G, Lok BH. Cell-Free DNA Hydroxymethylation in Cancer: Current and Emerging Detection Methods and Clinical Applications. Genes (Basel). 2024 Sep 3;15(9) pii: genes15091160. doi: 10.3390/genes15091160. PubMed PMID: 39336751.

DNA羥甲基化的生物學功能和機制
DNA去甲基化通路中的羥甲基化
DNA甲基化(5-甲基胞嘧啶,5mC)是哺乳動物DNA中研究最為深入的表觀遺傳標記,對基因調控至關重要。5mC可以通過DNA甲基轉移酶(DNMT)從S-腺苷甲硫氨酸(SAM)向胞嘧啶的5位共價轉移甲基基團來酶促產生。在主動去甲基化通路中,DNA 5hmC通過TET雙加氧酶(例如TET1、TET2和TET3)氧化5mC產生(圖1)。這一反應需要α-酮戊二酸(α-KG)和氧氣,在鐵和抗壞血酸(維生素C)下產生5hmC、琥珀酸和二氧化碳。TET酶進一步氧化5hmC產生5-甲酰胞嘧啶(5fC)和5-羧基胞嘧啶(5caC),盡管這些中間體的存在于5hmC的頻率要低得多。與5hmC不同,5fC和5caC不穩定,分別被胸腺嘧啶DNA糖基化酶(TDG)和基礎切除修復(BER)機制切除和修復,恢復為未修飾的胞嘧啶形式。5hmC也可以通過激活誘導的胞嘧啶脫氨酶(AID)/載脂蛋白B mRNA編輯酶,催化多肽類(APOBEC)脫氨成5-羥甲基尿嘧啶(5mU),然后通過BER去甲基化。通過復制稀釋也可以發生胞嘧啶修飾的被動去甲基化。

圖1:活性DNA去甲基化通路。
與5mC、5fC和5caC相比,TET酶和TDG-BER耦聯機制對5hmC的親和力較低,表明5hmC是穩定的,并不容易去甲基化。此外,5hmC可以在多次細胞分裂中持續存在,表明它可能在去甲基化通路之外具有重要的生物學功能。
DNA 羥甲基化的生物學功能和分布
5hmC在胚胎發育、干細胞多能性、T淋巴細胞(T細胞)的缺失和分化、以及不同疾病的病因學等多種生物過程中發揮重要作用,并在活躍的基因調控中扮演著關鍵角色。5hmC主要在轉錄活躍區域中富集,如基因體、增強子以及啟動子周圍(圖2)。富含5hmC區域通常位于活躍的組蛋白修飾(例如H3K4me2和H3K4me3)和組蛋白標記的增強子(例如H3K4me1和H3K27ac)附近,表明它可能參與調節活躍的基因表達(圖2)。許多研究表明5hmC水平與基因表達之間存在正相關。

圖2:全基因組和位點特異性DNA羥甲基化模式。
游離DNA和羥甲基化組
對游離細胞羥甲基化的研究開啟于2017年,song等人開發了一種高度敏感的化學標記檢測方法,能夠檢測到少量cfDNA輸入中的低水平5hmC。從那時起開始在各種臨床應用中被研究,包括早期癌癥檢測和預測癌癥結果。盡管與組織相比,cfDNA中的5hmC水平通常較低,但先前的研究表明cfDNA 5hmC模式和動態反映了組織中發生變化。此外,由于5hmC相對穩定,基因組DNA上的5hmC標記可以在cfDNA片段中重現,表明它有潛力作為一種微創的癌癥生物標志物。
癌癥中的DNA羥甲基化模式
DNA羥甲基化模式可以在全局(全基因組)或局部(位點特異性基因組,圖2)范圍內進行評估。在各種類型的癌癥中,包括膀胱、腦部、胰腺和乳腺癌,都檢測到全基因組5hmC丟失。在某些情況下,5hmC水平更大降低與更侵襲性腫瘤和更差預后相關。在皮膚T細胞淋巴瘤(CTCL)細胞系中,Qiu等人(2018年)觀察到隨著腫瘤侵襲性增加,5hmC逐漸丟失,其中大細胞轉化的CTCL細胞系顯示出最大的5hmC百分比降低,其次是未轉化的CTCL和前CTCL斑塊和補丁。同樣,Song等人(2017年)發現在非小細胞肺癌(NSCLC)中,cfDNA中的5hmC呈現階段依賴性缺失,其中轉移性NSCLC顯示出與非轉移性NSCLC和健康個體相比,歸一化羥甲基化區域的最低水平。但這些發現可能因所研究的組織類型和人群而異。例如,與Song等人(2017年)的研究不同,其他在中國人群中進行的NSCLC研究報告稱,與健康對照組相比,癌癥中的5hmC水平全基因組增加。盡管如此,整體5hmC模式在癌癥和非癌癥對照之間顯示出不同的特征。
癌癥中也在轉錄活躍區域描述了特定基因位點的5hmC增加。在結直腸癌的cfDNA研究中,Li等人(2017年)報告了5hmC在基因體、開放染色質區域(DNaseI高敏感位點)以及帶有活躍組蛋白修飾(H3K27ac,H3K4me1,H3K9me1)的區域富集。在另一項研究中,Sjöstrom等人(2022年)揭示了前列腺癌驅動基因的增強子或轉錄起始位點上游的局部5hmC富集,尤其是雄激素受體(AR)和叉頭盒蛋白A1(FOXA1),與其基因表達相關。表明5hmC失調可能導致疾病狀態,即使在驅動基因上沒有遺傳突變。
總的來說,這些研究表明整體和局部5hmC模式是強大的標記物,能夠區分癌癥和非癌癥樣本,暗示了5hmC作為癌癥生物標志物的潛力,盡管還需要進一步研究。
羥甲基化檢測方法的演變
在過去十年中,對羥甲基化組的定量和分析取得了顯著進展。早期5hmC分析研究主要通過質譜、薄層色譜、高效液相色譜(HPLC)、免疫檢測和光譜技術等定量方法。雖然這些方法能夠準確定量5hmC水平,但其樣本制備復雜性、高昂的設備和試劑成本以及低分辨率使得它們在臨床環境中難以實施。自那以后,科學家們開發出了基于測序的方法,用于全基因組和單堿基分辨率的分析。表1總結了最常見的5hmC分析技術。




表1:基于DNA羥甲基化測序的檢測方法。
亞硫酸鹽測序方法
亞硫酸鹽測序(BS-seq)是DNA甲基化分析的黃金標準方法,能夠提供全基因組范圍內的單堿基分辨率評估。傳統的BS-seq用亞硫酸鈉處理DNA,將未修飾的胞嘧啶(C)、5fC和5caC脫氨基成尿嘧啶(U),并將5hmC轉化為胞嘧啶-5-甲磺酸(CMS),而5mC保持不變。由于5mC和CMS的最終讀數(readout)都是胞嘧啶,BS-seq的一個限制是無法區分5mC和5hmC。為了克服這一障礙,可以在亞硫酸鹽處理前添加化學物質來保護或修飾堿基,從而實現對甲基化狀態的更精確區分。 氧化亞硫酸鹽測序(OxBS-seq)和TET輔助亞硫酸鹽測序(TAB-seq)是改良亞硫酸鹽技術的示例。OxBS-seq利用高碘酸鉀(KRuO4)將5hmC氧化成5fC。由于5fC是一種不穩定的中間體,TDG和BER機制會將其再轉化為胞嘧啶,使其在亞硫酸鹽處理下發生脫氨基。與傳統亞硫酸鹽測序讀數比較,可以識別5hmC(BS-seq中的“C”和OxBS-seq中的“T”)。TAB-seq依賴于T4噬菌體β-葡萄糖基轉移酶(T4-βGT)將葡萄糖基團轉移到5hmC上,保護其不受TET1氧化。經過氧化和亞硫酸鹽處理后,最終讀數(readout)允許直接識別5hmC(5hmC讀作“C”,而胞嘧啶、5mC和其他氧化衍生物讀作“T”)。
酶促和親和方法
為了克服基于亞硫酸鹽方法的局限性,非亞硫酸鹽技術使用化學物質、酶和抗體來葡萄糖基化、脫氨基、氧化或選擇性地拉下5hmC,以捕獲其全基因組分布。這些策略反過來提高了5hmC分析技術的靈敏度、特異性和可行性,為臨床應用的過渡提供了便利。
- 化學捕獲和葡萄糖基化技術
5hmC選擇性化學標記(HMe-SEAL)是另一種基于葡萄糖基化的技術,它利用T4-βGT將修飾的疊氮葡萄糖分子轉移到5hmC上。隨后通過點擊化學添加生物素標簽,以及隨后的鏈霉親和素珠子拉下生物素化片段。目前,HMe-SEAL優化版本廣泛用于稀有細胞群體(Nano-hmC-Seal)和游離細胞DNA的5hmC分析。然而,像其他富集技術一樣,HMe-SEAL無法對5hmC位點進行單堿基分辨率分析,限制其定量5hmC水平。盡管如此,HMe-SEAL為cfDNA研究提供了一個機會,因為它需要的DNA起始量低,并且可以有效地富集含有5hmC的片段,從而實現更具成本效益的測序。
同樣,J結合蛋白1測序(JBP1-seq)也依賴于T4-βGT來葡萄糖基化5hmC。J結合蛋白1是葡萄糖基化5hmC的天然抗體。在一項比較JBP1-seq與HMe-SEAL和其他基于親和性的5hmC分析方法的研究中,JBP1-seq顯示出顯著不同的5hmC譜圖,并且無法將染色質狀態與5hmC模式相關聯。此外,它可能偏向于轉錄起始位點,導致5hmC的富集度降低。然而,優化的JBP1-seq工作流程已經展示了改進的5hmC富集能力,更快的性能(4.5小時)和降低的DNA起始量要求。需要進一步驗證以全面評估這種優化工作流程的性能。
其他葡萄糖基化方法包括Jump-seq和5hmC連接寡核苷酸引導測序(hmTOP-seq)。Jump-seq和hmTOP-seq都使用T4-βGT將疊氮葡萄糖附著在5hmC上,然后通過點擊化學標記帶有發夾或連接的寡核苷酸,并延伸引物以定位5hmC。最近,hmTOP-seq也被用于檢測cfDNA中的5hmC。盡管研究圍繞母血cfDNA的產前檢測展開,hmTOP-seq在極低測序深度下檢測胎兒唐氏綜合癥的準確性達到了100%。表明它有潛力成為分析游離細胞羥甲基化組的工具。然而,需要注意的是,Jump-seq和hmTOP-seq都依賴于間接方法來定量5hmC,可能會在測序后引入偏差和假象。此外,Jump-seq往往對高CpG密度區域有偏倚,如果5hmC峰太接近可能會表現不佳。
② DNA脫氨方法
AID/APOBEC酶是一種替代的DNA脫氨方法,無需亞硫酸鹽處理過程中產生的不穩定的磺化中間體。這一反應使用鋅輔因子來脫氨基單鏈DNA上的胞嘧啶。第一個采用這種策略的技術是APOBEC偶聯表觀遺傳測序(ACE-seq)。在ACE-seq中,5hmC首先通過T4-βGT葡萄糖基化以保護其不受隨后APOBEC3A脫氨基的影響。另一方面,5mC和其他未修飾的胞嘧啶將在APOBEC3A處理下被脫氨基。ACE-seq的一個主要優勢是,ACE-seq可以實現5hmC的單堿基分辨率比對,所需的DNA 起始量比BS-seq少1000倍。酶促甲基測序(EM-seq)遵循與ACE-seq相同的工作流程,但在葡萄糖基化之前使用TET2氧化5mC和5hmC。
單步脫氨基測序(SSD-seq)是另一種脫氨基技術,它利用特別設計的蛋白eA3A-v10來脫氨基胞嘧啶和5mC,但不脫氨基5hmC。這種方法消除了脫氨基前額外的葡萄糖基化或氧化步驟的需要。此外,eA3A-v10的脫氨基使用溫和的脫氨基反應,克服了亞硫酸鹽處理對DNA損傷的限制。像ACE-seq一樣,需要注意的是5hmC的reads可能包括5fC和5caC的痕跡,這可能會高估5hmC水平。然而,由于它們的普遍性和穩定性遠低于5hmC,可能不會對最終結果產生顯著影響。
新的脫氨基方法將脫氨基與現有的分析技術相結合,以提高全基因組5hmC檢測的分辨率。DNA免疫沉淀偶聯化學修飾輔助亞硫酸鹽測序(DIP-CAB-seq)是一種三步策略:(1)葡萄糖基化、點擊化學和生物素-鏈霉親和素互作,如HMe-SEAL,(2)APOBEC脫氨基,以及(3)單鏈測序。盡管DIP-CAB-Seq工作量大,但它展示了與HMe-SEAL相當的5hmC富集能力,同時實現了改進的單堿基分辨率檢測。同樣,基于富集的單堿基分辨率5hmC測序(EBS-seq)遵循類似的工作流程,其中APOBEC脫氨基發生在鏈霉親和素珠子拉下之前。即使在5hmC含量低的樣本中,如人類癌細胞系和組織,也能有效地檢測到5hmC。
- 基于氧化策略
④ 基于抗體方法
特異性靶向5hmC或其衍生物的抗體也可以用來捕獲羥甲基化DNA片段。羥甲基化DNA免疫沉淀(hmeDIP)利用單克隆抗5hmC抗體來捕獲和拉下羥甲基化DNA,已廣泛用于癌癥組織和細胞系中5hmC的局部和全基因組分析。盡管基于抗體的分析技術受到抗體結合效率的變異性限制,可能偏向于高羥甲基化區域,但它們具有成本效益、易于實施,并且可以對5hmC具有高度特異性。
DNA羥甲基化及其臨床應用
5hmC作為一種有前途的癌癥生物標志物,展現出獨特的全局和局部模式,能夠區分癌癥和非癌癥樣本。以往的研究已經探索了它作為癌癥的診斷、預后和預測生物標志物的潛力,強調了它在癌癥管理中的實用性。圖3和表2突出了5hmC作為癌癥生物標志物的臨床應用示例。

圖3:DNA羥甲基化在癌癥中的臨床應用。



表2:DNA羥甲基化作為癌癥生物標志物示例。
DNA羥甲基化作為癌癥檢測的生物標志物
早期發現癌癥可以使得治療更加有效,預后更好,因此擁有可靠的診斷生物標志物至關重要。然而,由于早期腫瘤含量極低,尤其是循環腫瘤DNA(ctDNA),這使得檢測變得具有挑戰性。整體和特定基因位點的5hmC模式是很有前景的診斷生物標志物。
在一項泛癌研究中,Shao等人(2022年)利用健康個體和患有膀胱、乳腺、結直腸、腎臟、肺或前列腺癌患者的cfDNA建立了一個24個5hmC基因模型。他們的模型在驗證隊列中成功地區分了癌癥和健康個體(AUC=91%,靈敏度=68.6%,特異性=96.6%)。當單獨考慮每種癌癥時,他們的癌癥特異性加權診斷(wd)模型實現了從94%到99.8%的AUC,靈敏度從80%到96%,特異性從96%到100%。對于早期疾病的檢測性能也很高,泛癌靈敏度在71.4%和81.3%之間,癌癥特異性標志物在I期和II期疾病中分別為89.3%和94.1%。
在一項多中心研究METHOD-2(NCT03676075)中,Chang等人(2024年)還開發了一個能夠區分I-III期結直腸癌患者和非癌癥對照的cfDNA 5hmC分類器。他們基于96個5hmC基因體的模型在內部驗證中實現了94.3%的AUC,在外部驗證中實現了90.7%的AUC。他們的cfDNA 5hmC基礎分類器的性能超過了經典的結直腸癌生物標志物癌胚抗原(CEA),后者在內部和外部驗證隊列中的AUC分別為77.1%和73.2%。在90%的特異性下,基于5hmC的評分在I期和II/III期結直腸癌中的靈敏度為73.5%和85.3%,而CEA在同一階段的靈敏度分別為29.4%和47.2%。在肝細胞癌、肺癌和結直腸癌的研究也表明,基于5hmC的模型可以超越傳統的診斷生物標志物,突顯了5hmC在癌癥檢測中的潛力。
盡管全局和基因特異性的cfDNA 5hmC模式作為癌癥的診斷生物標志物具有潛力,甚至是對于早期疾病,但在這些模型可以轉化為臨床實踐之前,仍有幾個問題需要解決。首先,當前的診斷模型往往只關注基因特異性的5hmC標記,而其他富含5hmC的調控因子,如增強子,往往被忽視。將其他調控因子納入這些模型可以提高性能并改善我們對觀察到的5hmC模式背后的生物學的理解。其次,未來的研究應該優先驗證現有的基因標記模型,特別是在不同的地理和種族群體中,以評估這些模型的普適性。
DNA羥甲基化在癌癥中的預后價值
除了早期檢測,有證據支持5hmC分析在癌癥預后中的價值。例如,在肝內膽管癌(ICC)中,Dong等人(2015年)表明,與高/陽性5hmC水平相比,組織中低或陰性5hmC水平與更高的腫瘤階段、更多的淋巴結轉移、更短的總生存期和更差的無病生存期相關。同樣,Kuang等人(2024年)揭示了TET2/5hmC子宮內膜腺癌與其他TET2和5hmC表達組合相比,與最差的總生存期相關(p<0.001)。相比之下,TET2/5hmC子宮內膜癌與分化良好的細胞、最小的肌層侵襲、陰性淋巴結轉移和較低的腫瘤階段顯著相關。多變量分析進一步表明,TET2/5hmC關系可以作為子宮內膜癌的獨立預后因子(HR:2.84,95%CI 1.23–3.61,p=0.007)。同樣,在胃癌中,Fu等人(2022年)證明高5hmC是OS(風險比[HR]=0.61,95%CI0.38–0.98,p=0.04)和較低腫瘤階段(HR=0.32,95%CI0.13–0.77,p=0.011)的獨立、有利預測因子。
游離細胞5hmC標記也可用于癌癥預后或患者風險分層。在彌漫性大B細胞淋巴瘤(DLBCL)中,Chiu等人(2019年)創建了一個基于29個5hmC基因的加權預后(wp)模型,該模型在預測無進展生存期(EFS)和OS方面實現了96%的準確性、86%的靈敏度和100%的特異性。高加權預后(wp-score)的患者與低wp-score的患者相比,OS和EFS顯著更差。5hmC模型的靈敏度、特異性和準確性超過了現有的DLBCL預后因子,如乳酸脫氫酶水平升高、激活的B細胞型DLCBL和高國際預后指數(準確性=36–81%,靈敏度=56–80%,特異性=29–89%)。
在肝細胞癌(HCC)中,Cai等人(2021年)使用cfDNA 5hmC標記和兩個HCC蛋白生物標志物(甲胎蛋白[AFP]和去γ-羧基凝血酶原[DCP],表2)開發了一個HCC評分。高HCC評分與HCC的臨床病理預后因子,如微血管侵犯(MVI)、腫瘤大小和腫瘤階段,呈正相關,并且與更高的復發率、更短的無復發生存期和更短的OS顯著相關。同時,HCC評分也與實時腫瘤負擔動態正相關,表明其預測疾病復發的潛力。然而,這一發現受到研究樣本量小的限制。
在另一項研究中,Shao等人(2023年)使用基于H3K4me3標記的前500個最可變cfDNA 5hmC區域的無監督分層聚類,將54名急性髓系白血病(AML)患者分為三個聚類。第三聚類在TET2啟動子中表現出最低的5hmC水平,最短的OS和最高的白血病負擔。第三聚類和第一聚類之間的差異性羥甲基化區域(DhMR)富集在與不良預后相關的細胞生存/增殖通路中(例如,mTOR、ERK/MAPK和胰島素受體信號通路)。
同樣,在非小細胞肺癌(NSCLC)中,Shao等人(2024年)使用17個5hmC基因標記構建一個預后模型。低wp-score患者與高wp-score患者相比,平均OS(18.8vs.5.2個月,p=0.0006;HR0.22,95%CI0.09–0.57)和平均PFS(8.8vs.3.3個月,p=0.054;HR0.45;95%CI0.20–1.00)顯著更長。預后評分在預測生存結果方面比已知的臨床因子(如年齡、性別、吸煙史和腫瘤階段)更準確。
總的來說,這些研究表明游離細胞和基于組織的5hmC模式可以作為癌癥的預后生物標志物。對這些5hmC模式背后的基因和通路進行進一步的研究,將為導致不良預后風險因子提供更深入的見解。
DNA羥甲基化整合的多組學分析
癌癥是幾個潛在生物網絡的總和,而不僅僅是個體現象。因此,研究DNA 5hmC與其他生物學層面(如甲基化組學、片段組學和轉錄組學)的整合和互作日益增加。特別是研究cfDNA片段特征(片段組學),如大小、末端基序、鋸齒末端、核小體定位和覆蓋范圍,可以揭示腫瘤和非腫瘤DNA之間的差異。例如,ctDNA片段長度通常比cfDNA片段短(ctDNA中約145bp,cfDNA中約166bp)。在非小細胞肺癌(NSCLC)中,Hu等人(2022年)開發了一個整合了5hmC和片段組學模型的早期檢測模型。他們使用37個cfDNA 5hmC標記和48個片段特征(在不同窗口中短片段與長片段的比例),該模型能夠區分NSCLC患者和非癌癥對照組,并在兩個驗證隊列中實現了86-94%的AUC值,83-88%的靈敏度和78-90%的特異性。此外,這個整合模型的表現優于單獨的5hmC和片段模型,突出了將片段組學長度與cfDNA 5hmC結合用于癌癥檢測的價值。在一項泛癌研究中,Zhang等人(2023年)使用5hmC標記和多個cfDNA片段特征(包括大小、覆蓋范圍和優選末端)建立了一個診斷模型。該模型實現了高AUC值、靈敏度和特異性,展示了整合5hmC和片段特征用于癌癥診斷的潛力。整合的5hmC和片段組學模型也已在其他癌癥的早期檢測中進行了研究。
以前的研究小組還探索了5mC、5hmC和基因表達之間的互作,以更深入地理解癌癥背后的遺傳和表觀遺傳模式。Shi等人(2023年)結合了基因組、轉錄組、甲基化組和羥甲基化組的數據,以更好地理解膀胱癌復發的發展。他們證明盡管膀胱癌沒有已知的驅動突變,但5hmC或5mC誘導的轉錄變化與膀胱癌復發和腫瘤免疫逃逸相關通路有關。表明表觀遺傳改變在膀胱癌復發中可能比基因組突變發揮更顯著的作用。在兒童中樞神經系統(CNS)癌癥中,Lee等人(2024年)整合了5mC、5hmC和單核RNA-seq數據,以研究細胞類型組成對表觀遺傳學的影響。作者發現5mC和5hmC的豐度和變化受到腫瘤組成和異質性的強烈影響。他們還觀察到在腫瘤組織中5mC和5hmC的全基因組失調的普遍性,盡管5hmC在基因組中的豐度明顯低于5mC,這表明5hmC在腫瘤發生中具有獨立且至關重要的作用。
因此,將5hmC與其他組學數據集整合為增強當前癌癥生物標志物提供了機會,并加深了對5hmC模式和癌癥病理生理學的理解。
DNA羥甲基化靶點作為癌癥潛在治療策略
盡管已有多項研究報道了癌癥中5hmC的全局和局部模式,但推動這些變化的具體機制仍然難以捉摸。5hmC水平的降低與TET活性受損有關,這可能是由于TET基因的失活突變、TET表達下調以及TET輔因子和底物抑制。先前的研究表明,過表達TET可以顯著抑制細胞增殖、遷移和侵襲,而敲低TET則表現出相反的表型。因此,靶向TET可能為癌癥治療提供一種潛在策略。目前還沒有批準的藥物專門靶向TET蛋白進行癌癥治療。然而,先前的急性髓系白血病(AML)藥物篩選研究揭示了如NSC-311068和NSC-370284等化合物,它們可以抑制TET1表達,進而降低5hmC水平,以抑制體外和體內的細胞活力和腫瘤進展。另一種新興策略涉及使用CRISPR/cas9表觀基因組編輯工具,其中去活化的cas9(dcas9)與TET蛋白(TETCD)的催化域融合,以靶向并去甲基化由引導RNA(sgRNA)指定基因區域的DNA。Choudhury等人(2016年)使用CRISPR/dCas9-TET1CD系統進行的初步工作展示了體外BRCA1啟動子的成功去甲基化,從而恢復BRCA1表達,并抑制了多種癌細胞系的細胞生長。同樣,Xu等人(2018年)使用與TET3CD耦合的高保真度dcas9去甲基化腎臟纖維化中的高甲基化抗纖維化基因,展示了體外和體內抗纖維化基因Rasal1和Klotho的成功基因特異性重新激活。未來的研究方向,如優化sgRNA結合位點相對于目標的位置和研究脫靶效應,將提高這種CRISPR/Cas9技術的廣度和實用性。TET也可以通過改變其底物和輔因子的可用性間接修飾。例如,α-酮戊二酸(α-KG)是三羧酸循環(TCA)中的關鍵中間體,也是TET在去甲基化途徑中的底物。Liu等人(2023年)的研究表明,α-KG補充增加了黑色素瘤中TET2/3的活性,導致PD-L1啟動子處5hmC水平升高,提高了ICI的療效。異檸檬酸脫氫酶(IDH)基因IDH1和IDH2的突變也可能影響TET活性,因為突變酶將α-KG轉化為2-羥基戊二酸,這是TET催化位點的競爭性抑制劑。然而,IDH突變是否是癌癥中5hmC耗竭的主要原因仍不確定。維生素C是另一種可以增強TET活性的輔因子,從而增加5hmC水平。Peng等人(2018年)證明,維生素C處理可以以時間和濃度依賴性的方式恢復5hmC水平,同時抑制膀胱和腎臟癌細胞系的細胞增殖并誘導凋亡。盡管TET活性增加,但TET1/2/3的表達水平并沒有顯著變化,表明維生素C增強了TET活性,而不是表達水平。在其他癌癥中也觀察到了類似的發現,表明維生素C治療可能是癌癥的潛在選擇。 盡管α-KG和維生素C在改變TET活性方面顯示出潛力,但這些輔因子也參與多種細胞過程,因此可能導致意想不到的副作用。需要進一步研究這些輔因子改變的確切機制和后果。
挑戰和未來方向
選擇正確的5hmC檢測方法
5hmC檢測方法進步導致了研究羥甲基化組的全基因組分析策略的改進。目前的技術現在可以區分各種胞嘧啶修飾(表1),從而可以單獨評估每種修飾在腫瘤發生中的作用。同時對基因組和表觀基因組進行測序的新方法具有巨大的前景,為使用單一工作流程進行多組學分析提供了機會。然而,DNA輸入要求和測序成本等挑戰依然存在。此外,隨著cfDNA輸入的使用不斷增長,即使在低濃度下,也必須有能夠檢測5hmC的靈敏檢測方法。盡管如此,基于液體活檢技術的發展正在出現,可以提高cfDNA檢測的靈敏度和特異性。方法的選擇可能會受到分析解決這些障礙的程度或所選方法所需試劑的可用性的影響。
cfDNA羥甲基化的多組學分析
對癌癥檢測、預后和預測治療結果的cfDNA羥甲基化組進行分析正在取得進展。將5hmC數據與其他組學相結合,不僅可以補充當前的生物標志物模型,還可以更全面地了解癌癥生物學。然而,在臨床實施可行之前,需要解決幾個挑戰。
首先,每個血漿樣本中ctDNA含量有限(5-10ng/mL),這對多組學研究構成挑戰,因為進行多次檢測時ctDNA含量往往不足。
其次,多組學cfDNA研究的標準化方法仍然缺乏,因為這仍然是一個不斷發展的領域。開源生物信息學管道、ctDNA解卷積方法和合成參考對照(即DNA尖峰)的開發將有助于確保集成數據的可重復性和可比性。
第三,來自腫瘤微環境或外周血白細胞中cfDNA的表觀遺傳信號可能會破壞或稀釋正在研究的ctDNA信號。因此,至關重要的是要有適當的工具來細化腫瘤特異性5hmC信號,同時濾除背景、非腫瘤噪聲。目前的工具包括calling ctDNA變體和過濾外周血白細胞信號。
最后,擁有適當的生物信息學工具和基礎設施對于支持新發現的整合和分析至關重要。
結論
DNA羥甲基化作為癌癥檢測、預后和治療反應預測的生物標志物具有巨大的前景。分析方法的進展,特別是cfDNA方法的進步,使人們能夠開發出高靈敏度和特異性的工具來檢測羥甲基化。通過將5hmC數據與其他多組學數據集整合,可以進一步增強這些發展,提供對癌癥機制的更全面了解,并有助于發現新的生物標志物和治療靶點。然而,在更廣泛地臨床采用5hmC生物標志物之前,仍有幾個挑戰需要解決。這些包括進一步驗證當前的生物標志物,解決測序和輸入相關的問題,以及建立必要的生物信息學工具和分析基礎設施。盡管如此,隨著對5hmC機制和檢測方法的持續研究,5hmC有可能成為改善癌癥治療的有價值的生物標志物。
參考文獻:
Li JJN, Liu G, Lok BH. Cell-Free DNA Hydroxymethylation in Cancer: Current and Emerging Detection Methods and Clinical Applications. Genes (Basel). 2024 Sep 3;15(9) pii: genes15091160. doi: 10.3390/genes15091160. PubMed PMID: 39336751.
標簽:
DNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





