Cancer Cell(IF=50.3)文獻解析:揭秘膠質母細胞瘤治療新篇章
膠質母細胞瘤(Glioblastoma,GBM)是成人中常見的惡性腦腫瘤,其特征包括腫瘤壞死、微血管不穩定、抵抗常規治療、復發率高等。腫瘤相關巨噬細胞(TAM)是膠質母細胞瘤中主要的免疫浸潤細胞,直接與惡性細胞相互作用,促進腫瘤進展,在GBM中表現出顯著的異質性,因此,TAM已成為一個有吸引力的治療靶點。
目前在大規模的臨床試驗中還沒有觀察到顯著有效的靶向TAM的方法,這可能源于腫瘤內和腫瘤間細胞多樣性以及TAM池的可塑性。因此,探索TAM異質性和形成機制是設計靶向TAM腫瘤治療的關鍵。近期,陸軍軍醫大學第一附屬醫院全軍臨床病理學研究所卞修武院士/時雨副教授/平軼芳教授團隊聯合陸軍軍醫大學第一附屬醫院腦膠質瘤醫學研究中心/神經外科李飛副教授,華中科技大學武漢光電國家研究中心祁淑紅副研究員在Cancer Cell上發表了題為“Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization”的文章,該研究揭示了惡性膠質瘤內Mo-TAM的轉錄表型和空間分布異質性特征,鑒定出缺氧壞死微環境內富集的TAM缺氧亞群(Hypoxia-TAM)并證實其誘導微血管滲漏表型,闡明了靶向該亞群對膠質瘤血管正常化和提高抗腫瘤藥物遞送效率的治療學意義。(麥特繪譜提供能量代謝和蛋白質組檢測服務)

技術路線

圖1. 研究思路圖
研究結果
1. 單細胞轉錄組學對51例人惡性膠質瘤Mo-TAM進行分析,聚類注釋到具有缺氧響應、趨化運動、吞噬和抗原呈遞、脂代謝依賴、干擾素產生、核糖體合成特征的新功能亞群,并證實Mo-TAM多個亞群的轉錄特征在小鼠膠質瘤和人實體腫瘤中具有高度保守性。
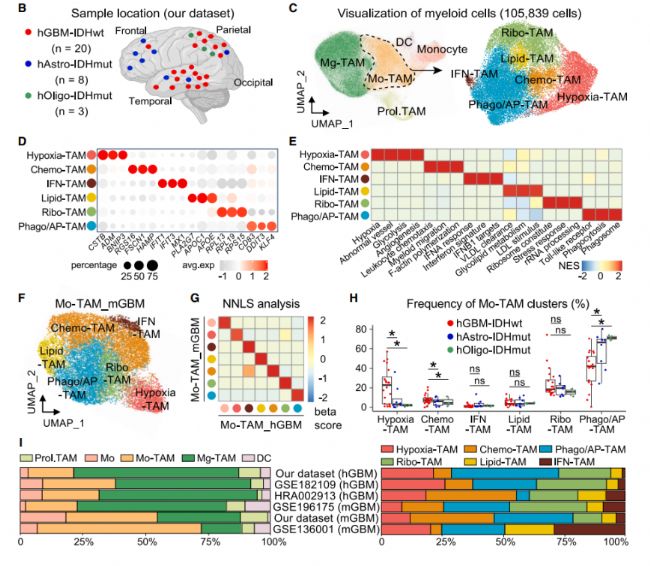
圖2. Mo-TAM的單細胞轉錄組學景觀
2. 空間轉錄組學揭示Mo-TAM的細胞多樣性及異質性,分析了35例人惡性膠質瘤空間轉錄組數據,建立了Mo-TAM不同亞群轉錄組特征與膠質瘤組織病理結構的空間映射網絡,繪制了Mo-TAM空間分布圖譜,發現不同Mo-TAM亞群在血管富集區、缺氧壞死區和侵襲前沿區的分布差異。

圖3. 空間轉錄組學揭示Mo-TAM的細胞多樣性特征
3. 多色免疫熒光成像證實了Hypoxia-TAM亞群在膠質瘤缺氧壞死區高度富集,發現空間缺氧梯度與Hypoxia-TAM表型轉化、膠質瘤細胞間質型轉化、糖酵解代謝重編程和微血管增生具有一定的相關性。
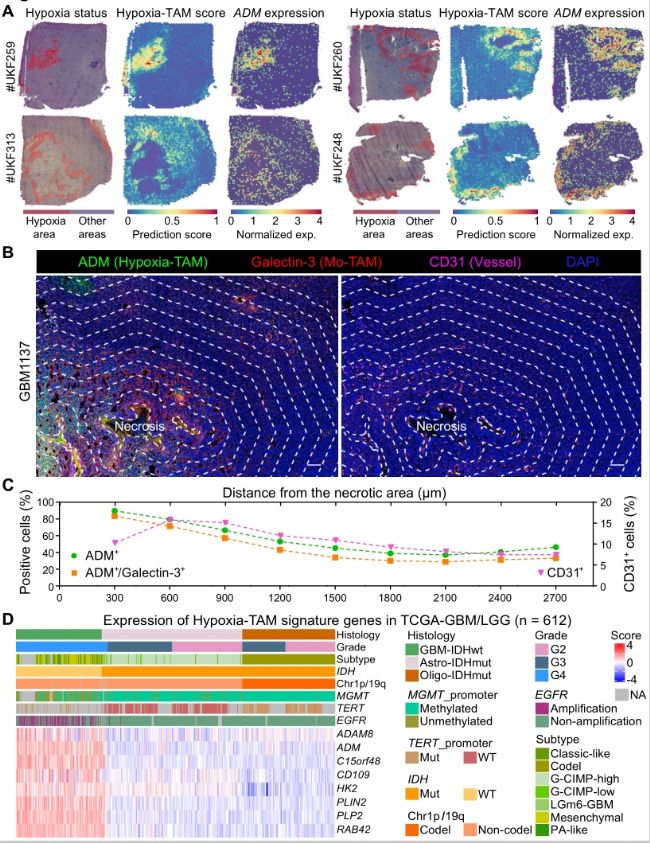
圖4. Hypoxia-TAM亞群在缺氧壞死區高度富集
4. bulk(常規普通)轉錄組、蛋白質組和代謝組(能量代謝:糖酵解)的多組學整合分析,系統篩選并鑒定出缺氧壞死微環境內膠質瘤細胞產生的富含半胱氨酸的酸性分泌蛋白(secreted protein acidic and rich in cysteine,SPARC)和缺氧誘導產生的乳酸是Hypoxia-TAM亞群極化的關鍵因素,并表明兩種因素協同誘導Mo-TAM內p50(由NFKB1編碼)入核增強Hypoxia-TAM核心表型基因轉錄。
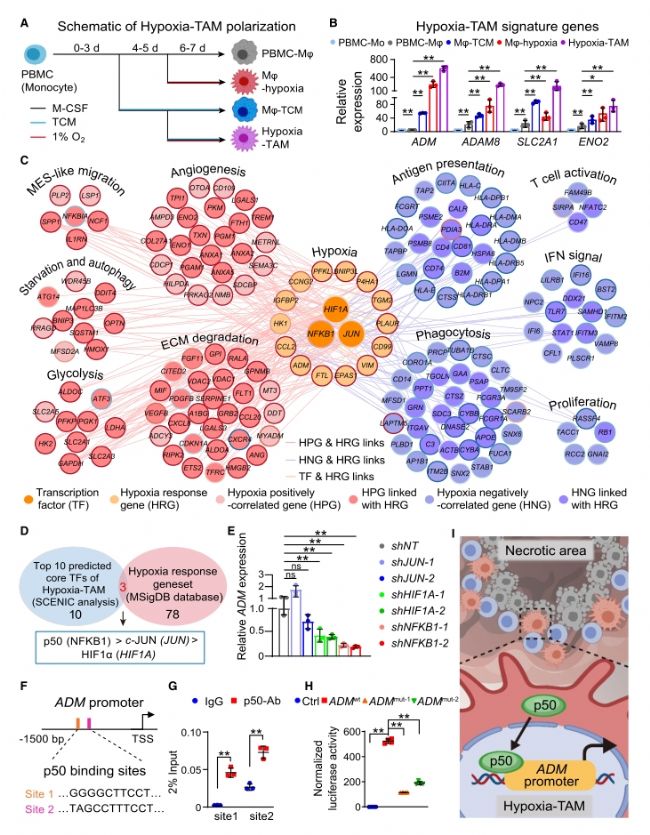
圖5. 低氧誘導Hypoxia-TAM極化
5. 進一步研究表明,Hypoxia-TAM直接促進腫瘤血管的滲漏,并通過Hypoxia-TAM過度分泌腎上腺髓質素(ADM),致使膠質瘤內微血管內皮細胞間的黏附連接破壞,進而引發血管高滲漏和血流低灌注。敲除Ccr2-Cre轉基因小鼠中單核細胞及其衍生細胞內Adm,或采用ADM拮抗劑阻斷ADM分泌通路,能夠選擇性地恢復內皮連接完整性并減少血管滲漏,從而誘導腫瘤內微血管結構正常化。
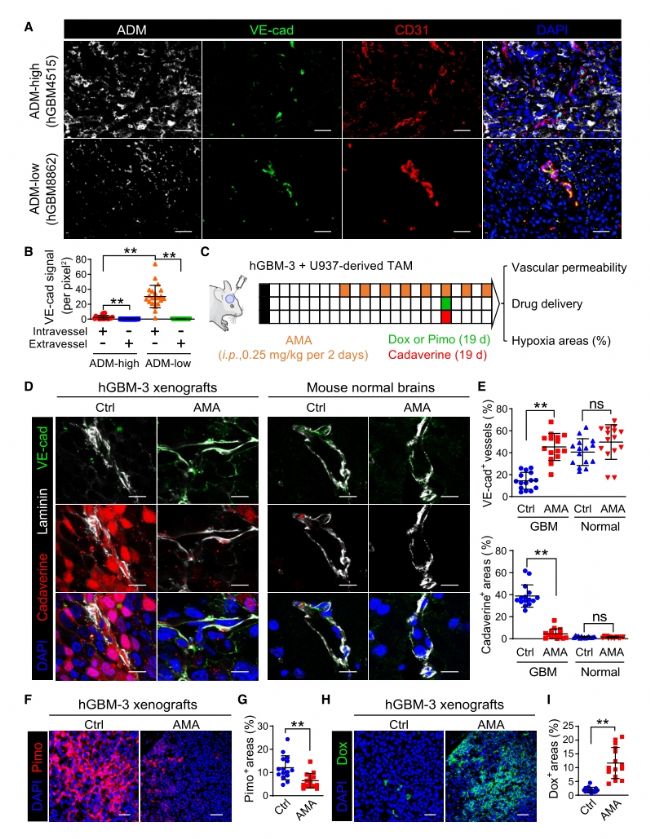
圖6. AMA治療hGBM異種移植瘤血管正常化
6. 構建Vehicle、Dab、AMA、AMA+Dab模型,在BRAFV600E突變型腦腫瘤中證實ADM拮抗劑(AMA)與BRAF小分子抑制劑達拉非尼(Dabrafenib)聯用,能有效增加達拉非尼的瘤內灌注,促進膠質瘤血管正常化,抑制腫瘤生長。
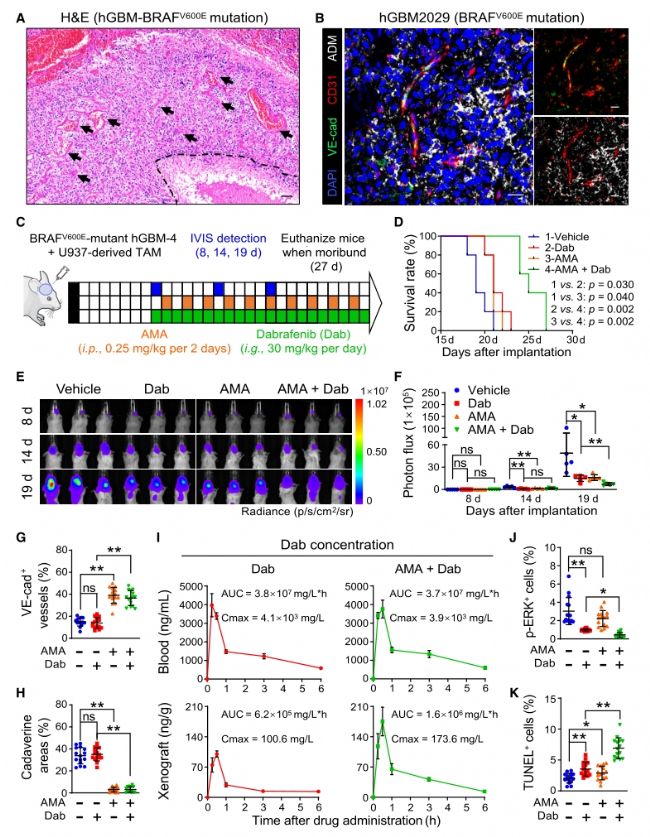
圖7. AMA治療改善達拉非尼的治療效果
研究結論
該研究繪制膠質母細胞瘤TAM空間圖譜,強調了腦膠質瘤中Mo-TAM的多樣性和空間微環境引導的Mo-TAM重編程,鑒定出缺氧微環境內Hypoxia-TAM新功能亞群,指出了針對Hypoxia-TAM的潛在治療方法,為提高腫瘤治療藥物灌注和療效提供新策略。
參考文獻
Wang W ,Li T ,Cheng Y , et al.Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization.[J].Cancer cell, 2024.
請掃描二維碼閱讀原文

繪譜幫你測
麥特繪譜為本文提供能量代謝和蛋白質組檢測服務,助力本研究發現富含半胱氨酸的酸性分泌蛋白和低氧誘導產生的乳酸,成為Hypoxia-TAM亞群極化的關鍵機制。麥特繪譜開創性地搭建了醫學領域高端代謝組學技術平臺,覆蓋了非靶向-全定量-代謝流等全方位的高端醫學代謝組解決方案,同時全面布局微生物組學、轉錄組學和蛋白質組學等多組學技術服務,已成為全球多組學研究者的優選合作伙伴。麥特繪譜擁有Q1000,Q500、Q300、Q200和膽汁酸、短鏈脂肪酸、色氨酸及吲哚衍生物、多胺和TMAO類等各類小分子代謝物、非靶向代謝組學和同位素示蹤代謝流技術等共40+系列檢測方法;已為數百家三甲醫院、科研院所和企業提供多組學解決方案,協助客戶與合作伙伴發表SCI文章400+篇,累計影響因子4000+,平均IF>10,包括Cell, Nature, Science, Cell Metabolism, Immunity, Gut, Hepatology, Microbiome等頂級期刊。
END





