類器官和CRISPR 篩選在疾病建模中的應用
【能量補給站】
CRISPR/Cas 被認為是細菌或古細菌在抵抗來自質粒或噬菌體的外來 DNA 的過程中進化出的“獲得性免疫系統”。基本原理是通過一段與靶標 DNA 相同的 gRNA 指導 Cas9 核酸酶對靶向基因進行 DNA 修飾,以此造成基因的功能突變或缺失[1]。
結直腸癌 (Colorectal cancer, CRC) 是男性和女性中第三大最常見的新診斷癌癥類型,其特點是患者之間存在顯著的遺傳和表型異質性。雖然外顯子組測序有助于復發性遺傳病變的識別,但檢測頻率較低。
為了促進腫瘤驅動因素的高通量基因測試和功能鑒定,Michels BE 等人開發了一個在人類結腸類器官中進行 CRISPR-Cas9 聯合篩選的平臺,使得利用類器官進行體外和體內移植后腫瘤抑制基因的篩選鑒定成為可能[2]。
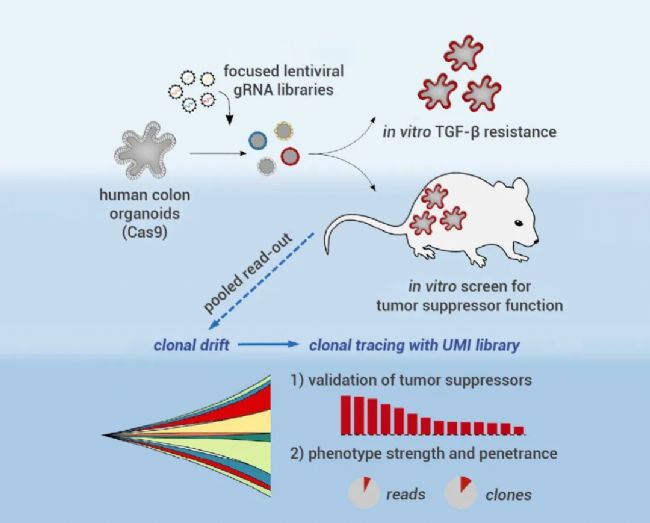
基于類器官的 CRISPR-Cas9 聯合篩選的平臺[2]。
 首先,作者通過藥篩系統將攜帶 Cas9 蛋白的慢病毒載體轉入結腸類器官,建立了穩定表達 Cas9 的人結腸類器官培養體系。正常人結腸類器官對轉化生長因子-β (TGF-β) 敏感,在培養體系中添加 TGF-β 可以有效殺死類器官,而敲除 TGF-B 的受體基因 (TGFBR) ,即用針對 TGFBR2 的慢病毒 gRNA 轉導則可以挽救 TGF-β 導致的細胞毒性。
首先,作者通過藥篩系統將攜帶 Cas9 蛋白的慢病毒載體轉入結腸類器官,建立了穩定表達 Cas9 的人結腸類器官培養體系。正常人結腸類器官對轉化生長因子-β (TGF-β) 敏感,在培養體系中添加 TGF-β 可以有效殺死類器官,而敲除 TGF-B 的受體基因 (TGFBR) ,即用針對 TGFBR2 的慢病毒 gRNA 轉導則可以挽救 TGF-β 導致的細胞毒性。
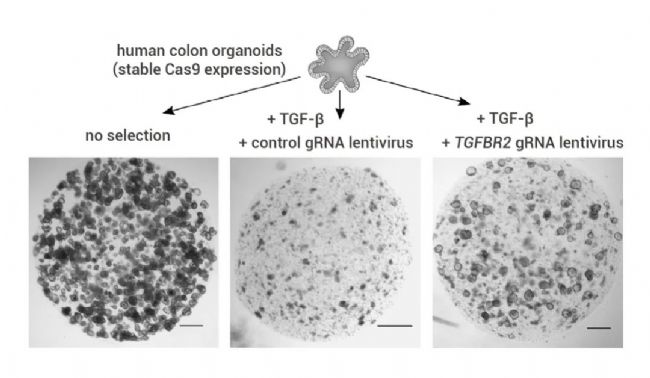
圖 1. 穩定表達 Cas9 的結腸類器官的組織形態學[2]。
在對照培養基中(左)以及在對照 gRNA(中)或 TGFBR2 gRNA 慢病毒(右)存在下進行 TGF-β 選擇 3 周后穩定表達 Cas9 的類器官的形態學。
【參考操作】[2]:
(一)類器官的培養:
1.完全培養基:含DMEM/F12,10 mM HEPES, 1x Glutamax, 1x penicillin/streptomycin, 2% B27, 1mM Nicotinamide, 12.5 mM N-Acetylcysteine, 500 nM A83-01, 10 mM SB202190, 50% Wnt3a, 20% R-spondin-1, 10% Noggin、50 ng/mL human EGF。
2. 類器官培養基每 2-3 天更換一次,每周傳代一次,并在 Rho 激酶抑制劑 Y-27632 (10 mM) 的存在下培養在基底膜基質膠中。
(二)類器官的轉染:1. 通過移液多次機械分散類器官,然后進行 Accutase 消化以獲得單細胞。
2. 洗滌后,將細胞重懸于含有 Rho 激酶抑制劑 (10 μM) 和 Polybrene(8 μg/mL) 的培養基中,并進行旋轉轉染 (500*g,1 小時,32°C)。
3. 37°C 孵育 3-5 小時后,將細胞接種到 Matrigel 中。轉染后 2 天開始選擇。
隨后,作者設計了針對 TGF-β 通路的 6 個關鍵組分 (圖 2A) 和 94 個對照基因。每個基因都被 20 個獨立的 gRNA 靶向,整個文庫包含 2,200 個 gRNA,并被轉導到穩定表達 Cas9 的正常人結腸類器官中 (圖 2 B)。以混合方式提取基因組DNA,并通過 NGS 分析慢病毒條形碼。針對 TGFBR1 和 TGFBR2 的單個 gRNA 富集程度最高,證實了篩選系統的有效。
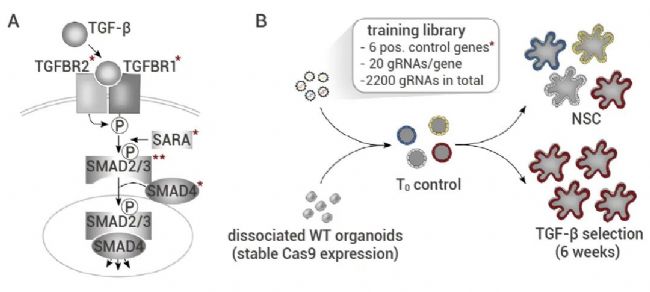
圖 2. 使用 TGF-β 耐藥性訓練庫進行類器官篩選[2]。
接著,作者對異種移植類器官中的腫瘤抑制功能進行體內篩選。作者構建了一種預致瘤類器官系,AK 類器官 (APC-KO/KRASGG12D),即缺失 APC 和致癌 KRASG12D 等位基因的結腸類器官。其僅在敲除 TGFBR2 (AKT 類器官) 后才顯示出生長。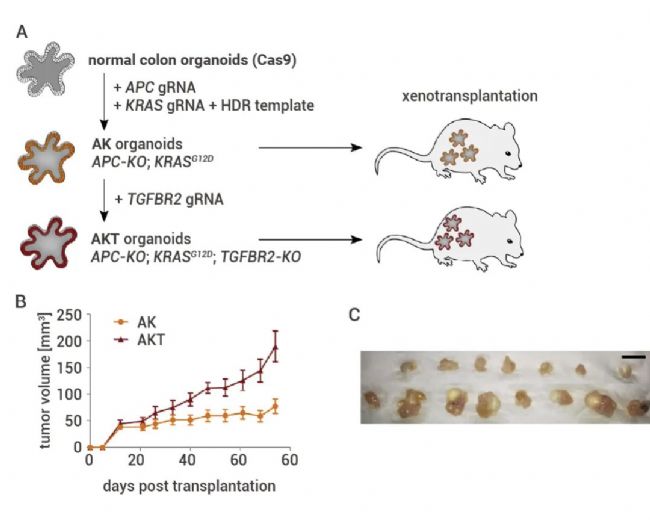
圖3. 腫瘤抑制功能可移植類器官模型的開發[2]。
(A) 實驗設置。致瘤前類器官系(AK:APC-KO 和 KRASG12D)和皮下移植后致瘤系(AKT:額外 TGFBR2 -KO)。(B) NSG 小鼠(n = 7 和 8 只小鼠)中移植 AK 和 AKT 類器官后腫瘤體積 (±SEM) 的測量。(C) AK(上排)和 AKT 類器官(下排)移植后的腫瘤形態。
【參考操作】[2]:
(一)AK(APC−/−,KRASG12D)類器官:
1. AK (APC−/−, KRASG12D) 類器官按照使用 WT 類器官的描述生成。該類器官用含有 Cas9 和 APC gRNA 的 lentiCRISPR v2 轉導,并在連續嘌呤霉素選擇 (0.5 μg/μL),不含 Wnt、Rspondin 的情況下培養。
2. 分離、擴增單個克隆,并通過 Sanger 測序證實 APC 突變。
3. KRASG12D 是通過將 KRAS gRNA 與單鏈修復模板一起瞬時共轉染到質粒 gRNA_GFP-T2 中而引入的。在不含 Wnt、Rspondin 和 EGF 且添加 0.5-1.0 mM EGFR 抑制劑的培養基中選擇類器官。
4. 擴增克隆系,并通過 Sanger 測序證實 KRASG12D 突變。(二)AKT 類器官:
通過慢病毒 gRNA 將 TGFBR2-KO 引入 AK 類器官中,然后在缺乏 TGF-β 抑制劑 (A83-01) 且補充有 5 ng/mL 重組人 TGF-β 的培養基中進行選擇,然后通過 Sanger 測序進行確認。
作者設計了一個泛癌 TSG gRNA 庫,其中包含先前研究中發現的 85 個 TSG。對于每個靶標,設計了 20 個獨立的 gRNA,包括對照在內,整個文庫包含 2,600 個 gRNA。轉導后,AK 類器官注射移植到 8-10 只 NSG 小鼠皮下(圖 4)。11 至 12 周后,匯集所有腫瘤的基因組 DNA,并在 3 個實驗重復中進行篩選,通過檢測 sgRNA 序列的富集情況來判斷發生突變的功能因子。篩選結果顯示, TGFBR2是所有三個重復中富集度最高的 gRNA,表明 TGF-β 在腫瘤微環境中具有主導的生長抑制作用。提示該篩選體系可以有效的進行腫瘤抑制因子的體內篩選。
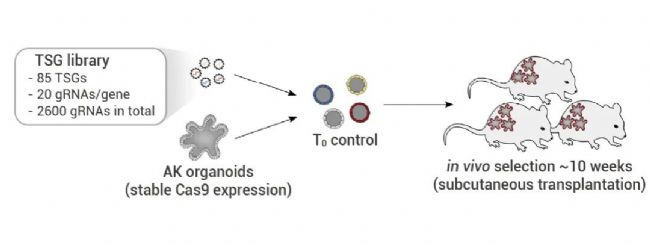
圖 4. 移植人體類器官中腫瘤抑制功能的體內文庫篩選[2]。
此外,也有一些針對非功能基因的 gRNA 被富集,表明存在假陽性。作者通過在sgRNA 載體引入 UMI (unique molecular identifiers) 的方式,顯著提高了篩選的準確性,降低了假陽性率。該方法體系還可以擴展到結腸以外其它上皮細胞的篩選,將來可能用于個性化的腫瘤治療。
看了這么多,相信大家對類器官的培養方法有了大概的了解。 MCE 現已推出類器官相關產品 55 折活動,截止到 2024.04.30,心動不如行動,來 MCE 官網查詢具體的產品信息吧!
▐ 關于 MCE
MCE 可為類器官研究提供 11 種腫瘤類器官培養基,9 種正常組織類器官培養基,3,000+ 細胞因子與生長因子,以及類器官研究需要的 9 款基質膠。
MCE 類器官產品適用多個研究領域,批次間穩定性高,類器官分化生長效果好。部分產品如下 :







 MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務。
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務。
[1] Zhu Y. Advances in CRISPR/Cas9. Biomed Res Int. 2022 Sep 23;2022:9978571.
[2] Michels BE, et al. Pooled In Vitro and In Vivo CRISPR-Cas9 Screening Identifies Tumor Suppressors in Human Colon Organoids. Cell Stem Cell. 2020 May 7;26(5):782-792.e7.





