在造血干細胞/祖細胞(HSPC)培養過程中實時監測的非侵入性方法詳解
Presens的SDR SensorDish®Reader可以在從人臍帶血中分離的造血干細胞/祖細胞(HSPC)培養過程中對體外氧濃度進行定量。在實時監測細胞培養液中氧濃度的同時,檢測模擬生理氧濃度對HSPC增殖、細胞周期狀態以及干細胞表型或分化細胞類型標志物表達的影響。這項研究證明了該系統在有效模擬體內氧氣環境的條件下檢測細胞表型和功能的有效性。
一、HSPC在生理氧濃度下的培養
從人臍帶血中分離的CD133 HSPC細胞在24孔OxoDish®中培養長達一周。每隔2-3天,取出細胞和培養液,短暫離心(1500rpm;5min),并將細胞仔細地懸浮在適當氧濃度(1%、8% 或 20%)預孵育1h的培養液中。在這項細胞培養研究中,低氧環境是使用插入傳統CO2培養箱(圖1)的缺氧室實現的。在整個孵育期內,用SDR在線監測實時氧濃度。同時,在相同條件下,根據測定方法,在24孔板或6孔板中培養HSPC細胞。更換介質時,取出等分試樣并使用計數器確定細胞數。在生理氧濃度(1%或8%)或環境氧濃度(20%)培養條件下,流式細胞儀測定DNA含量可用于檢測HSPC細胞周期狀態。同樣,使用凋亡試劑盒(BD)結合流式細胞術對細胞凋亡水平進行量化。在蛋白質水平,用多參數流式細胞術分析干/祖細胞或分化細胞的胞外標志物的表達模式(結果未顯示)。

圖1:SDR用于監測HSPC培養過程中的體外氧濃度,將SDR連接到計算機(B)允許在實驗期間對HSPC培養基中的氧濃度進行非侵入性實時測量。
二、結果
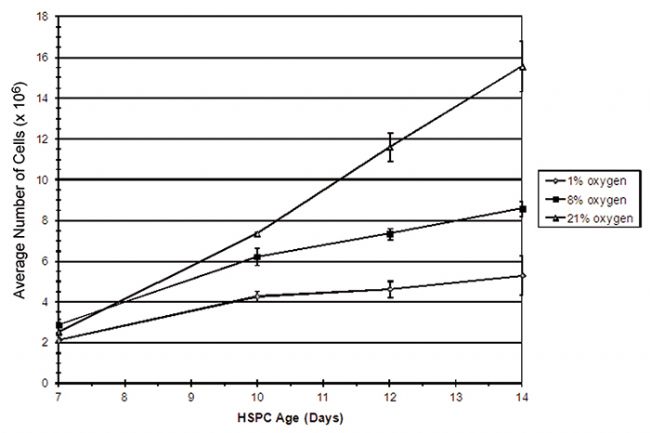
圖2顯示了在各種氧氣環境中進行為期兩天的 HSPC 培養期間,SDR和OxoDish®聯合測量的體外氧分壓。HSPC在1%O2中培養時的平均氧分壓為10.2(±5.5)mm Hg,在8%O2中培養時的平均氧分壓為65.0(±7.5)mm Hg。在常氧(20%O2)中,HSPC培養液的平均氧分壓為157.9(±9.2))mm Hg。為了獲得相對穩定的低氧環境,每隔24小時,每小時更換一次大氣,持續3小時。在高氧環境中,HSPC的增殖速度加快。HSPC生長曲線以氧濃度依賴性方式下降,在含有1%O2的環境中細胞增殖最低(圖3)。流式細胞儀分析HSPC DNA含量可用于分析細胞周期狀態。這項研究的結果清楚地表明,當環境中的氧氣濃度降低時,處于休眠狀態(如G0)或處于G1期的細胞數量顯著增加。在本實驗中,氧濃度似乎對HSPC的凋亡沒有顯著影響(數據未顯示)。綜上所述,這些結果表明,當HSPC在模擬體內環境的條件下培養時,細胞增殖下降,很可能是由于靜息細胞(G0)的數量增加,對細胞死亡沒有任何顯著影響。本研究證實了氧濃度對干/祖細胞表型和功能有一定影響的證據,并進一步證實了氧在胎盤發育中起關鍵作用的觀點。
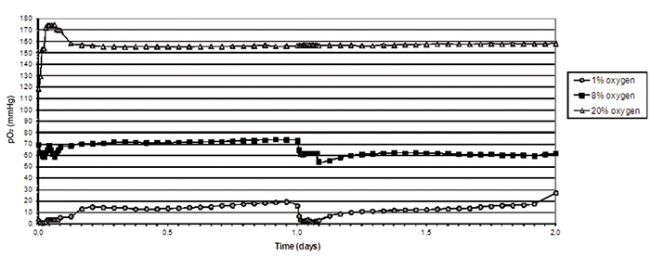
圖2:在含有低氧(1%或8% O2)和常氧(20% O2)的氧氣環境中進行為期兩天實驗期間,測量的HSPC培養基的實際氧張力
三、非侵入性氧氣監測的新視角
人類胎盤發育不同時間點的生理氧濃度可以使用含有1%或8%的O2(5%CO2)兩種不同的混合氣體精準有效地模擬。本研究中SDR與Presens的OxoDish®配合使用進行的測量提供了額外的證據,證明在大氣氧氣(20%O2)中進行的傳統細胞培養可以創造一個明顯的高氧環境,其氧分壓遠高于人體組織中的正常pO2。在胎盤研究中使用低氧混合氣體與之不同的是以前的研究不包括非侵入性、實時的氧氣監測。這項調查清楚地表明,低氧細胞培養系統中的氧濃度處于恒定的流動中,很難維持在生理水平。因此,需要對實驗參數(例如細胞數量、培養基成分、氣體置換間隔等)進行標準化和廣泛的測試,以確保達到并隨后維持實際的生理氧濃度。使用標準化的方案,減少了試驗之間的變異性。此外,SDR氧氣監測系統在整個實驗期間提供了關于體外氧氣水平的可靠數據。這項研究的重復性結果表明,氧濃度、細胞增殖和細胞周期狀態之間存在明顯的聯系。這些結果對干細胞/祖細胞培養和功能的意義將在未來詳細研究。SDR為進一步的體外研究打開了可能性,在這一研究中,明確的、與生理相關的氧濃度和穩定的細胞培養條件發揮著重要作用。此外,可以根據實驗監測和改變介質變化或氧氣濃度的變化。使用該系統,可以及時達到研究目標,從而降低研究成本。


SDR SensorDish®Reader OxoDish®OD24
實驗來源:
Timothy McKinnon1, Nelli Baal2, and Marek Zygmunt2
1Samuel Lunenfeld Research Institute, Mount Sinai Hospital, Toronto, Canada
2Universitätsklinikum Gießen und Marburg, Germany


想了解更多內容,獲取相關咨詢請聯系
電話:+86-0731-84428665
伍經理:+86-180 7516 6076
徐經理:+86-138 1744 2250





