細胞轉染新方法-免疫穿孔轉染法的原理及過程
細胞轉染現在是分子生物學的核心技術,也是基因制藥的必要前提。免疫穿孔轉染法技術是用涂有抗體并與特定細胞表面跨膜蛋白結合的珠子如何在移除珠子時在細胞中產生孔,從而允許用 DNA 或其他大分子轉染細胞。這種通過免疫穿孔對細胞進行的獨特靶向轉染非常有效,并且減少細胞凋亡。
免疫穿孔轉染法的原理
轉染細胞有多種方法,比如電穿孔 、脂質轉染 、磷酸鈣共沉淀 和 DEAE葡聚糖等方法 . 在這些方法中,只有電穿孔提供了將 DNA 和其他分子(如蛋白質)引入活細胞的可能性。目前的方法都不能針對特定類型的細胞進行轉染。在這種新的細胞轉染方法中,抗體包被的珠子與特定的表面抗原結合,然后通過混合將珠子從細胞中剪下:這會在細胞膜上形成瞬時孔,大分子可以通過這些孔進入。粒細胞、分化的人淋巴母細胞 HL-60 細胞通常在其表面表達 CD71。當在二甲基亞砜 (DMSO) 存在下誘導分化時,細胞停止表達 CD71,而是表達 CD11b。
免疫穿孔細胞轉染法的基本過程
將涂有抗 CD11b 抗體 (DYNAFECT-CD11b) 或抗 CD71 抗體 (DYNAFECT-CD71) 的 DYNAFECT 珠子在旋轉的上下混合器上以 33 rpm 在 22 °C 下混合 6 小時,與未誘導的 HL- 60 個細胞或用 DMSO 誘導 3 天的細胞。為了在 2-ml 微量離心管中混合,可將 10 7 個磁珠和 5×10 5 個細胞懸浮在含有 0.2 μg 編碼綠色熒光蛋白的質粒 DNA 載體 pEGFP-C1(4.7 kb)的 0.5 ml 轉染培養基(Dynal AS)中。轉染后,使用磁力分離器去除磁珠,將細胞轉移回組織培養基中并在分析前再培養 48 小時。
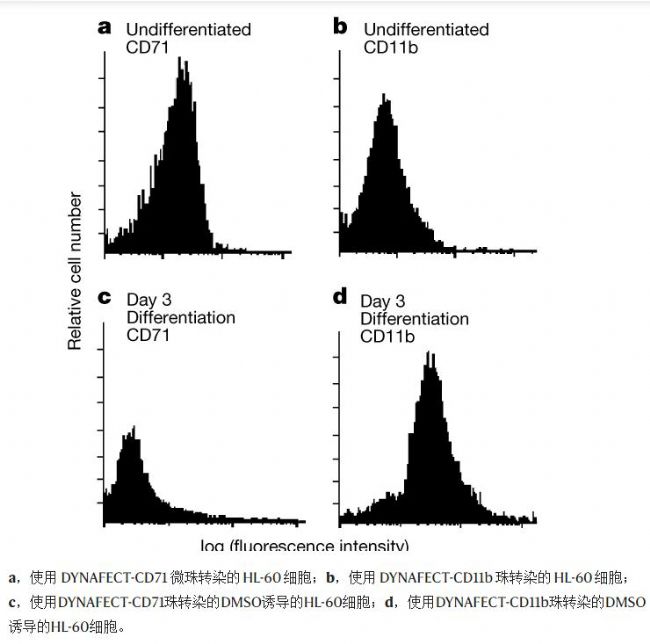
通過流式細胞技術來確定細胞轉染的程度。 DYNAFECT-CD71 微珠促進 DNA 轉染到正常的 HL-60 細胞中,但當細胞分化且不再表達 CD71 時,這些微珠不再發生轉染。相反,將未分化的 HL-60 細胞與 DYNAFECT-CD11b 珠子混合不會導致細胞被 DNA 轉染,但當細胞分化并開始表達 CD11b 時,這些磁珠確實會被轉染。
因此,免疫穿孔有可能靶向混合群體中特定類型的細胞進行轉染,這取決于它們的免疫特性,并允許靶向細胞吸收各種不同的分子。這也發生在幾種哺乳動物細胞系中,這些細胞系具有一系列針對選定細胞表面抗原的不同抗體。正常情況下,細胞轉染水平為 40-80%,具體取決于混合條件,而無活力細胞的數量通常會少于20%。
免疫穿孔轉染法的原理
轉染細胞有多種方法,比如電穿孔 、脂質轉染 、磷酸鈣共沉淀 和 DEAE葡聚糖等方法 . 在這些方法中,只有電穿孔提供了將 DNA 和其他分子(如蛋白質)引入活細胞的可能性。目前的方法都不能針對特定類型的細胞進行轉染。在這種新的細胞轉染方法中,抗體包被的珠子與特定的表面抗原結合,然后通過混合將珠子從細胞中剪下:這會在細胞膜上形成瞬時孔,大分子可以通過這些孔進入。粒細胞、分化的人淋巴母細胞 HL-60 細胞通常在其表面表達 CD71。當在二甲基亞砜 (DMSO) 存在下誘導分化時,細胞停止表達 CD71,而是表達 CD11b。
免疫穿孔細胞轉染法的基本過程
將涂有抗 CD11b 抗體 (DYNAFECT-CD11b) 或抗 CD71 抗體 (DYNAFECT-CD71) 的 DYNAFECT 珠子在旋轉的上下混合器上以 33 rpm 在 22 °C 下混合 6 小時,與未誘導的 HL- 60 個細胞或用 DMSO 誘導 3 天的細胞。為了在 2-ml 微量離心管中混合,可將 10 7 個磁珠和 5×10 5 個細胞懸浮在含有 0.2 μg 編碼綠色熒光蛋白的質粒 DNA 載體 pEGFP-C1(4.7 kb)的 0.5 ml 轉染培養基(Dynal AS)中。轉染后,使用磁力分離器去除磁珠,將細胞轉移回組織培養基中并在分析前再培養 48 小時。

通過流式細胞技術來確定細胞轉染的程度。 DYNAFECT-CD71 微珠促進 DNA 轉染到正常的 HL-60 細胞中,但當細胞分化且不再表達 CD71 時,這些微珠不再發生轉染。相反,將未分化的 HL-60 細胞與 DYNAFECT-CD11b 珠子混合不會導致細胞被 DNA 轉染,但當細胞分化并開始表達 CD11b 時,這些磁珠確實會被轉染。
因此,免疫穿孔有可能靶向混合群體中特定類型的細胞進行轉染,這取決于它們的免疫特性,并允許靶向細胞吸收各種不同的分子。這也發生在幾種哺乳動物細胞系中,這些細胞系具有一系列針對選定細胞表面抗原的不同抗體。正常情況下,細胞轉染水平為 40-80%,具體取決于混合條件,而無活力細胞的數量通常會少于20%。
標簽:
蛋白免疫印跡
western blot
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





