m6A-MeRIP-seq技術在揭示m6A修飾新功能的應用
2021年4月29日日內瓦大學Ramesh S. Pillai、David Homolka研究組合在著名學術期刊《Cell》在線發表了一項新成果,該團隊發現剪接位點m6A甲基化通過阻止剪接因子U2AF35與前體mRNA結合進而抑制RNA剪接,結合后續的功能機制研究,揭示了m6A甲基化修飾新的調控機制。接下來,就讓我們一起來看下研究人員是如何利用高通量測序技術RNA-seq和m6A-MeRIP-seq揭示m6A甲基化修飾調控RNA剪接這一新功能的。

發表期刊:Cell
發表日期:2021年4月29日
影響因子:41.582
研究方法::m6A meRIP-seq、RNA-seq、LC-MS/MS等
文章鏈接:https://pubmed.ncbi.nlm.nih.gov/33930289/
研究思路
研究內容
一、秀麗隱桿線蟲的m6A轉錄組
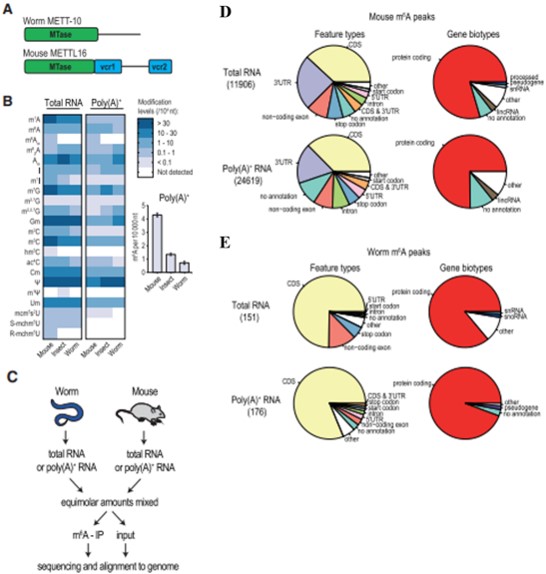
已知哺乳動物中主要有兩類m6A“編寫器”:METTL3/METTL14復合物以及METTL16,為了研究 METTL16 催化活性的保守作用,作者選擇了秀麗隱桿線蟲(以下稱為蠕蟲)。蠕蟲直系同源物 METT-10包含高度保守的 RNA 甲基轉移酶域,但缺乏哺乳動物 METTL16 中發現的 VCR域(圖 1A)。通過LC-MS/MS技術檢測來自成蟲的總 RNA 和 poly(A)+ RNA 中的各種核糖和堿基修飾發現,在來自所有三種生物來源的 poly(A)+ RNA 中檢測到 m6 A 修飾,包括秀麗隱桿線蟲(圖 1B)。為了鑒定攜帶 m6A 甲基化的蠕蟲轉錄本,作者使用來自成年秀麗隱桿線蟲的 poly(A)+ RNA 和小鼠睪丸 RNA (陽性對照)的混合物進行了 m6A-meRIP-seq(圖 1C)與超過 20,000 個小鼠峰相比,在蠕蟲 poly(A)+ 轉錄組中僅鑒定出 176 個 m6A 峰(圖 1D-E),這可能是由于蠕蟲中不存在 METTL3/METTL14 “編寫器”復合體。
二、蠕蟲 METT-10 是 U6 snRNA 和 SAM 合成酶 mRNA 的 m6A “編寫器”
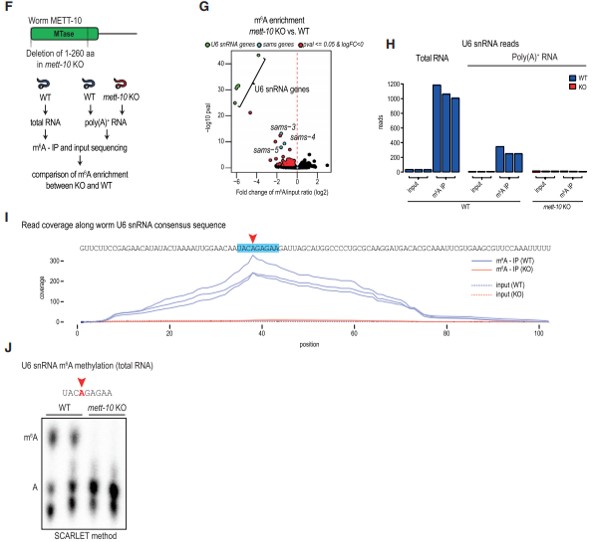
在確認蠕蟲 poly(A)+ RNA上存在 m6A 后,作者接下來尋找METT-10甲基化靶標,首先使用了m6A-meRIP-seq數據集的比較分析來鑒定 poly(A)+ 轉錄本,這些轉錄本在METT-10 敲除 (KO) 突變體中顯示m6A 甲基化減少(圖 2F)。其中,前 20 個編碼 U6snRNA 序列(圖2G)。與此一致,對總 RNA 樣本進行的單獨 m6A-meRIP-seq實驗顯示 U6 snRNA 讀數的富集程度更高(圖 2H)。已有研究表明人類 U6 snRNA 在九聚體基序 (UACm6AGAGAA) 內被人 METTL16 甲基化,在此m6A-meRIP-seq讀數的映射顯示蠕蟲 U6 snRNA 也在相同的位點(圖2I)。重要的是,這個 m6A 信號在 METT-10 KO 突變體中消失(圖 2H 和2I)。作為獨立驗證,通過 SCARLET 方法(以核苷酸特異性方式檢測甲基化狀態),對成蟲總 RNA 的分析證實了甲基化共有基序中這種特定腺苷(A)的甲基化(圖2J)。此外,在 METT-10 KO 中顯示 m6A水平顯著下降的其他轉錄本是 sams-3、sams-4 和 sams-5(圖2G),這些重復的基因編碼 SAM 合成酶,該酶負責產生甲基供體 SAM,這是細胞中甲基化反應所必需的。綜上,作者將蠕蟲 METT-10 鑒定為 m6A RNA 甲基轉移酶,并且與其哺乳動物直系同源物 METTL16 一樣,它具有 U6 snRNA 和 SAM 合成酶 RNA兩個保守靶點。
三、3’剪接位點 m6A 修飾抑制 SAM 合成酶前體 mRNA 的剪接
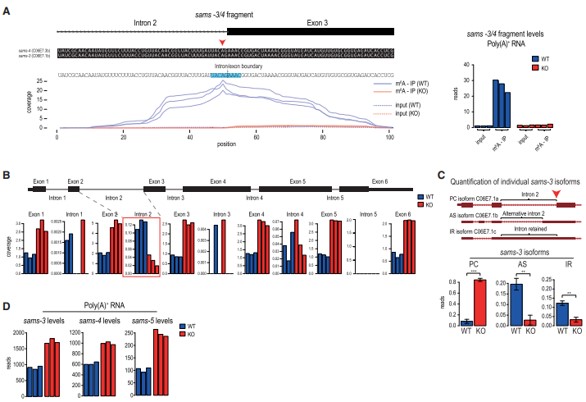
作者通過將m6A-meRIP-seq數據集映射到蠕蟲基因組,在sams m6A峰上發現了一個甲基化基序(UACm6AGAAAC),其中該基序中的甲基化腺苷位于內含子2的3’剪接位點(AG)(圖3A)。除了sams-3/4轉錄本的成熟剪接蛋白編碼型(PC亞型),作者還檢測到了兩個未使用內含子2內3’剪接位點的非編碼型:使用上游隱藏的3’剪接位點的替代剪接變異體(AS亞型) 和內含子保留型(IR亞型) (圖3C)。其中,與野生型(WT)蠕蟲相比,METT-10 KO中內含子2的總體含量較低,表明在沒有3‘剪接位點甲基化時,其有效剪接(圖3B)。與此一致的是,RNA-seq數據顯示,METT-10 KO中優先使用3’剪接位點(產生PC亞型) (圖3C)。這種m6A介導的剪接抑制的結果是METT-10 KO中sams mRNA水平普遍增加(圖3D)。綜上所述,蠕蟲通過METT10介導的3’剪接位點m6A甲基化來抑制SAM合成酶mRNA的剪接和產生。
四、一個保守的包含3’剪接位點甲基化共識基序的莖-環結構是被METT-10甲基化修飾所必需的
二級結構預測顯示,跨越3’剪接位點的sams-3 pre-mRNA的30-nt RNA片段折疊成莖環結構,甲基化共識基序(UACm6AGAAAC)占據了部分環區(圖4A)。為了證實該序列可以被蠕蟲METT-10甲基化,作者將這30-nt RNA與重組全長蠕蟲METT-10和放射性14C-SAM作為甲基供體孵育,發現RNA在3’剪接位點(AG)特異性甲基化,其中腺苷、共識基序內的單一或三重突變消除了METT-10的體外甲基化活性(圖4B)。莖稈區域對甲基化也很關鍵,將莖環區域堿基突變后失去甲基化活性 (圖4C)。這些結果表明,sams pre-mRNA的甲基化共識基序和3’剪接位點的莖環形成是其被METT-10識別的先決條件。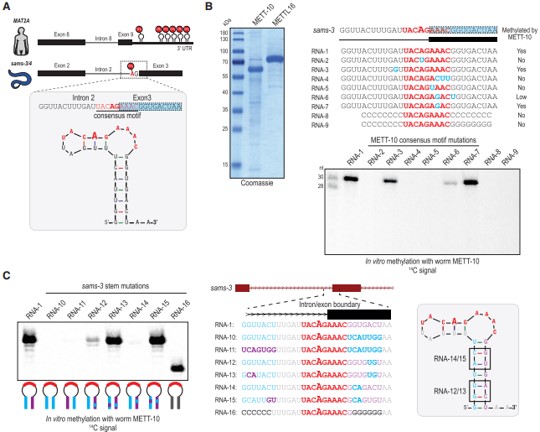
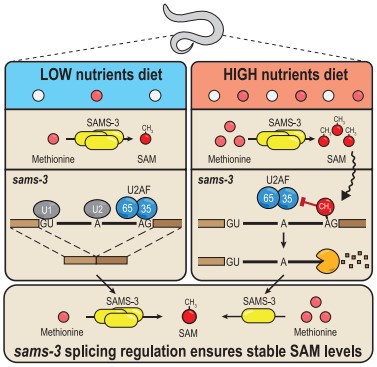
五、蠕蟲通過甲基化SAM合成酶轉錄子的3’剪接位點下調SAM合成酶的表達以響應高營養飲食
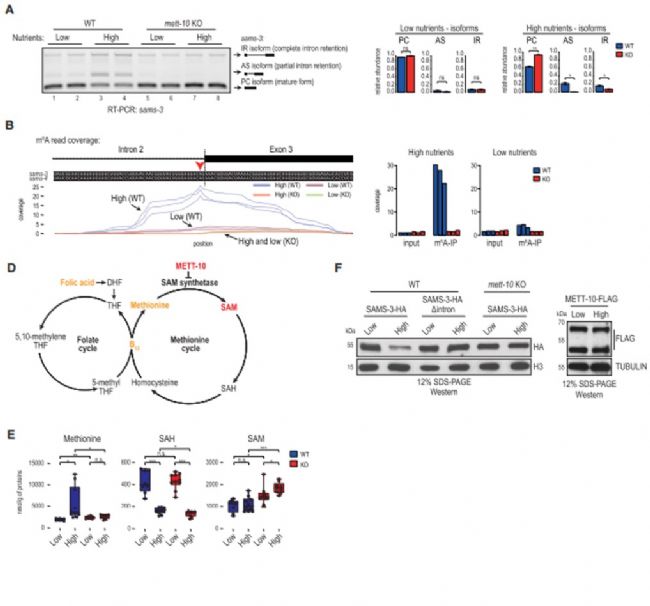
上述實驗3’剪接位點甲基化介導的剪接抑制,蠕蟲是在高營養瓊脂培養基上生長的,而將飲食改為低營養瓊脂平板后導致WT和METT-10 KO蠕蟲失去了這種剪接調控和類似的亞型表達模式(圖5A)。為了直接確定剪接位點m6A甲基化對飲食變化的響應,作者用來自WT和METT-10 KO蠕蟲的poly(A)+ RNA進行了m6A-meRIP-seq實驗,這些poly(A)+ RNA來自兩種不同的飲食,發現生長在高營養培養皿中的WT蠕蟲sams-3 pre-mRNA內含子2的3’剪接位點發生強m6A甲基化修飾,而低營養培養皿中甲基化顯著降低(圖5B)。因此,3'剪接位點m6A甲基化是對高營養飲食的反應,以抑制SAM合成酶pre-mRNA適當的剪接和表達。由于RNA甲基化依賴于SAM作為甲基供體,作者還研究了該途徑是否通過反饋抑制來調節細胞SAM水平。代謝組學分析顯示,盡管WT蠕蟲能夠控制SAM水平,但METT10 KO蠕蟲卻不能,METT-10的丟失破壞了這種穩態,導致兩種飲食條件下SAM濃度升高 (圖5E)。通過WB實驗檢測了該酶的蛋白水平,與RNA分析一致,高營養飲食條件下的SAMS-3蛋白水平下降 (圖5F)。因此,m6A修飾調控了蠕蟲SAM內穩態。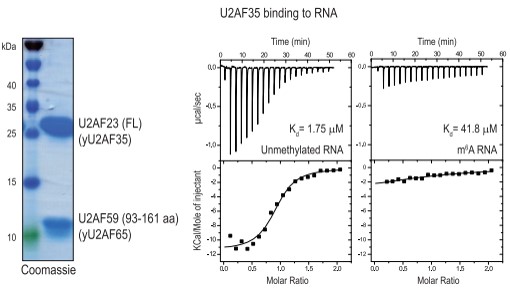
七、3ʹ剪切位點m6A甲基化也抑制哺乳動物細胞的剪接且METTL16的RNA m6A甲基化活性對發育至關重要
那么,m6A介導的抑制通路在哺乳動物系統中是否也存在呢?作者將基于蠕蟲sams-3的轉基因報告子構建體轉染到人HeLa細胞中,通過RT-PCR實驗發現與在蠕蟲中表達相同構建體時有著相似的剪接模式,且甲基化共識基序突變體AS亞型水平降低,發生有效剪接(圖7A)。為了證明剪接調控是由于m6A修飾的存在,在3’剪接位點人工引入了一個m6A,并進行體外剪接試驗。發現未甲基化底物正常剪接,而3’剪接位點m6A修飾的底物顯示缺少套索中間體和成熟剪接產物 (圖7B)。已知METTL16缺失會導致小鼠植入前胚胎死亡,為了檢測其催化活性的體內相關性,創建了一個攜帶催化基序突變體的基因敲入小鼠,發現純合子催化活性和RNA結合活性丟失的METTL16突變體表現出發育致死率(圖7C)。此外,METTL16條件性缺失(cKO)的小鼠會導致睪丸萎縮和生殖細胞發育受阻(圖7D-E)。以上實驗揭示了哺乳動物中3’剪接位點m6A甲基化的剪接抑制是保守的,以及METTL16催化活性在小鼠發育過程中的重要作用。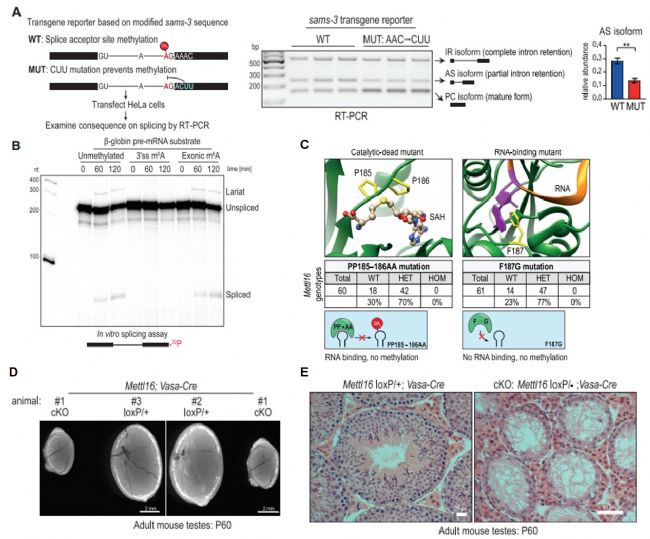
文章小結
文章通過m6A meRIP-seq、RNA-seq以及LC-MS/MS等技術揭示了3ʹ剪接位點的m6A 甲基化通過阻止必需剪接因子U2AF35對RNA的識別,從而抑制線蟲和哺乳動物中的前體mRNA 剪接。在蠕蟲中,這種機制用于調節剪接以響應飲食的變化。m6A修飾參與調控多種生物學功能,其調控機制異常還可能導致相關疾病或癌癥的發生,本文3ʹ剪接位點m6A 甲基化剪接調控機制的發現將有助于以后對這些相關生物學功能或疾病的探索。
01 m6ARNA修飾測序
m6A RNA修飾測序(m6A-meRIP-seq)
對m6A RNA甲基化,目前流行的檢測手段為m6A-Seq技術,適用于m6A RNA甲基化譜研究,快速篩選m6A RNA甲基化靶基因。云序可提供mRNA和多種非編碼RNA的m6A測序:
● m6A 全轉錄組測序(涵蓋mRNA,LncRNA,circRNA)
● m6A LncRNA測序(涵蓋LncRNA和mRNA)
● m6A Pri-miRNA測序(涵蓋Pri-miRNA和mRNA)
● m6A mRNA測序
● m6A miRNA測序
02 檢測整體m6ARNA修飾水平
LC-MS/MS檢測整體RNA修飾水平
精準高效,可以實現一次檢測,9類修飾水平檢測,一步到位。
比色法檢測整體RNA修飾水平
快速檢測m6A整體甲基化水平
03 m6A RNA修飾上游酶的篩選
m6A RNA修飾相關酶PCR芯片
尋找上游直接調控m6A RNA甲基化的甲基轉移酶。
04 m6A RNA修飾靶基因驗證
meRIP-qPCR
云序提供各類不同修飾的meRIP-qPCR服務,可針對mRNA,lncRNA,環狀RNA等不同類型的RNA分子進行檢測,低通量驗證RNA修飾靶基因表達水平。
05機制互作研究
5.1 RIP-seq/qPCR
篩選或驗證RNA修飾直接靶點,研究RNA修飾靶基因的調控機制。
5.2 RNA pull down -MS/WB
篩選或驗證目標RNA互作基因或蛋白,研究相應的分子調控機制。
5.3 雙熒光素酶實驗
驗證兩基因互作,研究相應的分子調控機制。
5.4 ChIP-seq
篩選或驗證目標蛋白與DNA互作,研究相應的分子調控機制。
優勢一:發表10分以上文章最多的m6A RNA甲基化測序服務平臺。云序已累計支持客戶發表52+篇高水平文章,合計影響因子450分+,是國內支持發文最多、累計影響因子最高的公司。
優勢二:至今完成4000+例m6A測序樣本,全面覆蓋醫口、農口等各類樣本。
優勢三:全面檢測mRNA和各類非編碼RNA(circRNA,lncRNA,Pri-miRNA等)。
優勢四:提供m6A一站式服務:m6A整體水平檢測、m6A測序、MeRIP-qPCR驗證、RIP和RNA pull-down等。
優勢五:率先研發超微量MeRIP測序技術,RNA量低至500ng起。
優勢六:國內最全的RNA修飾測序平臺,提供m6A、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化測序。

發表日期:2021年4月29日
影響因子:41.582
研究方法::m6A meRIP-seq、RNA-seq、LC-MS/MS等
文章鏈接:https://pubmed.ncbi.nlm.nih.gov/33930289/
文章概要
6-methyladenosine (m6A) RNA修飾被廣泛用于改變mRNA的命運。本文中作者證明了秀麗隱桿線蟲的甲基化修飾蛋白METT-10(小鼠METTL16的同源蛋白)沉積在S-腺苷甲硫氨酸(SAM)合成酶前體mRNA的3’剪接位點(AG)上的一個m6A修飾,可抑制其正確剪接和蛋白產生。這種機制是由豐富的飲食觸發的,以m6A介導的開關來停止SAM的產生并調節其內穩態。雖然哺乳動物SAM合成酶pre-mRNA不受此機制調控,但3’剪接位點m6A修飾抑制剪切在哺乳動物中是保守的。該修飾通過物理方式阻止必要的剪接因子U2AF35識別3’剪接位點。作者認為使用剪切位點m6A修飾是一種古老的剪接調節機制。
研究思路

研究內容
一、秀麗隱桿線蟲的m6A轉錄組
已知哺乳動物中主要有兩類m6A“編寫器”:METTL3/METTL14復合物以及METTL16,為了研究 METTL16 催化活性的保守作用,作者選擇了秀麗隱桿線蟲(以下稱為蠕蟲)。蠕蟲直系同源物 METT-10包含高度保守的 RNA 甲基轉移酶域,但缺乏哺乳動物 METTL16 中發現的 VCR域(圖 1A)。通過LC-MS/MS技術檢測來自成蟲的總 RNA 和 poly(A)+ RNA 中的各種核糖和堿基修飾發現,在來自所有三種生物來源的 poly(A)+ RNA 中檢測到 m6 A 修飾,包括秀麗隱桿線蟲(圖 1B)。為了鑒定攜帶 m6A 甲基化的蠕蟲轉錄本,作者使用來自成年秀麗隱桿線蟲的 poly(A)+ RNA 和小鼠睪丸 RNA (陽性對照)的混合物進行了 m6A-meRIP-seq(圖 1C)與超過 20,000 個小鼠峰相比,在蠕蟲 poly(A)+ 轉錄組中僅鑒定出 176 個 m6A 峰(圖 1D-E),這可能是由于蠕蟲中不存在 METTL3/METTL14 “編寫器”復合體。

二、蠕蟲 METT-10 是 U6 snRNA 和 SAM 合成酶 mRNA 的 m6A “編寫器”
在確認蠕蟲 poly(A)+ RNA上存在 m6A 后,作者接下來尋找METT-10甲基化靶標,首先使用了m6A-meRIP-seq數據集的比較分析來鑒定 poly(A)+ 轉錄本,這些轉錄本在METT-10 敲除 (KO) 突變體中顯示m6A 甲基化減少(圖 2F)。其中,前 20 個編碼 U6snRNA 序列(圖2G)。與此一致,對總 RNA 樣本進行的單獨 m6A-meRIP-seq實驗顯示 U6 snRNA 讀數的富集程度更高(圖 2H)。已有研究表明人類 U6 snRNA 在九聚體基序 (UACm6AGAGAA) 內被人 METTL16 甲基化,在此m6A-meRIP-seq讀數的映射顯示蠕蟲 U6 snRNA 也在相同的位點(圖2I)。重要的是,這個 m6A 信號在 METT-10 KO 突變體中消失(圖 2H 和2I)。作為獨立驗證,通過 SCARLET 方法(以核苷酸特異性方式檢測甲基化狀態),對成蟲總 RNA 的分析證實了甲基化共有基序中這種特定腺苷(A)的甲基化(圖2J)。此外,在 METT-10 KO 中顯示 m6A水平顯著下降的其他轉錄本是 sams-3、sams-4 和 sams-5(圖2G),這些重復的基因編碼 SAM 合成酶,該酶負責產生甲基供體 SAM,這是細胞中甲基化反應所必需的。綜上,作者將蠕蟲 METT-10 鑒定為 m6A RNA 甲基轉移酶,并且與其哺乳動物直系同源物 METTL16 一樣,它具有 U6 snRNA 和 SAM 合成酶 RNA兩個保守靶點。

三、3’剪接位點 m6A 修飾抑制 SAM 合成酶前體 mRNA 的剪接
作者通過將m6A-meRIP-seq數據集映射到蠕蟲基因組,在sams m6A峰上發現了一個甲基化基序(UACm6AGAAAC),其中該基序中的甲基化腺苷位于內含子2的3’剪接位點(AG)(圖3A)。除了sams-3/4轉錄本的成熟剪接蛋白編碼型(PC亞型),作者還檢測到了兩個未使用內含子2內3’剪接位點的非編碼型:使用上游隱藏的3’剪接位點的替代剪接變異體(AS亞型) 和內含子保留型(IR亞型) (圖3C)。其中,與野生型(WT)蠕蟲相比,METT-10 KO中內含子2的總體含量較低,表明在沒有3‘剪接位點甲基化時,其有效剪接(圖3B)。與此一致的是,RNA-seq數據顯示,METT-10 KO中優先使用3’剪接位點(產生PC亞型) (圖3C)。這種m6A介導的剪接抑制的結果是METT-10 KO中sams mRNA水平普遍增加(圖3D)。綜上所述,蠕蟲通過METT10介導的3’剪接位點m6A甲基化來抑制SAM合成酶mRNA的剪接和產生。

四、一個保守的包含3’剪接位點甲基化共識基序的莖-環結構是被METT-10甲基化修飾所必需的
二級結構預測顯示,跨越3’剪接位點的sams-3 pre-mRNA的30-nt RNA片段折疊成莖環結構,甲基化共識基序(UACm6AGAAAC)占據了部分環區(圖4A)。為了證實該序列可以被蠕蟲METT-10甲基化,作者將這30-nt RNA與重組全長蠕蟲METT-10和放射性14C-SAM作為甲基供體孵育,發現RNA在3’剪接位點(AG)特異性甲基化,其中腺苷、共識基序內的單一或三重突變消除了METT-10的體外甲基化活性(圖4B)。莖稈區域對甲基化也很關鍵,將莖環區域堿基突變后失去甲基化活性 (圖4C)。這些結果表明,sams pre-mRNA的甲基化共識基序和3’剪接位點的莖環形成是其被METT-10識別的先決條件。

五、蠕蟲通過甲基化SAM合成酶轉錄子的3’剪接位點下調SAM合成酶的表達以響應高營養飲食
上述實驗3’剪接位點甲基化介導的剪接抑制,蠕蟲是在高營養瓊脂培養基上生長的,而將飲食改為低營養瓊脂平板后導致WT和METT-10 KO蠕蟲失去了這種剪接調控和類似的亞型表達模式(圖5A)。為了直接確定剪接位點m6A甲基化對飲食變化的響應,作者用來自WT和METT-10 KO蠕蟲的poly(A)+ RNA進行了m6A-meRIP-seq實驗,這些poly(A)+ RNA來自兩種不同的飲食,發現生長在高營養培養皿中的WT蠕蟲sams-3 pre-mRNA內含子2的3’剪接位點發生強m6A甲基化修飾,而低營養培養皿中甲基化顯著降低(圖5B)。因此,3'剪接位點m6A甲基化是對高營養飲食的反應,以抑制SAM合成酶pre-mRNA適當的剪接和表達。由于RNA甲基化依賴于SAM作為甲基供體,作者還研究了該途徑是否通過反饋抑制來調節細胞SAM水平。代謝組學分析顯示,盡管WT蠕蟲能夠控制SAM水平,但METT10 KO蠕蟲卻不能,METT-10的丟失破壞了這種穩態,導致兩種飲食條件下SAM濃度升高 (圖5E)。通過WB實驗檢測了該酶的蛋白水平,與RNA分析一致,高營養飲食條件下的SAMS-3蛋白水平下降 (圖5F)。因此,m6A修飾調控了蠕蟲SAM內穩態。
六、 m6A甲基化阻止了必需剪接因子U2AF35對剪接位點的識別
在后生動物中,剪接因子對pre-mRNA內的關鍵順式元件的識別是剪接起始的關鍵。U2AF是由U2AF35和U2AF65亞基組成的異二聚體,其中U2AF35已被證明直接結合AG二核苷酸的3‘剪接位點,因此作者想研究3’剪接位點甲基化是否會阻礙U2AF35的結合。等溫量熱法(ITC)實驗顯示,U2AF35與未甲基化的RNA相互作用強烈,但3’剪接位點m6A的存在使其親和力降低了一個量級。因此,3’剪接位點m6A修飾通過物理上阻止必需剪接因子U2AF35對其的識別進而抑制pre-mRNA的正確剪接。
七、3ʹ剪切位點m6A甲基化也抑制哺乳動物細胞的剪接且METTL16的RNA m6A甲基化活性對發育至關重要
那么,m6A介導的抑制通路在哺乳動物系統中是否也存在呢?作者將基于蠕蟲sams-3的轉基因報告子構建體轉染到人HeLa細胞中,通過RT-PCR實驗發現與在蠕蟲中表達相同構建體時有著相似的剪接模式,且甲基化共識基序突變體AS亞型水平降低,發生有效剪接(圖7A)。為了證明剪接調控是由于m6A修飾的存在,在3’剪接位點人工引入了一個m6A,并進行體外剪接試驗。發現未甲基化底物正常剪接,而3’剪接位點m6A修飾的底物顯示缺少套索中間體和成熟剪接產物 (圖7B)。已知METTL16缺失會導致小鼠植入前胚胎死亡,為了檢測其催化活性的體內相關性,創建了一個攜帶催化基序突變體的基因敲入小鼠,發現純合子催化活性和RNA結合活性丟失的METTL16突變體表現出發育致死率(圖7C)。此外,METTL16條件性缺失(cKO)的小鼠會導致睪丸萎縮和生殖細胞發育受阻(圖7D-E)。以上實驗揭示了哺乳動物中3’剪接位點m6A甲基化的剪接抑制是保守的,以及METTL16催化活性在小鼠發育過程中的重要作用。

文章小結
文章通過m6A meRIP-seq、RNA-seq以及LC-MS/MS等技術揭示了3ʹ剪接位點的m6A 甲基化通過阻止必需剪接因子U2AF35對RNA的識別,從而抑制線蟲和哺乳動物中的前體mRNA 剪接。在蠕蟲中,這種機制用于調節剪接以響應飲食的變化。m6A修飾參與調控多種生物學功能,其調控機制異常還可能導致相關疾病或癌癥的發生,本文3ʹ剪接位點m6A 甲基化剪接調控機制的發現將有助于以后對這些相關生物學功能或疾病的探索。
云序生物m6A修飾研究五大模塊
01 m6ARNA修飾測序
m6A RNA修飾測序(m6A-meRIP-seq)
對m6A RNA甲基化,目前流行的檢測手段為m6A-Seq技術,適用于m6A RNA甲基化譜研究,快速篩選m6A RNA甲基化靶基因。云序可提供mRNA和多種非編碼RNA的m6A測序:
● m6A 全轉錄組測序(涵蓋mRNA,LncRNA,circRNA)
● m6A LncRNA測序(涵蓋LncRNA和mRNA)
● m6A Pri-miRNA測序(涵蓋Pri-miRNA和mRNA)
● m6A mRNA測序
● m6A miRNA測序
02 檢測整體m6ARNA修飾水平
LC-MS/MS檢測整體RNA修飾水平
精準高效,可以實現一次檢測,9類修飾水平檢測,一步到位。
比色法檢測整體RNA修飾水平
快速檢測m6A整體甲基化水平
03 m6A RNA修飾上游酶的篩選
m6A RNA修飾相關酶PCR芯片
尋找上游直接調控m6A RNA甲基化的甲基轉移酶。
04 m6A RNA修飾靶基因驗證
meRIP-qPCR
云序提供各類不同修飾的meRIP-qPCR服務,可針對mRNA,lncRNA,環狀RNA等不同類型的RNA分子進行檢測,低通量驗證RNA修飾靶基因表達水平。
05機制互作研究
5.1 RIP-seq/qPCR
篩選或驗證RNA修飾直接靶點,研究RNA修飾靶基因的調控機制。
5.2 RNA pull down -MS/WB
篩選或驗證目標RNA互作基因或蛋白,研究相應的分子調控機制。
5.3 雙熒光素酶實驗
驗證兩基因互作,研究相應的分子調控機制。
5.4 ChIP-seq
篩選或驗證目標蛋白與DNA互作,研究相應的分子調控機制。
云序生物服務優勢
優勢一:發表10分以上文章最多的m6A RNA甲基化測序服務平臺。云序已累計支持客戶發表52+篇高水平文章,合計影響因子450分+,是國內支持發文最多、累計影響因子最高的公司。
優勢二:至今完成4000+例m6A測序樣本,全面覆蓋醫口、農口等各類樣本。
優勢三:全面檢測mRNA和各類非編碼RNA(circRNA,lncRNA,Pri-miRNA等)。
優勢四:提供m6A一站式服務:m6A整體水平檢測、m6A測序、MeRIP-qPCR驗證、RIP和RNA pull-down等。
優勢五:率先研發超微量MeRIP測序技術,RNA量低至500ng起。
優勢六:國內最全的RNA修飾測序平臺,提供m6A、m5C、m1A、m7G、m3C、O8G、ac4C乙酰化和2'-O-甲基化測序。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





