光片顯微鏡技術小課堂(五)—— 數據的處理
處理數據
應對高速且大量的數據
光片顯微鏡的一個顯著優點是能夠在數小時(或數天)內以非常高的時間與空間分辨率對大樣本進行成像,但由此導致的結果是會產生巨大的數據量,很容易達到TB級別,于是樣本成像的速度不再受圖像采集速度的限制,而是受數據處理電腦、存儲容量和數據傳輸速度的限制。
當以中等幀速成像時,相機采集的數據可以簡單地通過消費級市場標準的連接(例如USB或FireWire)傳輸到采集電腦的存儲磁盤,甚至使用網絡連接傳輸到云端的普通存儲電腦。如果使用速度更快的相機,數據傳輸速度將會成為限制。有些相機允許圖像數據流保存到內部存儲器,需要在采集后讀出;其他相機則選擇采用更快的數據連接,這在大多數情況下需要在計算機中安裝額外的硬件(圖像采集卡)。然后,數據流要么傳輸到足夠大的主存儲器,要么以同樣快的速度(避免數據丟失)傳輸到專用的數據存儲設備。
還有一種辦法則是通過圖像壓縮來降低數據量。圖像數據可以在相機、圖像采集卡、處理器(CPU)或圖形處理卡(GPU)中壓縮。這樣的確能直接減輕數據傳輸和存儲系統的壓力,但增加了對壓縮和隨后解壓縮的處理能力的需求。
解決數據量問題的一個更有效的選擇是在拍攝前預定義感興趣的區域(ROI),并僅存儲這些區域的數據。這種實時處理的方法一般是為特定的某個標本或科學問題定制的,但可以使圖像數據本身減少很多。同時,在處理過程中數據已經很好地被可視化,以便于進一步的數據分析。理想情況下,顯微鏡(或相機)應該直接輸出預處理和壓縮后的數據,或者,如果可能的話,直接輸出最終結果(圖5-1)。
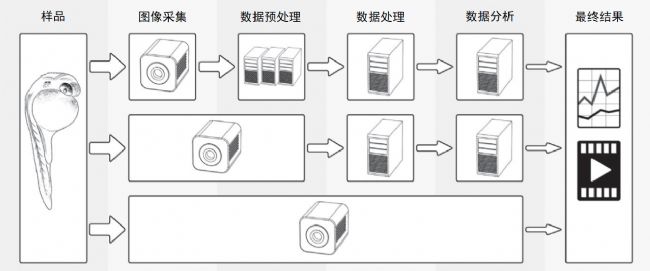
(圖5-1)
圖 5-1 處理光片顯微鏡數據集
光片顯微鏡所產生的大量數據需要強大的數據處理基礎設施。傳統的成像實驗方法(頂行)是從相機獲取樣本的圖像數據開始,在預處理(如轉換和裁剪等)之后,對數據進行處理(如濾波、配準和分割等)和分析(如細胞追蹤等),然后才能得到最終結果。一些自定義方法(中間行)可以在特定成像實驗中實時進行數據預處理,并減少后續處理和分析步驟的負擔。最理想的情況是顯微鏡甚至相機本身可以直接輸出最終結果,而無需對原始數據進行任何存儲、傳輸和處理(最后一行)。
另一種可能性是智能顯微鏡,它能更進一步,不預先定義ROI,而是讓顯微鏡選擇分別以何種分辨率拍攝哪些區域。智能顯微鏡這樣的選擇可以基于現有的,或者之前所拍攝的相似樣本的數據。
5.2 圖像增強
由于通過光片顯微鏡采集的圖像數據優秀的信噪比和整體圖像質量,在獲得數據后通常不需要進行過多的增強、去噪或恢復步驟。如有必要,用于共聚焦顯微鏡或寬場顯微鏡所采集圖像數據的各種濾波器也可用于光片顯微鏡的圖像數據。
5.3 多視圖融合
從多視圖獲取圖像數據(見光片技術小課堂四4.1)之后,一個必要的處理步驟是多視圖融合。第一步是在空間中相互配準各個視圖,這可以通過基準標記(如熒光珠,見光片技術小課堂三3.1)、樣本內的結構(如熒光核)或采集過程中相對位移位置的精確信息來實現。一旦配準,可以通過平均圖像強度或以基于內容的方式來融合圖像數據。多視圖融合的結果是繼承了每個視圖最佳特征的單個數據集。最終,使用者們會希望實時執行這種多視圖融合,以便只保存最終融合,而不保存任何原始數據。
5.4 圖像分析
光片顯微鏡和其他傳統顯微鏡,例如共焦顯微鏡,的圖像分析方法沒有太大區別。數據集可能需要進行三維重構,數據對象可能需要進行分割和追蹤,可能需要在空間和時間上測量信號強度,還可能需要分析多個通道之間的相關性。對于共定位研究和熒光定量,必須的注意一點是靠近視野邊緣時的光片形態和強度的變化,因為這會影響照明和熒光激發。因此,使用者應仔細檢查光片參數(見光片技術小課堂四4.2),并使用選定的基準標記驗證x、y和z中每個通道的重疊。
在大多數情況下,光片顯微鏡所獲取的圖像數據與普通光學顯微鏡的主要區別通常是數據量過大。光片顯微鏡所獲取的高空間與時間分辨率的數據需要更強大的計算能力,并且這尤其適用于延時數據的分析。普通的分析工具通常需要將整個數據集加載到內存中,而對于光片顯微鏡的圖像數據來說,這通常是不可能的。與普通的光學顯微鏡實驗相比,使用者必須謹慎考慮所需的分辨率:最高的可能速度、最大的視野和最高的分辨率可能聽起來非常美好,但數據量的快速增加也會使后續分析變得更加困難。
參考文獻:
1. Kaufmann, A., Mickoleit, M., Weber, M., & Huisken, J. (2012). Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development, 139(17), 3242–3247. http://dx.doi.org/10.1242/dev.082586.
2. Preibisch, S., Saalfeld, S., Schindelin, J., & Tomancak, P. (2010). Software for bead-based registration of selective plane illumination microscopy data. Nature Methods, 7(6), 418–419. http://dx.doi.org/10.1038/nmeth0610-418.
3. Krzic, U., Gunther, S., Saunders, T. E., Streichan, S. J., & Hufnagel, L. (2012). Multiview light-sheet microscope for rapid in toto imaging. Nature Methods, 9(7), 730–733.
http://dx.doi.org/10.1038/nmeth.2064.
4. Schmid, B., Shah, G., Scherf, N., Weber, M., Thierbach, K., Campos, C. P., et al. (2013). Highspeed panoramic light-sheet microscopy reveals global endodermal cell dynamics. Nature Communications, 4, 2207. http://dx.doi.org/10.1038/ncomms3207.





