正電子的力量-PET/CT在推動臨床前藥物研究的應用
作者:Todd Sasser,布魯克BioSpin美洲應用負責人,高級NMI應用專家
在過去的5~10年間,多模式成像已成為藥物發現與開發研究人員分析工具箱的重要組成部分。但目前在臨床前階段使用的技術自有其淵源,并已在早期臨床研究和常規人體診斷中得到驗證。
在這里,我們將重點介紹這些成像方式中或許是最常用,且應當是最靈敏、最定量化的一種,它被稱為PET/CT,即正電子發射斷層掃描(PET)與X射線計算機斷層掃描(CT)的結合。簡單地說,PET被用于人體內分子過程的可視化:系統檢測由正電子放射配體間接發射的伽馬射線對,該配體則通過生物活性放射性示蹤劑引入人體。CT掃描從不同角度對掃描物體進行的大量X射線測量,并用計算機對這些結果進行處理,生成被掃描物體特定區域的橫截面圖像,用戶可以在不切割物體的情況下看到物體內部。
由此產生的配準后圖像提供了必要的知識,有助于跨越臨床前與臨床的界限,即臨床前證據被認為足以將某個候選新藥推升到人體臨床研究第一位的那個點。
影像學簡史
影像學的早期發展主要集中在人體的臨床應用上。20世紀50年代,物理學家Gordon Brownell和神經外科醫生William Sweet創建了一套用于檢測腦腫瘤的系統。大約20年后,Edward Hoffman、Michael M. Ter-Pogossian和Michael E. Phelps于1973年在華盛頓大學建造了第一臺用于人體研究的PET相機。Phelps通常被認為是PET發明者,并因其貢獻而榮獲了1998年恩里科·費米總統獎。一批重要的技術發展,包括放射性示蹤劑、探測器和儀器幾何結構方面的顯著改進,催生了一系列更為完善的儀器,這些早期的發展已得到了廣泛的探討。1
2000年,David Townsend和Ronald Nutt的PET/CT掃描儀被《時代》雜志評為年度醫學發明。在這種背景下,藥物研究人員很快就意識到,成像技術可以應用于藥物開發。它們有可能提高人們對疾病的認識,并為選擇最有可能成功的候選藥物或停止開發最終可能失敗的藥物提供更好的決策依據。
理論與實踐
PET通常通過靜脈注射(iv)放射性示蹤劑(與放射性同位素結合的分子)創建受試者的三維(3D)圖像。載體分子可以與體內特定的蛋白質、受體和生物分子信號通路結合,以量化特定的生物活性。放射性同位素,通常是氟-18(18F)或碳-11(11C),產生與周圍電子相互作用的正電子,導致兩個粒子的湮滅和兩個光子(伽馬射線)的釋放。這些光子以相反的方向(約180°)發射,并由PET掃描儀中的探測器接收,以繪制體內放射性核素的分布圖。
成功的藥物開發依賴于理解動態生物學過程、基因表達、酶和蛋白質活性、疾病的進展與治療、生物分布以及新藥的藥代動力學/藥效學的能力。多模式成像設備PET/CT提供了一種既可以繪制藥物隨時間推移在全身的路徑圖,又可以監測療效并確定其是否適合臨床應用的手段。如何選擇在藥物開發范疇內最適合的成像方法,應基于在解決臨床領域類似問題時應用到何種技術這一思路。
相關技術考慮包括靈敏性、空間分辨率、時間分辨率、靶點特異性和造影劑的生物分布。重要問題之一是確保信號反映的是組織表型,而非主要反映血流、血管通透性或其它可能影響示蹤劑攝取的變量。實際考慮還包括成本、可用性和安全性。
強大的腫瘤學數據
臨床前研究人員有興趣了解腫瘤發展的生物學、腫瘤對癌癥治療的反應以及藥物毒性。PET/CT等成像技術可以揭示不同腫瘤類型的進展機制,以及治療對它們產生的影響。
相比正常細胞,許多癌癥細胞伴隨著更高的代謝速率,因此,使用PET和注射的放射性標記葡萄糖類似物示蹤劑,如18F-脫氧葡萄糖(18F-FDG),可以量化葡萄糖攝取,并檢測腫瘤負荷。該方法還可用于識別分子生物標記物,為癌癥檢測和治療反應評估做出貢獻。PET/CT用于確定18F-FDG的聚集區,獲得半定量標準攝取值(SUV),有助于對腫瘤性質的診斷。血流是另一項重要標志,腫瘤血管化有可能區分非腫瘤性和腫瘤性病變。
癌癥常常是聯合藥物療法的靶標。這些方案可以處理多個分子靶點,并減少產生耐藥性的機會。在一項研究中,研究人員使用臨床前PET/CT成像監測不同療法組合的18F-FDG腫瘤攝取:單獨放療(Rad)、放療加替莫唑胺(Tmz)、放療加米非司酮(Mife),以及Rad加Mife加Tmz。2所有數據都是在三模式小動物PET/SPECT/CT系統上使用多動物傳輸系統(多動物傳輸系統——MATS,和Bruker Albira II,Bruker Biospin GmbH)采集的。
Rad加Tmz是神經膠質母細胞瘤的典型治療方案,但研究發現,使用Mife作為啟動劑比其它療法組合更能抑制腫瘤生長(圖1)。Mife的這種化學放射增敏作用的機制尚未能完全闡明,但這類研究有助于研究人員朝著改進現有癌癥療法的方向邁出重要的一步。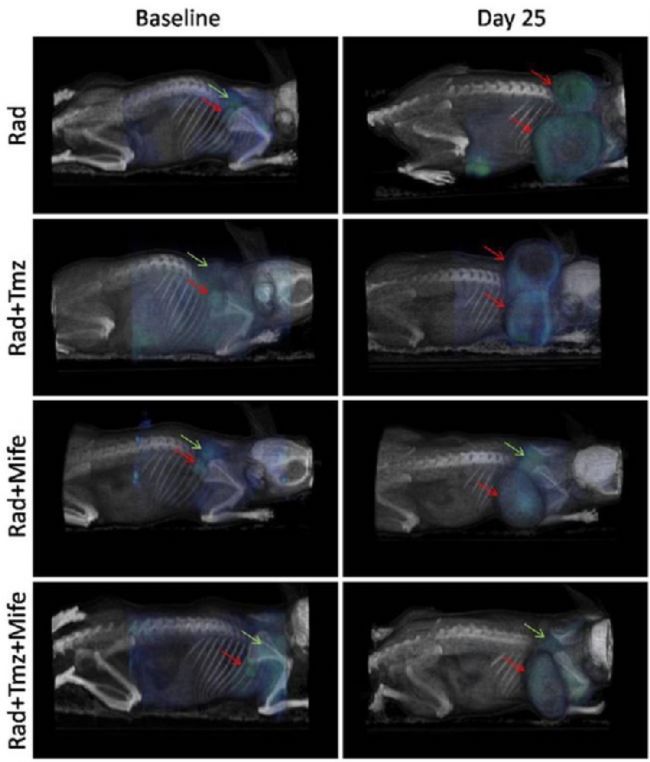 圖1:PET/CT圖像顯示在治療起始日和25天后,四種療法組合中18F-FDG的腫瘤攝取。紅色箭頭表示起始日和第25天的腫瘤位置,綠色箭頭表示棕色脂肪組織(BAT)中典型的18F-FDG攝取位置。依據知識共享協議許可(https://creativecommons.org/licenses/by/2.0/)從參考文獻[2]中復制。
圖1:PET/CT圖像顯示在治療起始日和25天后,四種療法組合中18F-FDG的腫瘤攝取。紅色箭頭表示起始日和第25天的腫瘤位置,綠色箭頭表示棕色脂肪組織(BAT)中典型的18F-FDG攝取位置。依據知識共享協議許可(https://creativecommons.org/licenses/by/2.0/)從參考文獻[2]中復制。
總結
PET/CT成像的發展使生理學、藥理學和生物化學檢測在臨床前藥物開發各階段中的價值得到持續提升。我們對目標疾病的基本認識已經更加深入,疾病發展和療效的重要標志正在被揭示出來并可被監測。現代先進儀器的核素分子成像能力使藥物研究人員能夠通過臨床前研究來開發潛在的藥物,從而更快、更有效地開發未來的治療方法。
有關Bruker臨床前成像解決方案的更多信息,請訪問:https://www.bruker.com/products/preclinical-imaging/nuclear-molecular-imaging.html
參考文獻
1、Jones T和Townsend D(2017);“正電子發射斷層成像的歷史和未來技術創新”; J Med Imaging (Bellingham);4(1):011013. doi:10.1117/1.JMI.4.1.011013。
2、Llaguno-Munive M、Medina LA、Jurado R、Romero-Piña M、Garcia-Lopez P(2013);“米非司酮改善膠質母細胞瘤異種移植物的化學輻射反應”;Cancer Cell International;13:29. https://doi.org/10.1186/1475-2867-13-29。
關于作者
Todd Sasser博士是Bruker臨床前成像應用負責人。他直接與各研究點合作,涉及感染成像、癌癥生物學和探針開發等多個學科領域的PET應用。Sasser博士曾就讀于利物浦大學和夏威夷大學,還是圣母大學的訪問學者。
在過去的5~10年間,多模式成像已成為藥物發現與開發研究人員分析工具箱的重要組成部分。但目前在臨床前階段使用的技術自有其淵源,并已在早期臨床研究和常規人體診斷中得到驗證。
在這里,我們將重點介紹這些成像方式中或許是最常用,且應當是最靈敏、最定量化的一種,它被稱為PET/CT,即正電子發射斷層掃描(PET)與X射線計算機斷層掃描(CT)的結合。簡單地說,PET被用于人體內分子過程的可視化:系統檢測由正電子放射配體間接發射的伽馬射線對,該配體則通過生物活性放射性示蹤劑引入人體。CT掃描從不同角度對掃描物體進行的大量X射線測量,并用計算機對這些結果進行處理,生成被掃描物體特定區域的橫截面圖像,用戶可以在不切割物體的情況下看到物體內部。
由此產生的配準后圖像提供了必要的知識,有助于跨越臨床前與臨床的界限,即臨床前證據被認為足以將某個候選新藥推升到人體臨床研究第一位的那個點。
影像學簡史
影像學的早期發展主要集中在人體的臨床應用上。20世紀50年代,物理學家Gordon Brownell和神經外科醫生William Sweet創建了一套用于檢測腦腫瘤的系統。大約20年后,Edward Hoffman、Michael M. Ter-Pogossian和Michael E. Phelps于1973年在華盛頓大學建造了第一臺用于人體研究的PET相機。Phelps通常被認為是PET發明者,并因其貢獻而榮獲了1998年恩里科·費米總統獎。一批重要的技術發展,包括放射性示蹤劑、探測器和儀器幾何結構方面的顯著改進,催生了一系列更為完善的儀器,這些早期的發展已得到了廣泛的探討。1
2000年,David Townsend和Ronald Nutt的PET/CT掃描儀被《時代》雜志評為年度醫學發明。在這種背景下,藥物研究人員很快就意識到,成像技術可以應用于藥物開發。它們有可能提高人們對疾病的認識,并為選擇最有可能成功的候選藥物或停止開發最終可能失敗的藥物提供更好的決策依據。
理論與實踐
PET通常通過靜脈注射(iv)放射性示蹤劑(與放射性同位素結合的分子)創建受試者的三維(3D)圖像。載體分子可以與體內特定的蛋白質、受體和生物分子信號通路結合,以量化特定的生物活性。放射性同位素,通常是氟-18(18F)或碳-11(11C),產生與周圍電子相互作用的正電子,導致兩個粒子的湮滅和兩個光子(伽馬射線)的釋放。這些光子以相反的方向(約180°)發射,并由PET掃描儀中的探測器接收,以繪制體內放射性核素的分布圖。
成功的藥物開發依賴于理解動態生物學過程、基因表達、酶和蛋白質活性、疾病的進展與治療、生物分布以及新藥的藥代動力學/藥效學的能力。多模式成像設備PET/CT提供了一種既可以繪制藥物隨時間推移在全身的路徑圖,又可以監測療效并確定其是否適合臨床應用的手段。如何選擇在藥物開發范疇內最適合的成像方法,應基于在解決臨床領域類似問題時應用到何種技術這一思路。
相關技術考慮包括靈敏性、空間分辨率、時間分辨率、靶點特異性和造影劑的生物分布。重要問題之一是確保信號反映的是組織表型,而非主要反映血流、血管通透性或其它可能影響示蹤劑攝取的變量。實際考慮還包括成本、可用性和安全性。
強大的腫瘤學數據
臨床前研究人員有興趣了解腫瘤發展的生物學、腫瘤對癌癥治療的反應以及藥物毒性。PET/CT等成像技術可以揭示不同腫瘤類型的進展機制,以及治療對它們產生的影響。
相比正常細胞,許多癌癥細胞伴隨著更高的代謝速率,因此,使用PET和注射的放射性標記葡萄糖類似物示蹤劑,如18F-脫氧葡萄糖(18F-FDG),可以量化葡萄糖攝取,并檢測腫瘤負荷。該方法還可用于識別分子生物標記物,為癌癥檢測和治療反應評估做出貢獻。PET/CT用于確定18F-FDG的聚集區,獲得半定量標準攝取值(SUV),有助于對腫瘤性質的診斷。血流是另一項重要標志,腫瘤血管化有可能區分非腫瘤性和腫瘤性病變。
癌癥常常是聯合藥物療法的靶標。這些方案可以處理多個分子靶點,并減少產生耐藥性的機會。在一項研究中,研究人員使用臨床前PET/CT成像監測不同療法組合的18F-FDG腫瘤攝取:單獨放療(Rad)、放療加替莫唑胺(Tmz)、放療加米非司酮(Mife),以及Rad加Mife加Tmz。2所有數據都是在三模式小動物PET/SPECT/CT系統上使用多動物傳輸系統(多動物傳輸系統——MATS,和Bruker Albira II,Bruker Biospin GmbH)采集的。
Rad加Tmz是神經膠質母細胞瘤的典型治療方案,但研究發現,使用Mife作為啟動劑比其它療法組合更能抑制腫瘤生長(圖1)。Mife的這種化學放射增敏作用的機制尚未能完全闡明,但這類研究有助于研究人員朝著改進現有癌癥療法的方向邁出重要的一步。

總結
PET/CT成像的發展使生理學、藥理學和生物化學檢測在臨床前藥物開發各階段中的價值得到持續提升。我們對目標疾病的基本認識已經更加深入,疾病發展和療效的重要標志正在被揭示出來并可被監測。現代先進儀器的核素分子成像能力使藥物研究人員能夠通過臨床前研究來開發潛在的藥物,從而更快、更有效地開發未來的治療方法。
有關Bruker臨床前成像解決方案的更多信息,請訪問:https://www.bruker.com/products/preclinical-imaging/nuclear-molecular-imaging.html
參考文獻
1、Jones T和Townsend D(2017);“正電子發射斷層成像的歷史和未來技術創新”; J Med Imaging (Bellingham);4(1):011013. doi:10.1117/1.JMI.4.1.011013。
2、Llaguno-Munive M、Medina LA、Jurado R、Romero-Piña M、Garcia-Lopez P(2013);“米非司酮改善膠質母細胞瘤異種移植物的化學輻射反應”;Cancer Cell International;13:29. https://doi.org/10.1186/1475-2867-13-29。
關于作者
Todd Sasser博士是Bruker臨床前成像應用負責人。他直接與各研究點合作,涉及感染成像、癌癥生物學和探針開發等多個學科領域的PET應用。Sasser博士曾就讀于利物浦大學和夏威夷大學,還是圣母大學的訪問學者。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





