2020年環狀RNA高分文章怎么發?
文章導讀
環狀RNA作為最新發現的RNA分子,從誕生之日起就是光環加身,屢屢登上Science、Nature、Cell等高分期刊。近期發表的《2019研究前沿》中,“環狀RNA作為癌癥新的生物標志物”成為生物科學領域6個新興前沿之一。2019年環狀RNA共發表SCI論文885篇,較2018年增長約20%,其中大于10分的文章約60篇,是2018年的3倍左右。2019年關于環狀RNA的國自然審批金額高達8000多萬,環狀RNA的火熱程度可想而知。
近期國際頂級雜志Cancer Cell上再次刊登了關于環狀RNA研究,來自瓦倫西亞大學等機構的科學家們通過研究開發了一種有效阻斷黑色素瘤發生轉移的新方法;文章中,研究人員發現環狀RNA-CDR1as可結合IGF2BP3,CDR1as表達降低后可釋放IGF2BP3,改變一些靶基因的表達狀態,參與黑色素瘤的遷移侵襲及GPX4藥物敏感性,環狀RNA-CDR1as有望成為新型癌癥生物標志物從而幫助開發新型抗癌療法。下面小編和大家一起解讀這篇23分的高分文章。
環狀RNA作為最新發現的RNA分子,從誕生之日起就是光環加身,屢屢登上Science、Nature、Cell等高分期刊。近期發表的《2019研究前沿》中,“環狀RNA作為癌癥新的生物標志物”成為生物科學領域6個新興前沿之一。2019年環狀RNA共發表SCI論文885篇,較2018年增長約20%,其中大于10分的文章約60篇,是2018年的3倍左右。2019年關于環狀RNA的國自然審批金額高達8000多萬,環狀RNA的火熱程度可想而知。
近期國際頂級雜志Cancer Cell上再次刊登了關于環狀RNA研究,來自瓦倫西亞大學等機構的科學家們通過研究開發了一種有效阻斷黑色素瘤發生轉移的新方法;文章中,研究人員發現環狀RNA-CDR1as可結合IGF2BP3,CDR1as表達降低后可釋放IGF2BP3,改變一些靶基因的表達狀態,參與黑色素瘤的遷移侵襲及GPX4藥物敏感性,環狀RNA-CDR1as有望成為新型癌癥生物標志物從而幫助開發新型抗癌療法。下面小編和大家一起解讀這篇23分的高分文章。

原文鏈接:Epigenetic Silencing of CDR1as Drives IGF2BP3-Mediated Melanoma Invasion and Metastasis
發表期刊:Cancer Cell
影響因子:23.916
發表日期:20200113
運用技術:全轉錄組測序、RIP-seq(云序提供以上服務)
文章內容
1.circRNA測序分析揭示了CDR1影響黑色素瘤發生發展
作者分析了4例黑色素瘤細胞和10例短培養黑色素瘤細胞(STCs)的全轉錄組測序(云序提供此服務)數據,共發現7,849個環狀RNA,其中上調116個,下調572個。重要的癌癥相關的環狀RNA--CDR1as,它的成環比例比預期的要低,10例STCs中6例檢測不到CDR1as,作者發現另外的4例是從黑色素瘤腦轉移的病灶分離的,懷疑是由于分離的標本中摻雜了膠質細胞的緣故。黑色素瘤的細胞系中CDR1as的表達也降低。進一步分析表明相對于初發的患者,高轉移侵襲的黑色素瘤標本中CDR1as的表達顯著降低。生存分析表明,CDR1as的低表達與患者的不良預后相關。這些現象表明,環狀CDR1as與黑色素瘤的發生發展相關。
發表期刊:Cancer Cell
影響因子:23.916
發表日期:20200113
運用技術:全轉錄組測序、RIP-seq(云序提供以上服務)
文章內容
1.circRNA測序分析揭示了CDR1影響黑色素瘤發生發展
作者分析了4例黑色素瘤細胞和10例短培養黑色素瘤細胞(STCs)的全轉錄組測序(云序提供此服務)數據,共發現7,849個環狀RNA,其中上調116個,下調572個。重要的癌癥相關的環狀RNA--CDR1as,它的成環比例比預期的要低,10例STCs中6例檢測不到CDR1as,作者發現另外的4例是從黑色素瘤腦轉移的病灶分離的,懷疑是由于分離的標本中摻雜了膠質細胞的緣故。黑色素瘤的細胞系中CDR1as的表達也降低。進一步分析表明相對于初發的患者,高轉移侵襲的黑色素瘤標本中CDR1as的表達顯著降低。生存分析表明,CDR1as的低表達與患者的不良預后相關。這些現象表明,環狀CDR1as與黑色素瘤的發生發展相關。

圖1 環狀CDR1as在黑色素瘤中低表達
2. 環狀CDR1as與黑色素瘤侵襲相關
為了探索環狀CDR1as在黑色素瘤中的功能,作者沉默環狀CDR1as后檢測黑色素瘤細胞的表型。結果顯示在高表達CDR1as的黑色素瘤細胞(WM278和WM115)中干擾CDR1as并不能顯著影響細胞增殖,但可以顯著提高細胞侵襲能力。在低表達LINC00632/CDR1as的細胞(SK-MEL-28 和 501MEL)中,干擾CDR1as對侵襲表型沒有影響。在SK-MEL-28 和 501MEL細胞中過表達CDR1as能降低侵襲性,體內成瘤實驗也表明,干擾CDR1as并不顯著改變腫瘤大小和生長速度,但可以顯著提高肺轉移比例。
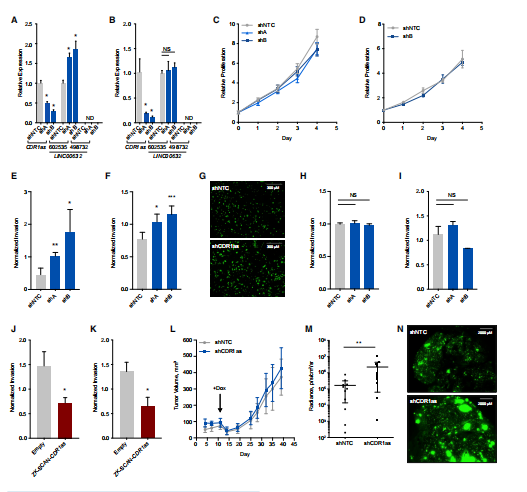
圖2 環狀CDR1as與黑色素瘤侵襲相關
3. 環狀CDR1as的生成調控
早期曾有報道發現CDR1as來自于非編碼RNA--LINC00632的基因內部。本文作者進一步驗證了這個假設,并證明CDR1as的表達與LINC00632高度相關。利用SAM CRISPR/Cas9技術增強LINC00632的表達后,CDR1as的數目也會增加。這些數據均證實了之前的報道,即CDR1as來源于LINC00632。miR-671-5p可通過RNAi機制促進CDR1as的降解,但還沒有報道表明LINC00632是miR-671-5p的作用底物,因此作者分析了黑色素瘤組織和細胞中三者的表達關系,結果表明在病人組織和細胞中miR-671-5p與CDR1as的表達相關性較弱。過表達miR-671-5p可降低CDR1as的表達,但不影響LINC00632的表達,而敲降miR-671-5p并不能使得CDR1as表達值恢復。綜上,黑色素瘤中CDR1as的表達似乎并非由miR-671-5p的調控實現,更可能是由于CDR1as的來源基因LINC00632表達的影響造成的。
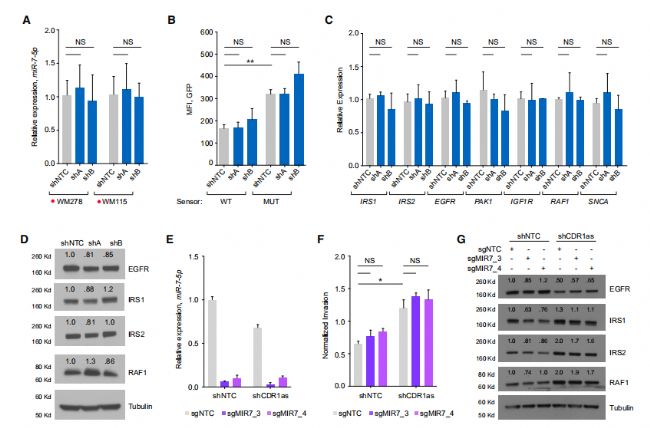
圖3 環狀CDR1as的表達主要受來源基因LINC00632表達的影響
4. IGF2BP3與CDR1as相互作用介導黑色素瘤的侵襲
為揭示CDR1as在黑色素瘤中的作用機制,作者首先思考了CDR1as可能的相互作用蛋白。作者首先從CLIP-seq的在線數據中分析了可能的結合蛋白,并從中發現了IGF2BP家族蛋白存在與CDR1as相互作用的證據。為進一步驗證,作者進行了RIP-seq(云序提供此服務),發現IGF2BP3對CDR1as的富集作用最強,并且對LINC00632的結合不高,說明IGF2BP3具有特異性結合CDR1as的作用。干擾IGF2BP3可挽救由于CDR1as缺失導致的侵襲增強現象。
CDR1as干擾前后IGF2BP3結合的靶分子種類沒有太明顯的改變,但CDR1as干擾后變化顯著的基因更傾向于富集到IGF2BP3結合的靶分子列表中。為進一步分析這些基因對CDR1as敲降后促進侵襲的表型的關系,作者進行了小規模RNA干擾文庫的分析,針對CDR1as干擾后表達會增高的9種基因進行RNAi文庫分析,其中6 種基因能顯著逆轉因干擾CDR1as導致的侵襲增加。其中SNAI2 和MEF2C在CDR1as干擾后的表達增高是由IGF2BP3介導的。
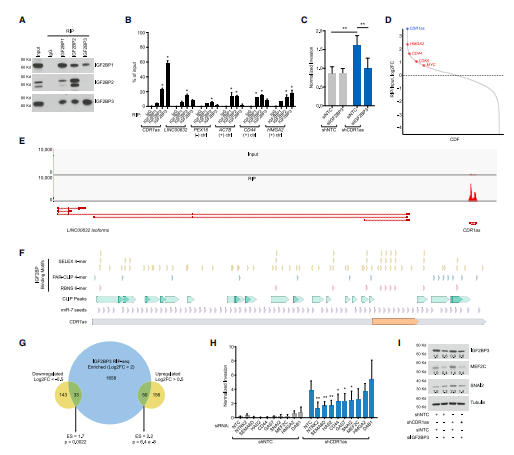
圖4 IGF2BP3與CDR1as相互作用介導黑色素瘤的侵襲
5. CDR1as表達狀態與GPX4抑制劑敏感性相關
最后,為分析CDR1as表達狀態與黑色素瘤中藥物敏感性和基因型的相關性,作者對不同數據庫進行挖掘,并根據CDR1as表達狀態進行了分組,分別為高、中和低表達三組。作者發現低表達CDR1as 組的細胞對多種MAPK通路的抑制劑更敏感,而CDR1as高表達組中對BRAF抑制劑的不敏感性。同樣,高表達CDR1as組的細胞也對GPX4抑制劑更敏感。數據庫分析表明,黑色素瘤中GPX4抑制劑的敏感性與MITF / AXL基因的表達情況有關。作者分析發現CDR1as高表達的細胞傾向于表現出MITF低表達和AXL高表達,而CDR1as低表達的細胞傾向于表現出MITF高表達和AXL低表達。實驗結果也表明CDR1as表達狀態與GPX4抑制劑敏感性相關,低表達CDR1as組的細胞對GPX4抑制劑更敏感。然而在高表達CDR1as的細胞中干擾CDR1as后并不能提高對GPX4的敏感性,說明CDR1as可作為黑色素瘤對GPX4抑制劑敏感性的指標,但并非該藥物發揮功能的關鍵因素。
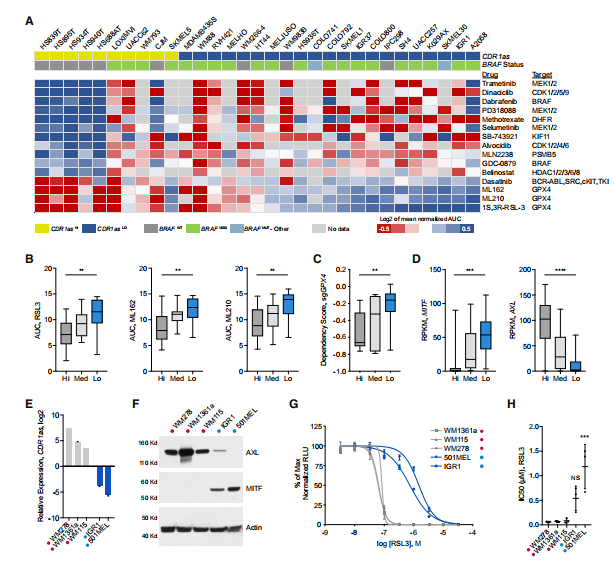
圖5 CDR1as表達狀態與GPX4抑制劑敏感性相關
總結:
腫瘤轉移是癌癥患者死亡的主要原因。了解和探究腫瘤轉移擴散的機制,將會揭示重要的腫瘤發生發展生物學過程,進而為臨床提供新的治療方向和靶點。本文作者以黑色素瘤為模型,通過全轉錄組測序和RIP-seq等技術(云序提供以上服務)研究了環狀RNA--CDR1as在腫瘤轉移中的作用。作者發現CDR1as的生成主要受其來源的長鏈非編碼RNA--LINC00632的表達影響,并通過IGF2BP3蛋白介導的機制促進黑色素瘤的侵襲和轉移。此外,CDR1as表達狀態與GPX4抑制劑敏感性相關。本文的研究揭示了CDR1as的功能、預后和預測作用,并揭示了環狀RNAs在轉移中的關鍵作用。
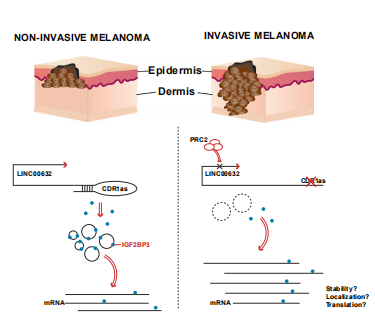
圖6環狀CDR1as通過 IGF2BP3蛋白介導機制促進黑色素瘤的轉移
云序生物—環狀RNA研究領跑者!(下段當中產品超鏈接)
云序生物作為國內早期提供環狀RNA測序的測序公司,自行建立的環狀RNA數據庫circDB,憑借物種覆蓋廣、數據量大、疾病背景多的特點為客戶提供優質的服務。云序積累了超過10000例環狀RNA測序的經驗,樣本覆蓋20多個物種以及50多種疾病。云序生物提供系統性環狀RNA服務,從篩選(全轉錄組測序)到驗證(qPCR)再到機制研究(RIP、RNA pull-down、chip)以及上游表觀調控(m6A甲基化、m5C甲基化、m1A甲基化、m7G甲基化、ac4c乙酰化測序、2’-O-RNA甲基化測序),為您全方位的覆蓋環狀RNA上下游分子機制驗證的重要研究環節。除了提供組織和細胞的樣本類型測序之外,我們還提供體液、血清血漿、外泌體石蠟樣本等特殊樣本的測序服務。回首過去,從國內環狀RNA測序到全轉錄組測序概念提出,到m6A等RNA甲基化測序平臺,再到如今的eccDNA測序服務,我們一直在緊跟國際科研熱點方向進行測序技術的創新。
云序生物環狀RNA一站式服務相關產品

云序客戶環狀RNA相關文章

相關產品:
全轉錄組測序
環狀RNA測序
LncRNA測序
mRNA測序
miRNA測序
RIP 測序
RNA pull-down
ChIP測序
ATAC測序
Cut-tag測序
往期回顧
1. circRNA和m6A再次秀恩愛攜手登上Nature Communication
2. 全轉錄組測序一箭三雕怎么玩?
3. 環狀RNA做ceRNA機制還能發10分以上文章嗎?
4. 做了環狀RNA,還愁5分文章不好發?丨云序客戶最新環狀RNA成果揭秘
5. circRNA再發IF=18.88高分文章--您想知道的circRNA機制研究,都在這兒
6. 云序客戶發表首篇直腸癌轉移肝癌環狀RNA文章,影響因子高達7.8分!
全轉錄組測序
環狀RNA測序
LncRNA測序
mRNA測序
miRNA測序
RIP 測序
RNA pull-down
ChIP測序
ATAC測序
Cut-tag測序
往期回顧
1. circRNA和m6A再次秀恩愛攜手登上Nature Communication
2. 全轉錄組測序一箭三雕怎么玩?
3. 環狀RNA做ceRNA機制還能發10分以上文章嗎?
4. 做了環狀RNA,還愁5分文章不好發?丨云序客戶最新環狀RNA成果揭秘
5. circRNA再發IF=18.88高分文章--您想知道的circRNA機制研究,都在這兒
6. 云序客戶發表首篇直腸癌轉移肝癌環狀RNA文章,影響因子高達7.8分!
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd
地址:上海市松江區莘磚公路518號20號樓3樓
網址:http://www.cloud-seq.com.cn
電話:021-64878766 郵箱:market@cloud-seq.com.cn
標簽:
全轉錄組測序、RIP-seq
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





