大分子量蛋白轉印的5個技巧
做western blot印跡膜時,較大的蛋白質眾所周知是難以處理的。 特別是,您可能很難實現良好的轉印效率。 在某些方面,蛋白質難以朝著你想要的方向前進。
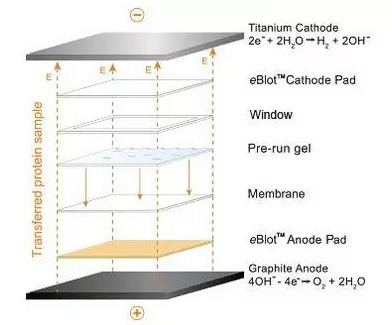
我們將給5點建議,幫助膠上大分子量蛋白的轉印。
01
犧牲膠的韌性來提高效率
低濃度的丙烯酰胺凝膠可能難以操作。一旦手指觸摸它就會撕裂? 但是,與高濃度的凝膠相比,大蛋白將更有效地從較低濃度的凝膠中移出(分辨率更好)。因此,提高你的靈活性和耐心,嘗試6-7.5%的凝膠。 或者可以嘗試使用梯度凝膠,可以同時分辨小分子量和大分子量蛋白質。
02
去除去垢劑
較大的蛋白質可能在凝膠中沉淀,抑制轉印。 在SDS-PAGE期間添加的SDS通常會解決這個問題,但較大的蛋白質可能需要更多的SDS。 您可以在轉印緩沖液中添加最多0.1%的SDS以阻止沉淀的產生。因為SDS抑制蛋白質與膜的結合,因此請嘗試從低濃度的SDS開始(例如0.0375%),然后逐步提高。
如果確實在轉印緩沖液中添加了SDS,則需要重新優化其他轉印條件,如轉印時間和電流,以防止蛋白透過膜。
03
降低甲醇濃度
甲醇與SDS具有相反的作用。 雖然甲醇增加蛋白與膜的結合,但它從蛋白質中剝離SDS。 因此,降低轉印緩沖液中的甲醇濃度也有助于防止蛋白沉淀。 您可以將濃度降低到10%或更低。 如果您使用的是PVDF膜,則可以完全省去甲醇。 在使用之前,不要忘記用甲醇將膜激活!
甲醇也會導致凝膠收縮,所以如果減少甲醇,你的凝膠會膨脹得更多。 這也有助于轉移大分子量蛋白。 但您可能需要使用比正常情況稍大的濾紙和膜。
04
慢速轉印大分子量蛋白
大分子量蛋白想要獲得良好的轉移效率可能需要更多時間。 快速移動那些大分子可能很困難。 嘗試以較低的電壓過夜轉印。 只是不要忘記保持轉印要在低溫環境!
05
使用濕轉
雖然半干轉印可能更適合設置并且需要較少的緩沖液,但它確實有其缺點。 半干轉印通常比濕轉移效率低,并且不能增加轉印時間以適應更大的蛋白。 轉移大蛋白時最好堅持使用濕轉。





