CloudReady生物反應器助力進行大腸桿菌發酵生產慢病毒載體四質粒
引言
質粒DNA的生產依賴于基因重組技術,將目的基因和其他輔助元件連接形成共價閉合環狀結構,通過大腸桿菌高密度發酵、純化生產制備。隨著CGT和mRNA等生物制藥技術的飛速發展,質粒DNA作為關鍵原料的需求急劇增加。
四質粒系統是一種基于HIV-1病毒改造的慢病毒載體系統,由轉移質粒、包裝質粒、包膜蛋白質粒及Rev表達質粒組成,各質粒協同作用,共同完成假型慢病毒顆粒的包裝與感染過程。該系統在基因治療和臨床醫學研究中具有廣泛應用。
本研究在CloudReady®(1.5L) 4聯云平臺生物反應器中系統探究不同補料速度及方式對基于慢病毒載體的四質粒系統在大腸桿菌上發酵生產質粒DNA的影響,通過三種不同的補料方式,顯著提升了質粒DNA的產率,為細胞與基因治療(CGT)及mRNA疫苗/藥物的產業化提供了重要技術支持。
材料與方法
實驗場所:
迪必爾生物 應用技術與工程研究中心(CARE)
菌株:
分別攜帶rev(4180bp)、fmc63(11922bp)、pol和gag(8890bp)、vsvg(5822bp)的四種大腸桿菌stbl3感受態細胞
檢測方法:
取發酵液100μL,經離心去上清后,使用TIANGEN小提試劑盒提取質粒DNA,并通過超微量分光光度計測定質粒濃度。同時,采用實時熒光定量PCR儀檢測質粒的完整性,確保無丟失現象發生(表1)。
反應器控制器及罐體:
CloudReady® + 1.5L 玻璃罐體×4
 圖1 CloudReady云平臺生物反應器16聯
圖1 CloudReady云平臺生物反應器16聯
軟件系統:
D2MS(設備和數據管理系統, Device & Data management system)Pro
實驗過程及結果
本研究在實驗室成熟的發酵培養基配方基礎上進行,嚴格控制各項參數(如表2所示)。為了優化質粒產量,我們嘗試了三種不同的補料策略:補料關聯DO_PV、恒速補料和時間序列補料。
表2 控制參數
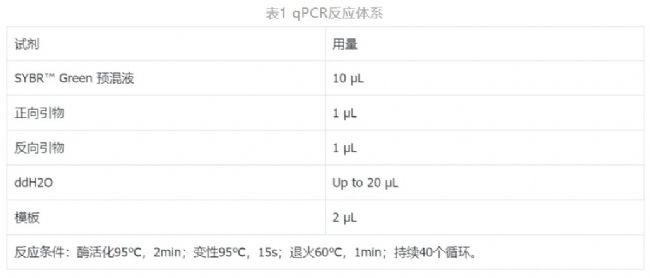
(1) 補料關聯DO_PV
實驗首先進行R1、R2的發酵實驗,按照補料泵關聯DO_PV值的方式進行補料(圖2),并且設置攪拌通氣只升不降。這種控制方式是根據DO_PV值的開關補料,具體邏輯是:DO_PV值高于設定的30%后,補料泵以10mL/h的速度運轉;DO_PV值低于設定的30%后,停止補料,這時溶氧控制器會調高攪拌速度、通氣量以增大DO。一般情況下,DO_PV值上升意味著底物的缺失,因此檢測DO_PV值的變化是可以較好的為菌株流加適量的底物。
然而這批實驗R1、R2在開啟補料后DO并未下降(圖3),反而是持續升高,導致補料泵持續運轉。推測可能是菌株在溶氧反彈后代謝發生變化,這時較快的補料速度反而可能有抑制作用。
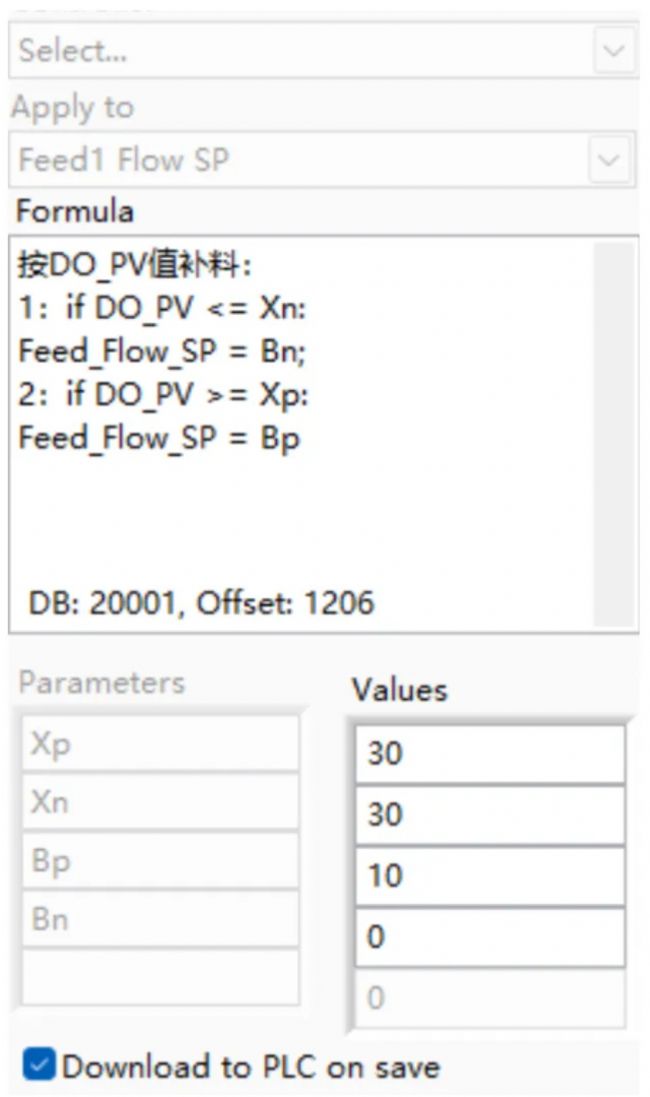
圖2 補料關聯DO_PV
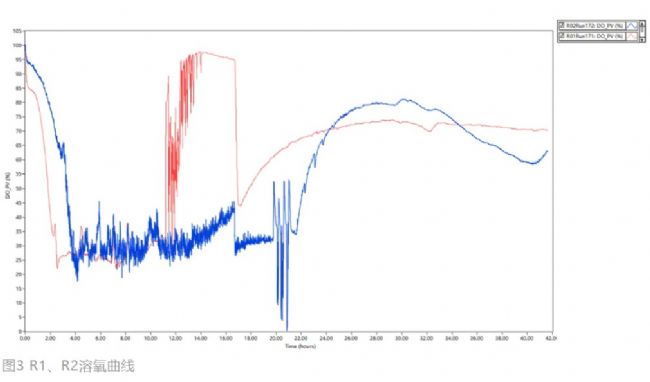
圖3 R1、R2溶氧曲線
(2) 恒速補料
上一批實驗溶氧未下降導致補料泵持續補料,這批實驗改用較慢的速度1mL/h恒速補料觀察菌株的生長狀況和質粒產量。結果顯示(圖4),20.5h后四個菌株OD600沒有明顯上升,但質粒產量有持續增長,且qPCR檢測質粒無丟失現象;R2、R4在52h觀察到質粒濃度下降的情況。
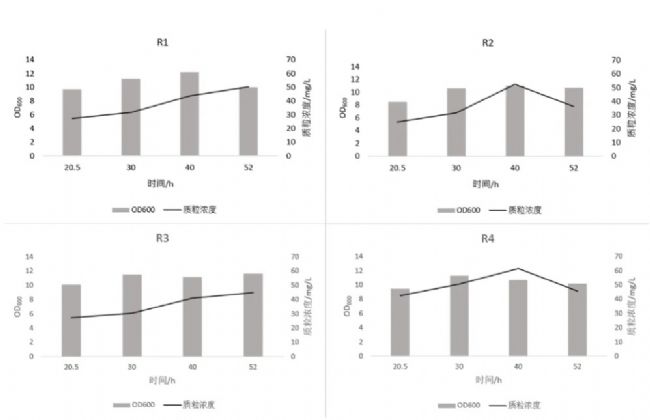
圖4 菌株OD600和質粒濃度變化
(3) 時間序列補料
上批恒速補料菌株OD600沒有明顯增長,因此本批次增大補料速度,開啟補料后按補料開始的相對時間進行梯度補料(圖5)。圖6是此次實驗四個菌株OD600和質粒濃度變化。本批次增大補料速度后四個菌株OD600和質粒濃度都有持續升高,最終的菌株密度和質粒產量也較上批恒速補料有所提高,且樣品QPCR檢測無丟失現象。批次運行46h下罐,培養過程中R1-R4的最大OD600分別為36.1、23.9、32、27.8,R1-R4的最大質粒濃度分別為231.5、154、281.89、296.33mg/L,其中R2的最大OD600和質粒濃度相比R1、R3、R4都是最低的,R1的最大OD600最高,R4的最大質粒濃度最高。
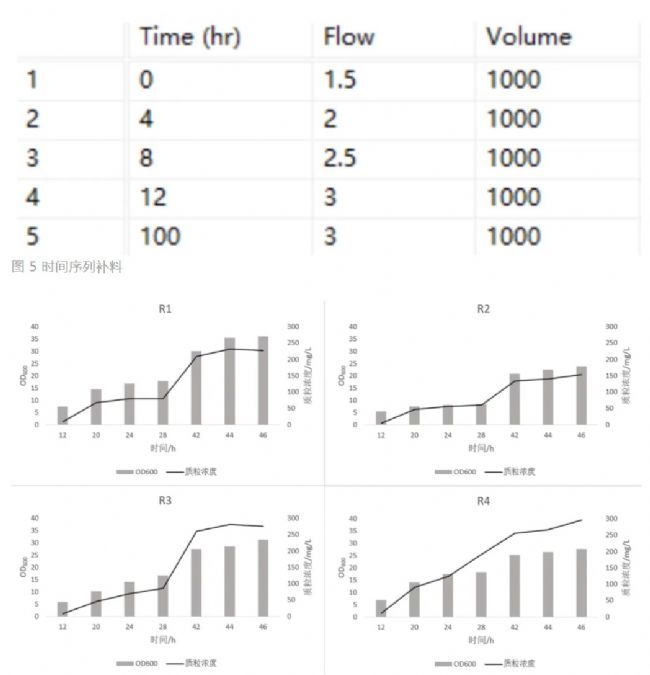 圖6 菌株OD600和質粒濃度變化
圖6 菌株OD600和質粒濃度變化
結論
本研究通過平行生物反應器平臺,系統地評估不同補料方式和速度在大腸桿菌發酵生產質粒DNA過程中的應用效果,發現補料速度較為合適的時間序列補料策略能夠有效提升質粒DNA的產率和穩定性。其中,攜帶vsvg的大腸桿菌在該策略下,最大質粒濃度達到了296.33mg/L,這一結果充分驗證了該策略的有效性和可行性。本研究不僅為大腸桿菌發酵生產質粒DNA提供了重要的技術參考,同時也進一步驗證了平行生物反應器在發酵工藝優化的重要性。





