已獲批上市的38款基因治療藥物匯總
經過多年的曲折發展,基因治療藥物臨床試驗取得了鼓舞人心的成效,(不統計DNA疫苗和mRNA疫苗在內)目前已有三十多款基因治療藥物獲批上市,隨著越來越多的基因治療產品的上市,以及基因治療技術的快速發展,基因治療即將迎來高速發展期。
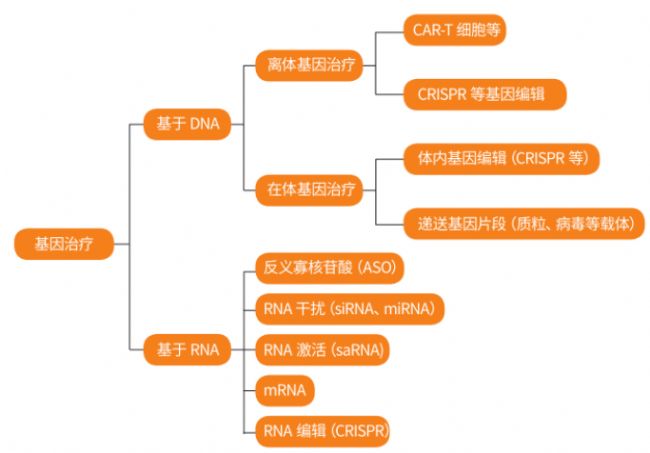
基因治療的分類(圖片來源:生物經緯)
本文列舉了(不包括DNA疫苗和mRNA疫苗在內)已獲批上市的38款基因療法。
體外基因療法
(1)Strimvelis
公司:由葛蘭素史克(GSK)公司研發。
上市時間:2016年5月被歐盟批準上市。
適應癥:用于重癥聯合免疫缺陷癥(簡稱SCID)治療。
備注:該療法大致流程是首先獲得患者自身的造血干細胞,在體外進行擴增培養,之后利用逆轉錄病毒將功能性ADA(腺苷脫氨酶)基因拷貝導入其造血干細胞,最后將修飾后的造血干細胞回輸到本人體內。臨床結果顯示,Strimvelis治療的ADA-SCID患者3年存活率為100%。
(2)Zalmoxis
公司:由意大利MolMed公司生產。
上市時間:2016年獲歐盟有條件上市許可。
適應癥:用于造血干細胞移植后患者免疫系統的輔助治療。
備注:Zalmoxis是一款經逆轉錄病毒載體改造的同種異體T細胞自殺基因免疫療法,該方法使用逆轉錄病毒載體對同種異體來源的T細胞進行基因改造,使基因修飾后的T細胞表達1NGFR和HSV-TK Mut2自殺基因,使得人們可以隨時使用更昔洛韋(ganciclovir)藥物殺死引起不良免疫反應的T細胞,防止可能出現的GVHD進一步惡化,為半相合HSCT患者術后免疫功能重建保駕護航。
(3)Invossa-K
公司:由TissueGene(KolonTissueGene)公司研發。
上市時間:2017年7月在韓國獲得批準上市。
適應癥:用于治療退行性膝關節炎。
備注:Invossa-K是一種涉及人軟骨細胞的同種異體細胞基因療法,同種異體細胞經體外基因修飾,修飾后的細胞經關節內注射給藥后可表達分泌轉化生長因子β1(TGF-β1),進而改善骨關節炎癥狀。臨床結果顯示,Invossa-K能夠顯著改善膝關節炎。于2019年被韓國藥監部門取消許可證,因為該制造商錯誤地標記了所使用的成分。
(4)Zynteglo
公司:由美國藍鳥生物(bluebird bio)公司研發。
上市時間:2019年獲歐盟批準上市。
適應癥:用于治療輸血依賴性β-地中海貧血。
備注:Zynteglo是一款慢病毒體外基因療法,該療法通過慢病毒載體,把正常的β-珠蛋白基因(βA-T87Q-珠蛋白基因)的功能性拷貝導入到從患者體內取出的造血干細胞中,再將這些基因修飾的自體造血干細胞回輸到患者體內,一旦患者擁有正常的βA-T87Q-珠蛋白基因,他們就有可能產生正常的HbAT87Q蛋白,即可有效降低或消除輸血需求。這是一種一次性療法,旨在取代終身輸血和終生藥物,適用于12歲及以上的患者。
(5)Skysona
公司:由美國藍鳥生物(bluebird bio)公司研發。
上市時間:2021年7月獲歐盟批準上市。
適應癥:用于治療早期腦腎上腺腦白質營養不良(CALD)。
備注:Skysona基因療法是唯一一個獲批用于治療早期腦腎上腺腦白質營養不良(CALD)的一次性基因療法。Skysona(elivaldogene autotemcel,Lenti-D)是一種造血干細胞慢病毒體外基因療法Lenti-D。療法大致流程為:從患者體內取出自體造血干細胞,體外經搭載人ABCD1基因的慢病毒轉導修飾后,回輸給患者。用于治療年齡在18歲以下、攜帶ABCD1基因突變、CALD患者。
(6)Kymriah
公司:由諾華(Novartis)研發。
上市時間:2017年8月獲FDA批準上市。
適應癥:治療前體B細胞急性淋巴細胞白血病(ALL)和復發、難治性DLBCL。
備注:Kymriah是一款慢病毒體外基因治療藥物,是全球首款獲批上市的CAR-T療法,靶向CD19,采用了4-1BB的共刺激因子。在美國定價為47.5萬美元,在日本定價為31.3萬美元。
(7)Yescarta
公司:由吉利德(GILD)公司旗下Kite Pharma開發。
上市時間:2017年10月獲FDA批準上市。
適應癥:用于治療復發或難治性大B細胞淋巴瘤。
備注:Yescarta是一款逆轉錄病毒體外基因療法,是全球第二款獲批上市的CAR-T療法,靶向CD19,采用了CD28的共刺激因子。在美國定價為37.3萬美元。
(8)Tecartus
公司:由吉利德(GILD)公司開發。
上市時間:2020年7月份獲FDA批準上市。
適應癥:用于復發或難治性套細胞淋巴瘤。
備注:Tecartus是一款靶向CD19的自體CAR-T細胞療法,是全球第三款獲批上市的CAR-T療法。
(9)Breyanzi
公司:由百時美施貴寶(BMS)開發。
上市時間:2021年2月獲FDA批準上市。
適應癥:復發或難治性(R/R)大B細胞淋巴瘤(LBCL)。
備注:Breyanzi是一款基于慢病毒的體外基因療法,是全球第四款獲批上市的CAR-T療法,靶向CD19。Breyanzi的獲批是百時美施貴寶在細胞免疫治療領域的一個里程碑,該藥物是百時美施貴寶在2019年以740億美元收購Celgene時獲得的。
(10)Abecma
公司:由百時美施貴寶(BMS)和藍鳥生物(bluebird bio)共同開發。
上市時間:2021年3月由FDA批準上市。
適應癥:復發或難治性多發性骨髓瘤。
備注:Abecma是一款基于慢病毒的體外基因療法,是全球首款靶向BCMA的CAR-T細胞療法,是FDA批準的第五款CAR-T療法。其藥物原理是體外通過慢病毒介導的基因修飾在患者自體T細胞上表達嵌合BCMA的受體,輸注該細胞基因藥物前,患者先接受環磷酰胺和氟達拉濱兩種化合物預處理,以清除患者體內未基因修飾的T細胞,隨后回輸修飾后的T細胞,修飾后的T細胞在患者體內尋找并殺死表達BCMA的癌細胞。
(11)Libmeldy
公司:由Orchard Therapeutics公司開發。
上市時間:2020年12月份獲歐盟批準上市。
適應癥:用于治療異染性腦白質營養不良(metachromatic leukodystrophy,MLD)。
備注:Libmeldy是一款基于慢病毒體外基因修飾的自體CD34+細胞的基因療法。臨床數據顯示,單次靜脈輸注Libmeldy可以有效地改變早發型MLD的病程,未接受治療的同年齡段患者則出現嚴重的運動和認知障礙。
(12)倍諾達
公司:由藥明巨諾公司開發。
上市時間:2021年9月獲NMPA正式批復。
適應癥:治療經過二線或以上系統性治療后成人患者的復發或難治性大B細胞淋巴瘤(r/r LBCL)。
備注:倍諾達是一款抗CD19的CAR-T基因療法,也是藥明巨諾公司的核心產品,是中國第二款獲批的CAR-T產品,除了復發/難治性大B細胞淋巴瘤,藥明巨諾公司還計劃開發瑞基奧侖賽注射液用于治療多種其它適應癥,包括濾泡淋巴瘤(FL)、套細胞淋巴瘤(MCL)、慢性淋巴細胞白血病(CLL)、二線彌漫性大B細胞淋巴瘤(DLBCL)及急性淋巴細胞白血病(ALL)等。
(13)CARVYKTI
公司:傳奇生物首款獲批上市的產品。
上市時間:2022年2月獲FDA批準上市。
適應癥:治療復發或難治性多發性骨髓瘤(R/R MM)。
備注:CARVYKTI(西達基奧侖賽,ciltacabtagene autoleucel,簡稱Cilta-cel)是一款具有兩種靶向B細胞成熟抗原(BCMA)單域抗體的CAR-T細胞免疫基因療法,數據顯示,CARVYKTI在既往接受過四種或者以上治療(包括蛋白酶體抑制劑、免疫調節劑和抗CD38單克隆抗體)的復發或難治性多發性骨髓瘤患者中顯示出高達98%的總緩解率。
基于病毒載體的體內基因療法
(1)Gendicine/今又生
公司:由深圳市賽百諾公司開發。
上市時間:2003年在中國獲批上市。
適應癥:用于治療頭頸部鱗狀細胞癌。
備注:重組人p53腺病毒注射液Gendicine/今又生是深圳市賽百諾公司擁有自主知識產權的腺病毒載體基因治療藥物,該藥物由正常人腫瘤抑制基因p53 和人工改造的重組復制缺陷型人5型腺病毒組成,前者是藥物發揮抗腫瘤作用的主體結構,后者主要起載體作用,腺病毒載體攜帶治療基因p53進入靶細胞內,在靶細胞內表達抑癌基因p53,其基因表達產物可上調多種抗癌基因和下調多種癌基因活性,從而增強機體抑癌作用,實現殺傷腫瘤的目的。
(2)Rigvir
公司:由拉脫維亞Latima公司開發。
上市時間:2004年在拉脫維亞獲批上市。
適應癥:用于黑色素瘤治療。
備注:Rigvir是由一種基于基因修飾的ECHO-7腸道病毒載體基因療法,目前該藥已在拉脫維亞、愛沙尼亞、波蘭、亞美尼亞、白俄羅斯等地被采用,同時也正在進行歐盟國家EMA的注冊登記。過去十幾年的臨床案例證明,Rigvir溶瘤病毒安全、有效,能提高黑色素瘤患者4-6倍的生存率,此外該療法也適用于多種其它癌癥,包括結腸直腸癌、胰腺癌、膀胱癌、腎癌、前列腺癌、肺癌、子宮癌、淋巴肉瘤等。
(3)Oncorine/安科瑞
公司:由上海三維生物公司研發。
上市時間:2005年在中國獲批上市。
適應癥:治療頭頸部腫瘤、肝癌、胰腺癌、宮頸癌等多種癌癥。
備注:Oncorine (安科瑞)是一種以腺病毒為載體的溶瘤病毒基因治療產品,該藥物是利用基因工程技術刪除人5型腺病毒E1B-55kD基因片段和E3-19KD基因片段后重新獲得的一種溶瘤腺病毒,其在p53 基因缺乏或異常的腫瘤中能夠特異性地復制,導致腫瘤細胞裂解,從而殺滅腫瘤細胞。而不損害正常細胞。臨床顯示安柯瑞對多種惡性腫瘤具有良好的安全性和有效性。
(4)Glybera
公司:由uniQure公司研發。
上市時間:2012年在歐洲獲批上市。
適應癥:治療嚴格限制脂肪飲食卻仍然發生嚴重或反復胰腺炎發作的脂蛋白脂酶缺乏癥(LPLD)。
備注:Glybera(alipogene tiparvovec)是一款基于AAV為載體的基因治療藥物,該療法以AAV作為載體,將治療基因LPL轉導入肌細胞,從而使相應的細胞能夠產生一定數量的脂蛋白脂酶,起到緩解疾病的作用,該療法,一次給藥長期(藥效可持續多年)有效。該藥物于2017年退市,其退市原因可能與定價太高、市場需求受限兩大因素有關。該藥物平均一次療法費用高達100萬美元,上市至今只有一位患者購買使用過,雖然醫療保險公司對其報銷了90萬美元,但對于保險公司而言這也是較大的負擔。此外,該藥物針對的適應癥過于罕見,發病率約為1/100萬而且誤診率較高。
(5)Imlygic
公司:由安進公司(Amgen)開發。
上市時間:2015年先后在美國和歐盟獲批上市。
適應癥:治療不能經手術完全切除的黑色素瘤病灶。
備注:Imlygic是一種經過基因過程技術改造的(刪除其ICP34.5和ICP47基因片段,同時在病毒中插入了人粒細胞巨噬細胞集落刺激因子GM-CSF基因)減毒1型單純皰疹病毒(HSV-1)溶瘤病毒,是首款FDA批準上市的溶瘤病毒基因療法。給藥方式為病灶局部注射(intralesional injection),將其直接注射到黑色素瘤病灶中可造成腫瘤細胞的破裂,并釋放出腫瘤源性抗原和GM-CSF,促進抗腫瘤免疫應答。
(6)Luxturna
公司:由羅氏旗下Spark Therapeutics公司研發。
上市時間:2017年獲FDA批準上市,之后于2018年在歐洲獲批上市。
適應癥:用于因雙拷貝RPE65基因突變所致視力喪失但保留有足夠數量的存活視網膜細胞的兒童和成人患者的治療。
備注:Luxturna是一款基于AAV的基因療法,給藥方式是視網膜下注射。該基因療法以AAV2作為載體,將正常RPE65基因的功能性拷貝導入患者視網膜細胞,使相應細胞細胞表達正常的RPE65蛋白,彌補患者RPE65蛋白缺陷,從而改善患者視力。
(7)Zolgensma
公司:由諾華公司旗下AveXis公司研發。
上市時間:2019年5月獲FDA批準上市。
適應癥:治療2歲以下脊髓性肌萎縮癥(Spinal Muscular Atrophy, SMA)患者。
備注:Zolgensma是一款基于AAV載體的基因療法,該款藥物是全球唯一一款獲批上市的脊髓性肌萎縮癥一次性治療方案,藥物的上市開啟了脊髓性肌萎縮癥治療新的一頁,是一項里程碑式的進展。此基因療法用scAAV9載體經靜脈輸注將正常SMN1基因導入患者體內,產生正常的SMN1蛋白,從而改善運動神經元等受累細胞的功能。相比之下,治療SMA的藥物Spinraza和Evrysdi則需要長期重復給藥,Spinraza每四個月通過脊柱注射給藥一次,而Evrysdi是一種需每日口服藥物。
(8)Delytact
公司:由第一三共株式會社(Daiichi Sankyo Company Limited,TYO: 4568)公司研發。
上市時間:2021年6月獲得日本厚生勞動省 (MHLW) 的有條件批準。
適應癥:用于治療惡性膠質瘤。
備注:Delytact 是全球獲批的第四款溶瘤病毒基因治療產品,也是第一個被批準用于治療惡性膠質瘤的溶瘤病毒產品。Delytact 是一種基因工程改造的單純皰疹病毒 1 型 (HSV-1)溶瘤病毒,由 Todo 博士及其同事開發。Delytact 是在第二代HSV-1的G207基因組中引入額外的缺失突變,增強其在癌細胞中選擇性復制及對抗腫瘤免疫反應的誘導,同時保持高安全性。Delytact 是目前進行臨床評估的第一個第三代溶瘤 HSV-1。Delytact 在日本的獲批主要基于一項單臂 2 期臨床試驗,在復發性膠質母細胞瘤患者中,Delytact 達到了一年生存率的主要終點,結果顯示與G207相比,Delytact表現出更強復制力和更高的抗腫瘤活性。這在乳腺癌、前列腺癌、神經鞘瘤、鼻咽癌、肝細胞癌、結腸直腸癌、惡性周圍神經鞘瘤和甲狀腺癌等實體瘤模型中均有效。
小核酸藥物
(1)Vitravene
公司:由Ionis Pharma(原Isis Pharma)和諾華聯合開發。
上市時間:1998年和1999年先后獲FDA和歐盟EMA批準上市。
適應癥:用于治療HIV陽性患者的巨細胞病毒性視網膜炎。
備注:Vitravene是一款反義寡核苷酸藥物,是全球最早獲批上市的寡核苷酸藥物。上市初期,市場對于抗巨細胞病毒藥物的需求甚為迫切;隨后由于高活性抗逆轉錄病毒療法的發展,巨細胞病毒病例數量急劇下降,因市場需求低迷,該藥物于2002年和2006年先后在歐盟國家和美國撤市。
(2)Macugen
公司:由輝瑞(Pfizer)和Eyetech共同研發。
上市時間:2004年在美國獲批上市。
適應癥:用于治療新生血管性年齡相關性黃斑變性。
備注:Macugen是一款聚乙二醇化的修飾性寡核苷酸藥物,該產品能夠靶向結合血管內皮生長因子(VEGF165亞型),給藥方式為玻璃體內注射。
(3)Defitelio
公司:由爵士制藥(Jazz)研發。
上市時間:2013年獲歐盟批準上市,2016年3獲FDA批準上市。
適應癥:用于治療肝小靜脈閉塞癥伴隨造血干細胞移植后腎或肺功能障礙。
備注:Defitelio是一款寡核苷酸藥物,為一種具有纖溶酶特性的寡核苷酸混合物。由于商業原因于2009年撤市。
(4)Kynamro
公司:由Ionis Pharma和Kastle共同開發。
上市時間:2013年作為孤兒藥在美國獲批上市。
適應癥:用于輔助治療純合子家族性高膽固醇血癥。
備注:Kynamro是一款反義寡核苷酸藥物,是一種以人類apo B-100 mRNA為靶點的反義寡核苷酸。Kynamro的給藥方式為200mg皮下注射,每周1次。
(5)Spinraza
公司:由Ionis Pharmaceuticals公司研發。
上市時間:2016年12月獲FDA批準上市。
適應癥:用于治療脊髓性肌萎縮癥(SMA)。
備注:Spinraza (nusinersen)是一款反義寡核苷酸藥物,Spinraza通過與SMN2外顯子7的剪切位點結合,能夠改變SMN2基因的RNA剪切,進而增加全功能性SMN蛋白的生產。2016年年8月,BIOGEN公司行使了選擇權獲得了Spinraza的全球權利。Spinraza在2011年才開始第一次在人體進行臨床試驗,短短5年時間,到2016年就獲得FDA批準上市,體現了FDA對其療效的充分認可。該藥物于2019年4月在中國獲批上市,Spinraza在國內的整個審批周期不到6個月,距離Spinraza在美國首次獲批2年零2個月,這樣一個重磅的國外罕見病新藥在中國上市的速度已經算是很快了。這也得益于藥品審評中心在2018年11月1日發布了《關于發布第一批臨床急需境外新藥名單的通知》,列入首批40個重點加速審評的國外新藥,Spinraza位列其中。
(6)Exondys 51
公司:由AVI BioPharma公司(后改名為Sarepta Therapeutics)開發。
上市時間:2016年9月獲得FDA批準上市。
適應癥:用于治療DMD基因發生51外顯子跳躍基因突變的杜氏肌營養不良癥(DMD)。
備注:Exondys 51是一款反義寡核苷酸藥物,該反義寡核苷酸可以與DMD基因的pre-mRNA 51號外顯子位置結合,導致在形成成熟mRNA后,51號外顯子部分被切除,從而部分修正mRNA讀碼框,幫助患者合成一些有一定功能形式的相對正常蛋白短一點的抗肌萎縮蛋白,從而改善患者癥狀。
(7)Tegsedi
公司:由Ionis Pharmaceuticals公司開發。
上市時間:2018年7月獲歐盟批準上市。
適應癥:用于治療遺傳性轉甲狀腺素蛋白淀粉樣變性(hATTR)。
備注:Tegsedi是一款靶向轉甲狀腺素蛋白mRNA的反義寡核苷酸藥物,為全球首個獲批治療hATTR的藥物,給藥方式為皮下注射。該藥物通過靶向轉甲狀腺素蛋白(ATTR)的mRNA,降低ATTR蛋白的產生,在治療ATTR方面具有良好的效益風險比,患者神經病變和生活質量方面獲得實質性改善,并與TTR突變類型、疾病分期或心肌病存在均無關。
(8)Onpattro
公司:由Alnylam公司和Sanofi公司共同開發。
上市時間:2018年在美國獲批上市。
適應癥:用于治療遺傳性轉甲狀腺素蛋白淀粉樣變性(hATTR)。
備注:Onpattro是一款靶向轉甲狀腺素蛋白mRNA的siRNA藥物,該藥物通過靶向轉甲狀腺素蛋白(ATTR)的mRNA,降低肝臟中ATTR蛋白的產生,減少周圍神經中淀粉樣沉積物的積累,進而改善和緩解疾病癥狀。
(9)Givlaari
公司:由Alnylam公司研發。
上市時間:2019年11月獲FDA批準上市。
適應癥:用于治療成人急性肝卟啉癥(acute hepatic porpyria,AHP)。
備注:Givlaari是一款siRNA藥物,是繼Onpattro之后,第二款獲批上市的siRNA藥物。給藥方式為皮下注射,該藥物靶向降解ALAS1蛋白的mRNA,每月接受Givlaari治療能夠顯著持久地降低肝臟中ALAS1的水平,從而將具有神經毒性的ALA和PBG的水平降低到正常范圍,從而緩解患者的疾病癥狀。數據顯示,與安慰劑組相比,接受Givlaari治療的患者疾病發作次數降低74%。
(10)Vyondys53
公司:由Sarepta Therapeutics公司開發。
上市時間:2019年12月獲FDA批準上市。
適應癥:用于抗肌萎縮蛋白基因外顯子53剪切突變的DMD患者的治療。
備注:Vyondys 53是一款反義寡核苷酸藥物,該寡核苷酸藥物靶向抗肌萎縮蛋白mRNA前體的剪接過程,在抗肌萎縮蛋白mRNA前體間接過程中,將其中的外顯子53部分剪切掉,即不出現在成熟的mRNA上,旨在產出截短但仍具有功能的抗肌萎縮蛋白,從而改善患者運動能力。
(11)Waylivra
公司:由Ionis Pharmaceuticals公司及其子公司Akcea Therapeutics研發。
上市時間:2019年5月獲歐洲藥物管理局(EMA)批準上市。
適應癥:作為家族性乳糜微粒血癥綜合征(FCS)成年患者控制飲食之外的輔助療法。
備注:Waylivra是的一款反義寡核苷酸藥物,此藥是全球首個獲批上市用于治療FCS的藥物。
(12)Leqvio
公司:由諾華(Novartis)公司開發。
上市時間:2020年12月獲歐盟批準上市。
適應癥:用于治療成人原發性高膽固醇血癥(雜合子家族性和非家族性)或混合型血脂異常。
備注:Leqvio是的一款靶向PCSK9 mRNA的siRNA藥物,是全球首款降膽固醇(LDL-C)的siRNA療法,給藥方式為皮下注射。該藥物通過RNA干擾作用,降低PCSK9蛋白水平,進而降低LDL-C水平。臨床數據顯示,對于使用最大耐受劑量的他汀類藥物治療后仍無法使LDL-C水平下降至達標水平的患者,Leqvio可使LDL-C下降約50%。
(13)Oxlumo
公司:由Alnylam制藥公司開發。
上市時間:2020年11月獲歐盟批準上市。
適應癥:用于治療原發性高草酸尿癥1型(PH1)。
備注:Oxlumo是一款靶向羥基酸氧化酶1(HAO1)mRNA的siRNA藥物,給藥方式為皮下注射。該藥物采用了Alnylam公司最新的增強穩定化學ESC-GalNAc共軛技術開發,該技術可使皮下給藥的siRNA具有更強的持久性和藥效。該藥物通過靶向降解或抑制羥基酸氧化酶1(HAO1)mRNA,降低肝臟中乙醇酸氧化酶的水平,進而消耗生成草酸所需的基質,減少草酸生成來控制患者疾病進展,改善疾病癥狀。
(14)Viltepso
公司:由日本新藥株式會社(Nippon Shinyaku)子公司NS Pharma開發。
上市時間:2020年8月獲FDA批準上市。
適應癥:用于治療DMD基因發生53外顯子跳躍基因突變的杜氏肌營養不良癥(DMD)。
備注:Viltepso是一款磷酰二胺嗎啉代寡聚核苷酸藥物,該寡核苷酸藥物可以與DMD基因的pre-mRNA 53號外顯子位置結合,導致在形成成熟mRNA后,53號外顯子部分被切除,從而部分修正mRNA讀碼框,幫助患者合成一些有一定功能形式的相對正常蛋白短一點的抗肌萎縮蛋白,從而改善患者癥狀。
其它基因治療藥物
(1)Rexin-G
公司:由Epeius生物技術公司研發。
上市時間:2005年獲菲律賓食品與藥品管理局(BFAD)批準上市。
適應癥:用于治療對化療產生抵抗的晚期癌癥。
備注:Rexin-G是一種載基因的納米顆粒注射劑,通過逆轉錄病毒載體向靶細胞引入細胞周期蛋白G1突變基因,特異地殺死實體瘤,給藥方式為靜脈輸注。作為主動尋找并摧毀轉移性癌細胞的腫瘤靶向藥物,對包括靶向生物制劑藥在內的其它癌癥藥品無效的患者具有一定的療效。
(2)Neovasculgen
公司:由Human stem cells institute公司研發。
上市時間:2011年12月7日在俄羅斯獲批上市,此后于2013年在烏克蘭上市。
適應癥:用于治療周邊血管動脈疾病,包括重度肢體缺血。
備注:Neovasculgen是一種基于DNA質粒的基因療法,將血管內皮生長因子(VEGF)165基因構建于質粒骨架上,輸注給患者。
(3)Collategene
公司:由大阪大學和風投公司共同研發。
上市時間:2019年8月獲日本厚生勞動省批準上市。
適應癥:治療重癥下肢缺血。
備注:Collategene是一款的基于質粒的基因療法,此基因治療藥物AnGes公司生產的首個日本本土基因治療藥物。此藥的主要成分是含人體肝細胞生長因子(HGF)基因序列的裸露質粒,若注射該藥物到下肢肌肉,表達的HGF會促進閉塞的血管周圍形成新的血管。臨床試驗證實了其改善潰瘍的效果。
文章來源:細胞與基因治療領域