種質資源研究技術方案—種子萌發率高通量檢測與活力評估
種子活力是種子發芽和出苗率、幼苗生長的潛勢、植株抗逆能力和生產潛力的總和(發芽和出苗期間的活性水平與行為),是種子品質的重要指標,具體包括吸漲后旺盛的代謝強度、出苗能力、抗逆性、發芽速度及同步性、幼苗發育與產量潛力。
種子萌發實驗無疑是最為直接有效的種子活力檢測方法。但一般的傳統方法需要人工計數來測量幼苗和計算發芽率,工作量極大,也非常耗時。而基于彩色圖像分析來識別發芽幼苗又存在很大誤差。
同時,傳統的萌發幼苗形態數據如胚根、胚軸長度等很大程度上只能作為基礎數據使用,難以直接評估幼苗生長的潛勢、植株抗逆能力和生產潛力。因此,基于現代植物表型組學研究和種子活力評估要求,在種子萌發實驗中還需要實時監測各種表型數據,而不僅僅是傳統表型所說的形態數據。
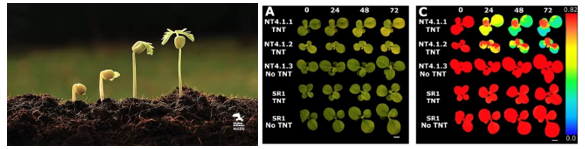
赫爾辛基大學的研究人員為了研究一種新的ABA響應泛素E3連接酶對擬南芥種子萌發活力的影響,設計了一個基于高通量葉綠素熒光成像分析的萌發實驗。這一實驗主要通過赫爾辛基大學國家植物表型研究設施(National Plant Phenotyping Infrastructure,NaPPI)中裝備的PlantScreen植物表型成像分析系統完成的。

赫爾辛基大學裝備的兩套PlantScreen植物表型成像分析系統:
一套適用于50cm以下的小型植株,如擬南芥或作物幼苗等(上圖);
一套適用于120cm以下的大型植株,如小麥、玉米等(下圖)
PlantScreen植物表型成像分析系統可以自動對植物樣品進行連續培養和表型監測,非常適用于進行高通量的種子萌發實驗。其配備的LED光照控溫培養室能夠模擬理想的光照與溫度條件。自動傳送系統可以按設置的序列自動讓樣品傳送到成像室。
種子萌發率檢測則是基于FluorCam葉綠素熒光成像技術。在種子未萌發時,子葉沒有展開,也沒有合成葉綠素,因此幾乎不會被激發出葉綠素熒光。而一旦種子萌發,甚至在子葉沒有展開時,系統內置的FluorCam葉綠素熒光成像模塊就可以檢測到種子的葉綠素熒光。測量得到的最大葉綠素熒光Fm能夠非常有效地識別發芽的種子。專用的分析軟件能夠很容易地將未萌發種子和背景去除掉,從而使發芽率計算極為準確。

高通量葉綠素熒光成像分析工作流程;
a.播種、放置樣品、成像測量、圖像分析;b.最大葉綠素熒光Fm成像圖的分析過程
葉綠素熒光成像分析后除了能獲得準確的動態發芽率曲線,還可以同時獲得一系列與植物光合能力、抗性相關的表型動態曲線,如葉綠素熒光參數、冠層面積等。葉綠素熒光參數,例如QY_max最大光化學效率(Fv/Fm,對各種脅迫極為敏感)、Effective QY實際光化學效率(量子產額)、NPQ非光化學淬滅(與光系統熱耗散、光保護機制有關)、Rfd熒光衰減比率等可以反映植物光合能力和光系統抗逆能力。PlantScreen配備的熱成像單元還可以提供冠層和葉片溫度數據,反映植物蒸騰、水分利用狀態以及病害等脅迫信息。這些指標已經廣泛用于幼苗生長潛勢、植株抗逆能力和生產潛力的評估,并得到了大量的驗證。
同時熱成像模塊還測量了發芽幼苗的冠層溫度,這與幼苗的蒸騰速率、水分利用能力密切相關。
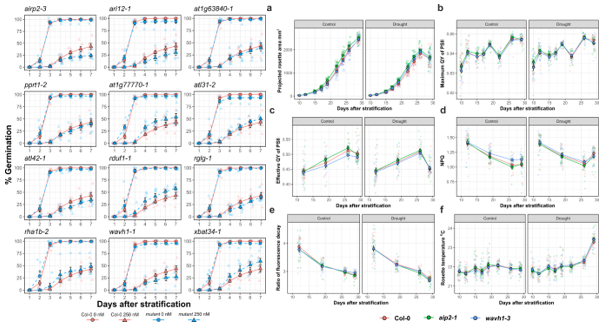
左:發芽率動態曲線;
右:冠層投影面積、各項葉綠素熒光參數、冠層溫度的動態曲線
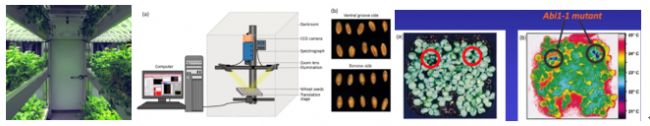
因為各種原因,無法使用PlantScreen植物表型成像分析系統進行種子萌發活力實驗的科學家,也可以選擇PhenoTron作物種質資源監測鑒定平臺。這一平臺包括LED光照培養箱、FluorCam葉綠素熒光成像、種子形態分析、種子代謝強度測量、高光譜成像、熱成像等儀器系統,可根據具體研究需要靈活組合、定制設計。
參考文獻:
Pavicic M, et al. 2019. High throughput in vitro seed germination screen identifed new ABA responsive RING‑type ubiquitin E3 ligases in Arabidopsis thaliana. Plant Cell, Tissue and Organ Culture 139: 563-575





