AlphaFold(AF) 不能替代基于實(shí)驗(yàn)的蛋白質(zhì)結(jié)構(gòu)解析的原因分析
文章原創(chuàng): 豬豬俠愛科學(xué) 文章來源:蛋白動(dòng)態(tài)
AlphaFold (AF) 預(yù)測(cè)的很多蛋白結(jié)構(gòu)已達(dá)到甚至有些超過實(shí)驗(yàn)精度,但AF還遠(yuǎn)遠(yuǎn)不能取代實(shí)驗(yàn)對(duì)所有蛋白質(zhì)結(jié)構(gòu)進(jìn)行精準(zhǔn)預(yù)測(cè)。常見的原因如下:
1. 有的天然無序蛋白在溶液中不存在單一的穩(wěn)定的結(jié)構(gòu)狀態(tài),而AF預(yù)測(cè)其有結(jié)構(gòu)(一般為結(jié)合底物后的結(jié)構(gòu)),出現(xiàn)“假陽性”結(jié)果,如突觸核蛋白(α-synuclein);
2. AF無法預(yù)測(cè)點(diǎn)突變?nèi)缗c疾病相關(guān)的突變體以及翻譯后修飾對(duì)蛋白造成的結(jié)構(gòu)擾動(dòng);
3. AF無法預(yù)測(cè)周圍環(huán)境因素如膜環(huán)境對(duì)蛋白可能造成的結(jié)構(gòu)影響,因此不能準(zhǔn)確預(yù)測(cè)一些膜蛋白的結(jié)構(gòu);
4. AF無法預(yù)測(cè)蛋白結(jié)合底物后的構(gòu)象變化;
5. AF無法預(yù)測(cè)蛋白質(zhì)在溶液中存在的不同構(gòu)象;
6. AF預(yù)測(cè)的蛋白結(jié)構(gòu)loop區(qū)域一般準(zhǔn)確度較低;
7.最后一點(diǎn)是,即便pLDDT置信度值高于80,AF預(yù)測(cè)的結(jié)構(gòu)與實(shí)驗(yàn)的晶體結(jié)構(gòu)仍然存在差異!
8. 其他的尚未發(fā)現(xiàn)的可能影響AF預(yù)測(cè)精度的因素...
本文介紹屬于8 (即不在常見的1-7類) 的一個(gè)案例,AF無法正確預(yù)測(cè)其結(jié)構(gòu)但是給出了很高的置信度,這表明AF預(yù)測(cè)的結(jié)構(gòu)并不是100%真實(shí)的,基于實(shí)驗(yàn)的結(jié)構(gòu)解析或者驗(yàn)證仍必不可少!如下圖所示,AF2/3預(yù)測(cè)的蛋白結(jié)構(gòu)與液體核磁解析的結(jié)構(gòu)存在較大差異,其中最明顯的是N端 (1-36) 的兩個(gè)β片:
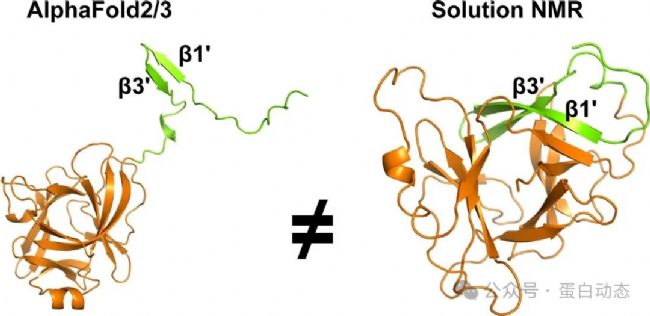
詳細(xì)的結(jié)構(gòu)差異有以下幾點(diǎn):
1.N端的pro-domain (1-36) 在AF結(jié)構(gòu)中遠(yuǎn)離蛋白核心區(qū)域而在液體核磁結(jié)構(gòu)中則是作為其一部分,除此以外,β片的長度也不同,實(shí)驗(yàn)結(jié)構(gòu)的β片更長;
2. 除pro-domain外,其他蛋白折疊區(qū)域 (βAF和αAF) 也存在較大差異,表現(xiàn)為二級(jí)結(jié)構(gòu)的位置和長度均不一致;
3. β1和β*的位置長度和位置差異較大,二者主鏈RMSD為13.3 Å,值得注意的是,此區(qū)域?yàn)榻Y(jié)合底物蛋白caspase-1/4的區(qū)域之一。具體見下圖:

雖然AF預(yù)測(cè)的IL-18前體蛋白與實(shí)驗(yàn)結(jié)構(gòu)差異較大,作者發(fā)現(xiàn)AF預(yù)測(cè)的結(jié)構(gòu)與成熟的IL-18 (即1-36被caspase-1/4切割后) 的構(gòu)象吻合得非常好,二者RMSD僅為0.2Å:
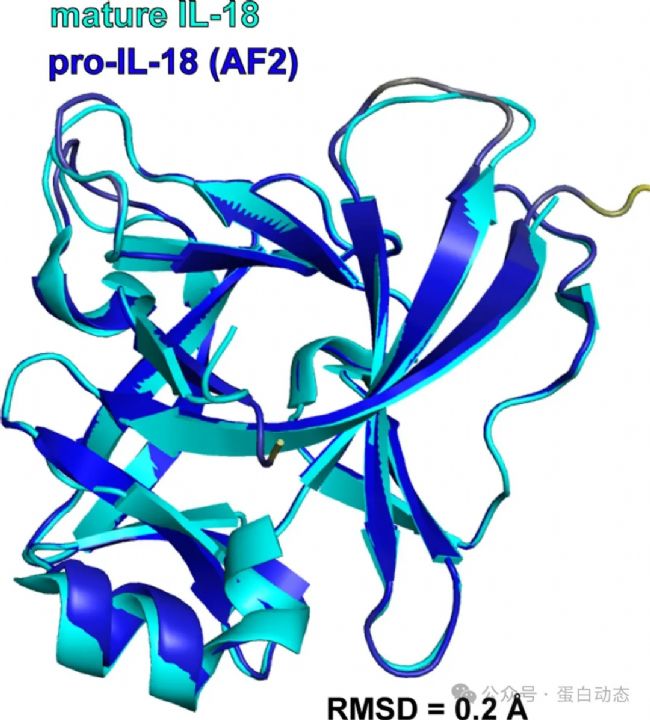
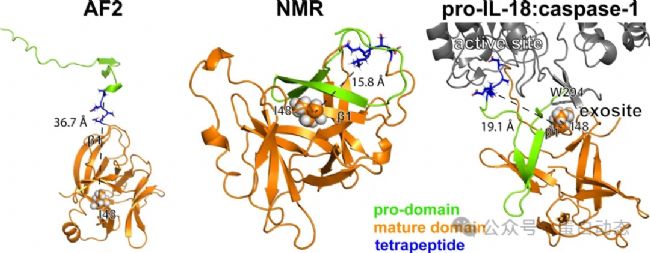
通過比較IL-18前體蛋白與caspase-1的復(fù)合物結(jié)構(gòu),作者發(fā)現(xiàn)液體核磁結(jié)構(gòu)可以更好地結(jié)合caspase-1從而被其切割為成熟體,而AF預(yù)測(cè)的結(jié)構(gòu)則不利于與caspase-1的相互作用。原因有三點(diǎn):
1)caspase-1與pro-IL-18的采取一種“雙結(jié)合位點(diǎn)”的結(jié)合模式,即除活性區(qū)域 (pro-domain) 外,位于β1的Ile48與caspase-1中 294位的色氨酸存在相互作用。在AF2預(yù)測(cè)結(jié)構(gòu)中,二者距離較遠(yuǎn)不利于同時(shí)與caspase-1發(fā)生相互作用,因此可能影響與caspase-1的結(jié)合;
2)AF2預(yù)測(cè)的結(jié)構(gòu)中,pro-IL-18的切割位點(diǎn) (33-LESD-36) 處臨近β1,而在實(shí)驗(yàn)結(jié)構(gòu)中它位于一段柔性較高的無結(jié)構(gòu)區(qū)域而更利于被caspase-1處理;
3)AF2預(yù)測(cè)結(jié)構(gòu)中,單獨(dú)的、伸展的pro-domain在細(xì)胞內(nèi)更容易被其他蛋白酶非特異性切割,不利于IL-18正確地發(fā)揮生物功能:
本文提供的這個(gè)例子非常直觀地表明AF2尚不能完全替代實(shí)驗(yàn)結(jié)構(gòu),最好的方法便是結(jié)合AF2與實(shí)驗(yàn)數(shù)據(jù)更快、更準(zhǔn)確地對(duì)蛋白結(jié)構(gòu)進(jìn)行解析,這一策略將在后續(xù)詳細(xì)地介紹,也是現(xiàn)在的研究前沿和熱點(diǎn)。
參考文獻(xiàn):
1.Bonin et.al., Journal of Magnetic Resonance, 2024.
2.Terwilliger et.al., Nature Methods, 2024.
3.Agarwal et.a., Nature Chemical Biology, 2024.
- 翼和生物SNP基因分型技術(shù):揭秘基因密碼,探尋寶寶健康之路
- 促腎上腺皮質(zhì)激素釋放激素(CRH)在探索肥胖機(jī)制中的研究
- 泌尿系統(tǒng)疾病的關(guān)鍵治療靶點(diǎn)之V2R的介紹及相關(guān)實(shí)驗(yàn)
- 激光共聚焦顯微鏡助力腫瘤抑制劑研究
- 空間多組學(xué)解碼腫瘤微環(huán)境,助力加速精準(zhǔn)治療研究
- 利用單細(xì)胞轉(zhuǎn)錄組技術(shù)解析多種免疫細(xì)胞對(duì)大量細(xì)胞因子的響應(yīng)
- Emulate器官芯片助力研究藥物引起肝損傷的機(jī)制
- 骨質(zhì)疏松和甲狀旁腺功能減退關(guān)鍵靶點(diǎn)PTH1R的結(jié)構(gòu)功能及相關(guān)實(shí)驗(yàn)介紹
- 生物芯片推出"芯空一號(hào)"方案重塑空間多組學(xué)新范式
- IPHASE課堂開課啦:細(xì)菌回復(fù)突變?cè)囼?yàn)常見問題與解答
- 生物芯片與芯超生物聯(lián)合推出"芯空一號(hào)"多組學(xué)方案
- 生物醫(yī)藥檢測(cè)與試劑供應(yīng)商翼和生物向全國招募經(jīng)銷商
- 線上課程:豬腸道冠狀病毒與人體無聲的代謝斗爭(zhēng)
- 一作直播:抗性淀粉通過重塑腸道微生物群緩解肥胖
- SBC&模基生物2024年第一期類器官初級(jí)培訓(xùn)班邀請(qǐng)函
- SBC邀您參加2024空間多維組學(xué)創(chuàng)新轉(zhuǎn)化研討會(huì)





