動態RNA甲基化修飾及其在哺乳動物發育和疾病中的調控作用
在已鑒定的170多種RNA核苷酸堿基的化學修飾中,RNA甲基化是存在于幾乎所有類型RNA上的的主要表觀轉錄修飾類型,并已被證明參與RNA代謝的整個過程,包括轉錄、 pre-mRNA可變剪切和成熟、mRNA出核、mRNA降解和穩定、mRNA翻譯。由于高通量檢測技術發展以及動態調控因子和識別蛋白的鑒定,RNA甲基化修飾在調控生物體正常發育以及RNA甲基化失調時各種疾病發生和發育異常的機制已越來越清晰。中國科學院北京基因組研究所(國家生物信息中心)楊運桂研究員團隊以“Dynamic RNA methylation modifications and their regulatory role in mammalian development and diseases“為題發表綜述文章,特別關注三種RNA甲基化:N6-甲基胞嘧啶(m6A)、5-甲基胞嘧啶(m5C)和N7-甲基腺苷(m7G),總結了這三種RNA修飾與其動態組裝和去除、特定結合蛋白以及高通量檢測技術發展相關元件。為全面理解其生物學意義,還概述了這三種mRNA甲基化修飾在配子發生、胚胎發育、免疫系統發育以及疾病和腫瘤進展中的基本機制和關鍵作用的最新知識。

mRNA的分布特征和調控元件
m6A
m6A是研究最廣泛的RNA甲基化修飾類型,幾乎存在于所有類型的RNA中,包括染色質相關新生pre-mRNA(chromatin-associated nascent pre-mRNA,caRNA)、成熟mRNA和非編碼RNA(ncRNA)。約25%哺乳動物細胞mRNA含有m6A,每個轉錄本平均含有三個m6A殘基。利用LC-MS/MS技術鑒定出人類mRNA中m6A/A占比約0.4%–1.79%。m6A主要位于內部mRNA中,特別是在靠近終止密碼子和mRNA的3′UTRs區域。m6A的保守motif序列是RRACH(R=A/G,H=A/C/U)。m6A的分布特征表明m6A可能廣泛參與mRNA代謝,如可變剪切、翻譯等,從而在生理和病理過程中發揮重要作用。m6A甲基化形成由甲基轉移酶(“writers”)催化,主要由METTL3、METTL14和WTAP組成,以及其他蛋白亞基,包括ZC3H13/Hakai/Virilizer、KIAA1429(VIRMA)、RBM15/15B。METTL16也是METTL同源家族蛋白之一,催化MAT2A mRNA和U6 snRNA上的m6A形成。同時m6A甲基基團能夠被去甲基化酶(“erasers”)去除,主要包括FTO和ALKBH5家族成員。m6A修飾的RNA堿基位點被特定的結合蛋白(“readers”)識別以執行多樣的生物學功能。迄今為止已鑒定的m6A readers包括YTH結構域蛋白(YTHDC1-2、YTHDF1-3)、核異質核糖核蛋白(HNRNPC、HNRNPA2B1)、類胰島素生長因子2 mRNA結合蛋白(IGF2BP1-3)、真核起始因子3(eIF3)(表1)。
m5C
m5C是另一種常見且豐富的RNA修飾,存在于各種RNA中,包括mRNA、tRNA、rRNA和vtRNA。在人類和小鼠的mRNA中,m5C位于翻譯起始位點(TSS)的下游區域,通過LC-MS/MS檢測人類mRNA中m5C/C占比約為0.02%–0.09%。
與m6A類似,m5C修飾也由其“writers”和“erasers”動態調控。已經鑒定的幾個m5C甲基轉移酶(writers),包括NOL1/NOP2/SUN結構域家族成員(NSUN1-7)、DNA甲基轉移酶同源物(DNMT2)和特異性tRNA甲基轉移酶家族成員(TRDMT4A和TRDMT4B),其中NSUN2和NSUN6能夠催化mRNA上m5C形成。Tet家族蛋白(TET1和TET2)不僅催化DNA上5mC到5-羥甲基胞嘧啶(5hmC)的形成,還介導mRNA中m5C氧化。目前,有兩種主要類型的mRNA m5C readers蛋白,其具有特殊的RNA結合域,以決定m5C修飾RNA分子的不同命運,包括RNA和出口因子結合蛋白2(ALYREF)和Y-box結合蛋白(YBX1和YBX2)(表1)。
m7G
m7G也是一種普遍存在的RNA甲基化修飾,被發現位于真核生物的18S rRNA和tRNA變環以及microRNA(miRNA)中。此外,大多數真核mRNA在N7-鳥嘌呤的5′帽端含有m7G修飾。隨著靈敏度更高的檢測和定位技術發展,研究人員最近發現m7G修飾存在于mRNA內部區域。在人類和小鼠細胞系的去帽poly(A)+ mRNA中,m7G/G占比約為0.02%–0.05%,占相同細胞中m6A/A的5%–10%(使用LC-MS/MS)。Zhang等人(2019b)報告稱,m7G峰值主要積聚區域位于3′UTR,次要區域在5′UTR內部mRNA中。另一項報告也發現,人類和小鼠mRNA內部的m7G修飾富集在5′UTR,特別是在翻譯起始位點附近的AG富集區域。
與m6A和m5C相比,關于m7G調控因子的研究才剛剛開始。報道的m7G甲基轉移酶包括Trm8p/Trm82p復合體和酵母中的Bud23/Trm112,以及哺乳動物中相應的同源物METTL1/WDR4和WBSCR22/TRMT112,其中METTL1不僅介導tRNA上的m7G修飾,還催化mRNA內部m7G修飾。此外,RNMT和RAM復合體參與催化哺乳動物N7-鳥嘌呤5′帽端的m7G修飾的形成。最新研究報告稱,QKI(QKI15、QKI16和QKI17)是mRNA內部m7G修飾的第一個reader蛋白,它在應激條件下與G3BP1互作,抑制m7G修飾的mRNA形成應激顆粒,同時調控Hippo信號通路中關鍵基因的穩定性和翻譯效率(表1)。
檢測技術
基于Bulk RNA甲基化檢測技術
基于免疫沉淀方法
抗體和免疫沉淀的RNA甲基化檢測策略,是一種簡單、穩定且低成本的方法,傳統上被廣泛用于各種生物的表觀轉錄組特征圖譜繪制。典型的技術分為兩類:基于RNA甲基化抗體的(包括m6A/m5C/m7G-MeRIP-seq、m6A/m7G-miCLIP-seq、PA-m6A-seq和m6A-LAIC-seq)和基于甲基轉移酶抗體的(m5C-miCLIP-Seq和AZA-IPseq)。
(1) MeRIP-seq
大多數用于RNA甲基化修飾的高通量測序技術依賴于特定甲基化抗體(如m6A、m5C和m7G)。甲基化RNA免疫沉淀測序(MeRIP-seq),如m6A-MeRIP-Seq(m6A-seq)(圖1A)、m5C-MeRIP-Seq(圖2A)和m7G-MeRIP-Seq(圖3A)是常用的方法,用于鑒定mRNA中的RNA甲基化peaks。然而,MeRIP-seq存在一些缺點,如相對較低的檢測分辨率(約100-150 nt)和對低豐度RNA上的RNA甲基化位點不敏感。Molinie等人(2016年)改進的m6A-MeRIP-seq開發了m6A-LAIC-seq(m6A水平和異構體特征序列),通過調整抗體使用、涉及各種內標調控和同時進行上清液(m6A陰性部分)的NGS測序,計算m6A陽性和m6A陰性部分的RNA表達,以在全轉錄組范圍內定量m6A的化學計量學(表2)。
(2) miCLIP-seq
通過將MeRIP技術與光交聯反應結合,研究人員發明了UV誘導的抗體-RNA交聯方法來檢測轉錄組甲基化修飾,如PA-m6A-Seq(光交聯輔助m6A測序)(圖1C)、m6A-CLIP(m6A交聯免疫沉淀)(和m6A/m7G-miCLIP(m6A/m7G甲基化單堿基分辨率交聯免疫沉淀)(圖1B和3B)。m6A-CLIP和m6A/m7G-miCLIP均基于UV交聯RNA與m6A或m7G抗體在結合位點形成共價鍵,導致逆轉錄過程中的C-T位點轉換或截斷,通過此方法可以準確鑒定m6A位點并獲得單堿基分辨率甲基化圖譜(表2)。
(3) PA-m6A-seq
PA-m6A-seq(光交聯輔助m6A測序)方法依賴于4-硫尿苷(4SU,光敏感的核苷酸類似物)在細胞培養期間并入poly(A) RNA中,抗m6A免疫沉淀和UV交聯,隨后進行靶向RNA洗脫和文庫構建(圖1C)。與MeRIP-Seq或m6A-seq相比,該方法實現哺乳動物接近單堿基分辨率全轉錄組m6A圖譜(表2)。
(4) m5C-miCLIP-seq
甲基轉移酶可以催化體內特定核酸堿基位點的RNA甲基化形成。m5C甲基轉移酶NSUN2包含釋放(半胱氨酸271)和催化(半胱氨酸321)位點。m5C-miCLIP(m5C甲基化單堿基分辨率交聯和免疫沉淀)利用這一特性,通過結合細胞中外源表達的NSUN2-C271A(NSUN2上的突變釋放位點)與UV交聯免疫沉淀,其中突變蛋白NSUN2-C271A和m5C修飾位點在UV交聯下強烈結合形成共價鍵,這在RT-PCR過程中引起截斷或突變(圖2B)。因此,m5C-miCLIP也能夠以單堿基分辨率檢測m5C修飾位點(表2)。
(5) AZA-IP-seq
AZA-IP-seq(5-氮胞嘧啶介導的RNA免疫沉淀測序)是另一種基于甲基轉移酶抗體的m5C檢測方法。簡要來說,5-氮胞嘧啶(5-azaC),作為DNA甲基轉移酶抑制劑之一,可以隨機并入DNA和新生RNA中,并且也有能力與甲基轉移酶(外源和內源)結合形成共價鍵。結合5-azaC處理和特定甲基轉移酶抗體(如NSUN2)的免疫沉淀,可以以單堿基分辨率檢測m5C修飾位點(圖2A,表2)。
表1:mRNA甲基化修飾調控因子綜述
基于化學反應方法
(1) RNA-BisSeq
RNA亞硫酸鹽測序(RNA-BisSeq)是定量分析mRNA m5C甲基組的經典方法之一。它依賴于用亞硫酸鹽預處理RNA,促使未修飾的C發生化學脫氨反應并轉化為U,而甲基化的胞嘧啶(m5C)保持為C。經過RT、cDNA合成和PCR過程后,U堿基轉化為T,從而可以區分m5C和C。通過生物信息學分析,可以通過分析未轉化的胞嘧啶來鑒定m5C修飾位點,同時,通過計算未轉化胞嘧啶的覆蓋率百分比來估計m5C甲基化水平(圖2D)。總的來說,RNA-BisSeq不需要在細胞中表達外源基因或化學試劑,能夠準確捕獲細胞和組織中原始的m5C修飾狀態。RNA-BisSeq被廣泛用于探索各種RNA中m5C的表達特征,并預測其潛在功能,包括哺乳動物、斑馬魚、擬南芥和水稻。RNA-BisSeq中m5C檢測的準確性取決于亞硫酸鹽處理過程中C到U的轉化效率,這受到反應條件(如溫度、反應時間)和RNA狀態(如RNA質量、RNA二級結構等)的影響(表2)。
(2)m6A-SEAL-seq
FTO輔助的m6A選擇性化學標記測序(m6A-SEAL-seq)是一種利用FTO作為催化劑將m6A轉化為hm6A(N6-羥甲基腺苷)的化學標記方法。不穩定的hm6A將通過二硫蘇糖醇(DTT)介導的硫醇加成化學反應轉化為更穩定的dm6A(N6-二硫代肌醇甲腺苷)。然后,dm6A通過甲硫磺酸鹽(MTSEA)響應組裝生物素標簽,隨后進行鏈霉親和純化和測序(圖1D)。m6A-SEAL分辨率約為200 nt(表2)。
(3) m6A-label-seq
這種技術基于甲硫氨酸類似物Se-烯丙基硒代同型半胱氨酸作為人類和小鼠細胞的培養營養物質。這種類似物可以驅動甲基供體SAM被烯丙基團標記,通過細胞自身代謝形成Allyl-SAM或Allyl-SeAM。因此,細胞RNA能夠在假定m6A生成腺苷位點被代謝性地修飾為N6-烯丙基腺苷(a6A)。基于碘化誘導的a6A環化和在cDNA逆轉錄過程中對側位點錯配,實現全轉錄組范圍內單堿基分辨率檢測。m6A-label-seq的建立為理解m6A在分子水平上的生理作用提供了強有力的工具,并且可以應用于所有m6A motif。烯丙基團標記的效率和時間窗口對于準確鑒定m6A位點至關重要(表2)。
(4) m6A-SAC-seq
m6A選擇性烯丙基化學標記和測序(m6A-SAC-seq)是單堿基分辨率繪制全轉錄組m6A圖譜方法之一。這種方法的本質是使用Dim1/KsgA家族的二甲基轉移酶酶(MjDim1)在m6A上添加烯丙基SAM化學基團形成烯丙基6m6A,隨后在I2處理后發生環化。環化的烯丙基6m6A在逆轉錄過程中將被read為突變。根據突變reads,可以定量和分析轉錄組中m6A沉積位點(圖1F)。m6A-SAC-seq能夠覆蓋幾乎所有經典的m6A motif,并已應用于檢測HeLa、HEK293、HepG2以及造血干細胞(HSC)和單核細胞中的m6A水平。m6A-SAC-seq的初始樣本量約為30ng的poly(A)或rRNA耗盡RNA(表2)。
(5) GLORI
類似于RNA m5C的RNA-BisSeq,乙二醛和亞硝酸鹽介導的未甲基化腺苷的脫氨(GLORI)也是一種無偏倚、絕對基于化學反應的m6A定量方法。該程序包含三個連續步驟:①使用乙二醛形成可逆結構保護G(N1, N2-二羥基鳥嘌呤加合物)以避免亞硝酸鹽誘導的G脫氨;②未甲基化的A通過亞硝酸鹽催化的脫氨反應轉化為I;③通過堿性或加熱條件處理實現G的脫保護(圖1G)。GLORI的主要優勢是實現RNA中m6A定量分析,但GLORI成本高于m6A MeRIP-seq,且GLORI無法區分m6A和其他一些A修飾,如m6Am和m1A,盡管技術發明者聲稱已開發出分析流程來消除由m6Am和m1A引起的假陽性(表2)。
(6) eTAM-seq
進化的TadA輔助N6-甲基腺苷測序(eTAM-seq)是一種基于酶促脫氨反應的單堿基分辨率m6A測序方法,用于全轉錄組范圍內定量檢測m6A位點。簡要來說,使用高活性的tRNA腺苷脫氨酶TadA8.20進行脫氨反應,全局未甲基化的A轉化為I,只能與C配對并在隨后的逆轉錄、文庫構建和測序過程中被讀為G。修飾的m6A保持不變,在測序過程中仍然被讀為A。因此,通過eTAM-seq,A被讀為G,m6A被讀為A。eTAM-seq能夠在極少量RNA中(低至10個細胞的RNA)進行m6A的定量檢測,其初始RNA需求遠低于現有的m6A定量分析方法(圖1H)。
(7) TAWO-seq
TET輔助的過鎢酸鹽氧化測序(TAWO-seq)也是一種 RNA m5C單堿基分辨率測序方法,主要包含三個連續程序,包括由β-葡萄糖轉移酶(βGT)標記保護的原始hm5C,由TET酶氧化的原始m5C轉化為hm5C,以及由過鎢酸鹽介導的新生成hm5C的選擇性氧化為三羥基胸腺嘧啶(thT)(圖2E)。這項技術的最大優勢是與RNA-BisSeq相比能夠區分m5C和hm5C。
(8) m7G-seq
m7G上的正電荷對NaBH4介導的還原特別敏感。m7G-seq采用NaBH4介導的還原,在m7G位置上產生一個堿性位點,然后這些位點被生物素標記,隨后進行生物素下拉實驗。在逆轉錄過程中,RNA中的生物素標記m7G位點會導致錯配(主要是T以及其他堿基),從而實現基于這些突變的m7G甲基組的單堿基分辨率(圖3C,表2)。
基于酶切反應技術
MAZTER-seq和m6A-REF-seq(m6A敏感的RNA內切核酸酶促進的測序)是同時報道不依賴抗體的方法,用于定量m6A的化學計量分析。這兩種方法都依賴于RNA內切核酸酶MazF對ACA motif上的m6A識別,能夠在全轉錄組范圍內以單堿基分辨率檢測m6A修飾位點及其豐度。MazF在mRNA上更傾向于識別A-CA motif。由于RNA上m6A的motif是RRACH(R=A/G,H=A/C/U),大多數經過MazF酶處理后的讀段將在5'端含有ACA,因此內部的(m6A)CA基序被認定為甲基化位點(圖1I和J)。然而,這兩種方法都受限于內切核酸酶對m6A CA序列的選擇性,這使得不包含m6A CA序列的序列無法被識別(表2)。
基于RNA編輯的技術
DART-seq(脫氨基作用鄰近RNA修飾靶標測序)是一種不依賴抗體的方法,通過在哺乳動物細胞中表達外源性的APOBEC1-YTH融合蛋白來檢測全局m6A修飾位點。其中,YTH(m6A結合域)識別m6A,而連接的APOBEC1(胞嘧啶脫氨酶)直接將胞嘧啶殘基上的C編輯為U。這些編輯位點在后續的數據分析中被識別為m6A修飾區域(圖1K)。由于YTH結構域與m6A的2'-OH之間的氫鍵鍵合是關鍵結構,DART-seq中的YTH結構域無法識別m6Am。盡管DART-seq能夠從低量RNA(約10 ng總RNA)中繪制m6A位點,但需要將APOBEC1-YTH短暫轉染入哺乳動物細胞要求限制了其應用,并且可能破壞了生理狀態(表2)。
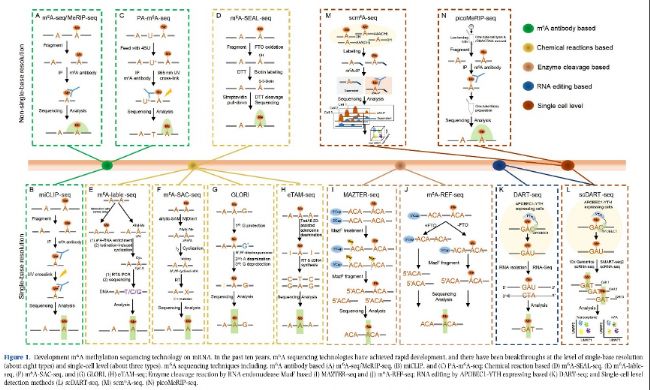
圖1:mRNA甲基化測序技術的發展。過去十年m6A測序技術取得快速發展,在單堿基分辨率(約八種類型)和單細胞水平(約三種類型)上取得了突破:包括基于m6A抗體的(A)m6A-seq/MeRIP-seq、(B)miCLIP和(C)PA-m6A-seq;基于化學反應的(D)m6A-SEAL-seq、(E)m6A-label-seq、(F)m6A-SPAC-seq和(G)GLORI、(H)eTAM-seq。
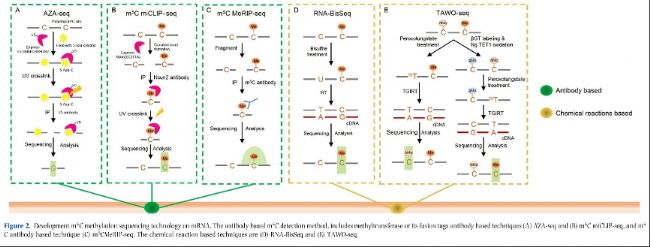
圖2:mRNA m5C甲基化測序技術。基于抗體m5C檢測方法,包括基于甲基轉移酶或其融合標簽抗體的技術(A)AZA-seq和(B)m5C miCLIP-seq,以及基于m5C抗體的方法(C)m5C MeRIP-seq。基于化學反應的技術是(D)RNA-BisSeq和(E)TAWO-seq。
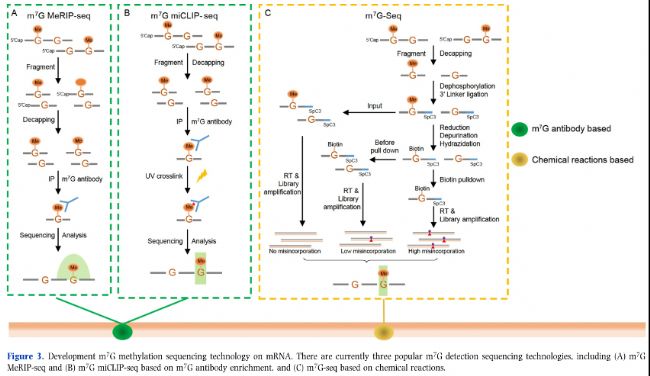 圖3:mRNA m7G甲基化測序技術。目前有三種流行的m7G檢測測序技術,包括(A)m7G MeRIP-seq和(B)基于m7G抗體富集的m7G-miCLIP-seq以及(C)基于化學反應的m7G-seq。
圖3:mRNA m7G甲基化測序技術。目前有三種流行的m7G檢測測序技術,包括(A)m7G MeRIP-seq和(B)基于m7G抗體富集的m7G-miCLIP-seq以及(C)基于化學反應的m7G-seq。

與單細胞組學圖譜相比,傳統的群體細胞測序方法使用的樣本包含成千上萬個細胞,因此只能反映群體中的平均甲基化水平。特別是,細胞表達的異質性在很大程度上被掩蓋,無法準確反映組織/器官的真實生理或病理特征。目前已經建立單細胞水平的測序技術,用于繪制轉錄組、染色質開放可及性、DNA甲基化修飾等圖譜。報道的單細胞轉錄組甲基化圖譜技術包括scDART-seq和scm6A-seq。
(1) scDART-seq
scDART-seq是在引入10X Genomics單細胞測序后從DART-seq發展而來,是首個單細胞水平的m6A檢測方法。通過應用scDART-seq,在成千上萬個單細胞中進行m6A圖譜分析,發現m6A在單細胞水平上表現出高度異質性,并且可以根據RNA甲基化特征區分細胞亞群,與基因表達水平無關。這些發現揭示以前在bulk-cell m6A分析中被忽視的m6A基本特征,并為理解m6A在不同細胞中的功能提供新見解(圖1L)。但由于scDART-seq基于外源基因表達,因此很難應用于組織樣本,也無法呈現細胞的原始狀態(表2)。
(2) scm6A-seq
通過結合RNA多重標記和MeRIP-seq/m6A-IP,scm6A-seq能夠捕獲全轉錄組范圍的m6A圖譜,并能夠在不表達任何外源基因的情況下比較單細胞中的m6A水平。它已被用于區分有核仁包圍(SN)和無核仁包圍(NSN)的卵母細胞,以單細胞分辨率繪制小鼠卵母細胞發育和合子基因組激活期間的m6A調控機制(圖1M,表2)。
(3) picoMeRIP-seq
picoMeRIP-seq也是一種基于m6A抗體的低輸入RNA/細胞或單細胞啟動的m6A圖譜方法。與scm6A-seq相比,picoMeRIP-seq不標記單細胞中的RNA,后續文庫構建直接使用商業的SMART-Seq stranded kit(TaKaRa)。在這種方法中,通過系統優化關鍵步驟提高了m6A/A富集比率,包括增加洗滌劑(SDS)和鹽(NaCl)濃度,使用低結合管和商業m6A抗體(Millipore)等(圖1N)。picoMeRIP-seq已用于在100 pg poly(A) RNA、單個斑馬魚合子、單個小鼠卵母細胞和植入前胚胎、小鼠胚胎干細胞(1,000、100和10個細胞)的全轉錄組水平上繪制m6A(表2)。
綜上所述,過去十年中RNA甲基化測序技術的快速發展使我們能夠更清晰地了解RNA甲基化修飾的分布特征和功能機制。盡管每種技術都有其自身的優勢和劣勢,但它們可以從多個維度進行補償或校正,以獲得更準確的RNA甲基化位點信息。此外,在單堿基精度和單細胞水平上取得了技術突破,這可以更精細地捕獲細胞間RNA甲基化的異質性,并建立單細胞水平的RNA甲基化調控網絡。
生物學功能
RNA過程和代謝
作為轉錄后修飾,RNA甲基化參與RNA代謝的整個過程,如pre-mRNA剪切、mRNA出核、mRNA降解或穩定性以及mRNA翻譯。
pre-mRNA剪切
pre-mRNA剪切作為基因表達轉錄后調控的第一階段,是去除pre-mRNA中內含子、有序連接外顯子以最終生成成熟mRNA的過程。pre-mRNA可變剪切是這一過程中的關鍵步驟,它可以從一個基因生成多個轉錄本,為遺傳多樣性和復雜性做出貢獻。m6A去甲基化酶(FTO和ALKBH5)和甲基轉移酶復合體(WTAP、METTL3和METTL14)定位于核斑點中,提示m6A在RNA剪切中的潛在作用。FTO優先結合內含子區域pre-mRNA,靠近可變剪切(AS)外顯子和聚腺苷酸位點,并調控可變剪切和3′UTR表達。
m6A reader蛋白hnRNPG結合到共轉錄新生的m6A修飾pre-mRNA,并通過對RNA聚合酶II的互作及其在hnRNPG調控外顯子周圍的占位影響來調控可變剪切。此外,m6A分布在圍繞5′-和3′-剪切位點的外顯子區域,并與SRSF1和SRSF2的結合簇空間重疊。在3T3-L1細胞中敲除FTO增強了m6A水平,并促進了SRSF2蛋白的RNA結合能力,該蛋白調控脂肪生成調控因子RUNX1T1的可變剪切和隨后的前脂肪細胞分化。同時,有報道稱m6A參與依賴其閱讀蛋白YTHDC1的pre-mRNA剪切,促進pre-mRNA剪切因子SRSF3(SRp20)而阻止SRSF10(SRp38)進入目標mRNA的結合區域。小鼠卵母細胞中的Ythdc1與pre-mRNA 3′端處理因子(CPSF6、SRSF3和SRSF7)互作,并以m6A依賴方式廣泛參與可變聚腺苷酸化和改變3′UTR長度。果蠅中YTH家族蛋白的同源物YT521-B介導依賴于m6A的pre-mRNA可變剪切,并調控果蠅的神經功能和性別決定。Louloupi等人報告稱,剪切位點上的m6A沉積促進快速剪切,而內含子中高m6A水平與慢可變剪切相關。有趣的是,m6A開關調控HNRNPC結合活性,其中m6A主導RNA和reader蛋白互作的RNA結構依賴性可及性,促進外顯子保守并影響目標mRNA的可變剪切。總的來說,m6A對pre-mRNA成熟過程發揮重要作用,但m5C或m7G是否也參與這一過程尚不清楚。
mRNA出核
mRNA出核是基因表達過程中的關鍵步驟,mRNA通過這一步驟被轉運到細胞質中進行翻譯。大多數mRNA出核依賴于轉錄出核復合體(TREX)和核異二聚體出核受體(NXF1-P15)通路,其中TREX復合體成員被沉積在mRNA上并將其交給NXF1。
YTHDC1通過剪切因子SRSF3和出核接頭NXF1促進含m6A的mRNA出核。研究發現多個TREX亞基(ALYREF、UAP56、THOC5、CHTOP)與m6A甲基轉移酶復合體(WTAP、METTL3、METTL14、KIAA1429)互作,調控轉錄本出核。Mettl3在細胞核中顯著增加了時鐘基因Per2和Arntl的mRNA積累,而細胞中ALKBH5缺失加速了mRNA的RNA出核。同時,HeLa細胞中YTHDC1缺失導致m6A修飾的mRNA核積聚,而在細胞質中缺失。
除了m6A,m5C也在mRNA出核中發揮關鍵作用。ALYREF不僅是m5C reader蛋白,也是調控核質穿梭的TREX亞基之一。在HeLa細胞中,ALYREF促進含m5C的mRNA出核。3T3-L1細胞中NSUN2的缺乏導致ALYREF-m5C軸介導的CDKN1A mRNA出核減少,導致細胞周期加速和促進脂肪形成。
mRNA降解和穩定性
m6A修飾參與調控mRNA代謝。在野生型mESCs中,Mettl3和Mettl14組成的甲基轉移酶復合體在標靶轉錄本上催化m6A形成,隨后阻止與mRNA穩定性相關蛋白HuR的結合,并增強microRNA靶點,導致目標轉錄本不穩定。YTHDF2是一個經典的m6A reader蛋白,它通過多種通路促進含有m6A的靶轉錄本降解。首先,Wang等人(2014a)分析了YTHDF2蛋白結構,發現YTHDF2的羧基末端域(C-YTHDF2)選擇性地識別含m6A mRNA,而氨基末端域(N-YTHDF2)負責將YTHDF2-m6A-mRNA復合體定位到更專門的mRNA降解機器(如P體等)。其次,哺乳動物細胞中的YTHDF2招募CCR4-NOT脫腺苷酸酶復合體,加速含m6A RNA的脫腺苷酸化和降解。此外,YTHDF2還與HRSP12互作,招募RNase P/MRP復合體(內切核糖核蛋白酶復合體),以切割含m6A的RNA。YTHDF2介導的m6A甲基化mRNA的降解在各種發育和疾病過程中發揮關鍵作用,如維持造血干細胞功能、在卵母細胞成熟和胚胎發生過程中母源mRNA降解、癌癥進展等。
與YTHDF2作用不同,另一個m6A reader蛋白IGF2BPs參與維持穩定性和儲存,并在正常和應激條件下影響目標m6A甲基化mRNA基因表達。IGF2BPs介導的m6A修飾mRNA的穩定性參與腫瘤形成。
m5C修飾在mRNA穩定性中也表現出類似的作用。兩項平行研究報告稱,m5C reader蛋白YBX1通過招募RNA穩定性相關蛋白(HuR或PABPC1a)影響目標mRNA穩定性,并因此參與膀胱尿路上皮癌(UCB)的腫瘤形成和轉移,以及斑馬魚胚胎發育。在小鼠Th17細胞中NSUN2缺失以m5C依賴方式導致Il17a和Il17f mRNAs的半衰期和數量減少。
翻譯
RNA甲基化已被證明可以促進或抑制翻譯過程。在細胞質中,YTHDF1富集在40S核糖體的蛋白質亞基中,并與翻譯啟動復合體的組成部分eIF3互作,從而促進m6A依賴的mRNA翻譯。
YTHDF3也與YTHDF1協同促進蛋白質合成。另一項平行研究也報告稱,YTHDF3與YTHDF1合作,通過在翻譯過程中順序招募翻譯效應物(40S和60S核糖體亞基)來促進m6A修飾目標mRNA的翻譯效率。總體而言,YTHDF1和YTHDF3通過與YTHDF1/YTHDF3鏈接,在轉錄本m6A修飾的3'端和40S和60S亞基的翻譯效應物的5'端之間形成loop,調控翻譯啟動。最近的報告還說明了幾條分子通路參與YTHDF1或YTHDF3介導的m6A修飾轉錄本的翻譯過程。Zou等人(2023年)報告稱,YTHDF1與核糖體蛋白結合以促進其目標mRNA翻譯,但FMRP通過阻礙YTHDF1與核糖體蛋白的結合來抑制神經翻譯。然而在神經刺激下,FMRP被磷酸化并釋放YTHDF1,以提高m6A甲基化mRNA翻譯效率,從而促進神經去極化。同時,Chen等人(2023年)已經證明YTHDF1和YTHDF3(不是YTHDF2)攜帶高水平的營養感應O-GlcNAc修飾,O-GlcNAcylation通過抑制它們與mRNA翻譯相關蛋白互作,抑制YTHDF1和YTHDF3的翻譯促進功能,導致m6A甲基化mRNA翻譯抑制。Chen等人(2023年)還建議不同的細胞在YTHDF1/3上表現出不同的O-GlcNAc修飾水平,這可能是先前研究對YTHDF1/3是否促進m6A RNA翻譯功能得出不同結論的原因之一。此外,當m6A位于5'UTR時,它可以通過被43S復合體組分eIF3識別,在細胞應激下促進帽的單獨翻譯。另一個reader蛋白YTHDC2也以m6A依賴方式增強其靶標翻譯效率。盡管如此,Choi等人(2016年)證明,轉錄本中m6A修飾密碼子通過破壞轉錄本上tRNA的選擇導致翻譯延伸動態更慢和翻譯效率更低。此外,Lin等人(2016年)發現METTL3,而不依賴其m6A催化活性,通過招募eIF3到翻譯啟動復合體,增強包括重要的癌基因如EGFR和TAZ在內的目標mRNA翻譯,導致人類肺癌細胞的生長、存活和侵襲得到促進。
m5C廣泛分布在rRNA和tRNA變區和反密碼loop上,通過調控tRNA穩定性和密碼子識別、翻譯保真度和準確性或全局蛋白質合成等參與翻譯調控。mRNA上的m5C也參與調控翻譯效率,在3T3-L1細胞中,NSUN2以m5C依賴的方式促進CDKN1A mRNA的翻譯效率。在大鼠的T淋巴細胞中,NSun2介導的m5C修飾在高同型半胱氨酸血癥誘導下促進IL-17A mRNA的翻譯。此外,NSUN6特異性m5C位點富集在3'UTR中的CTCCA motif上,與翻譯終止保真相關。然而,Tang等人(2015年)報告稱NSun2通過在p27 mRNA的5'UTR上的胞嘧啶C64上甲基化,抑制p27翻譯,表明mRNA上m5C位點可能決定其對翻譯效率的調控效應。
真核mRNA的5'帽上m7G已被證明參與翻譯調控。最近的研究還表明,mRNA內部的m7G修飾在mRNA翻譯通路中起作用。METTL1組裝的內部m7G修飾能夠促進m7G修飾轉錄本翻譯效率,而不依賴于其對全局翻譯和tRNA甲基化的影響。內部m7G在人類mRNA沿的表現顯示在翻譯起始位點保守富集,而在H2O2或熱休克處理下在CDS和3'UTR區域顯著積累,促進mRNA翻譯效率。此外,METTL1介導的m7G甲基化增強VEGFA mRNA翻譯,促進人臍靜脈內皮細胞(HUVECs)的血管生成。
綜上所述,RNA甲基化修飾在包括pre-RNA處理、mRNA代謝和翻譯在內的整個mRNA表達過程中發揮重要作用,凸顯其生物學意義。Li等人(2017c)證明METTL3/METTL14介導的m6A和NSUN2介導的m5C甲基化在p21 3'UTR中協同增強p21翻譯,在氧化應激誘導的細胞衰老中導致p21表達升高,表明多種RNA甲基化修飾可能協同調控同一生物學事件。然而,仍然需要揭示這些修飾單獨或協同調控mRNA表達過程的更多調控機制,這將有助于描繪多種RNA甲基化的調控網絡。
哺乳動物發育
配子發生
一系列最新研究表明,RNA甲基化表觀轉錄組在精子發生和卵子發生中扮演著至關重要的角色。Guo等人(2022年)通過LC-MS/MS分析發現,多種RNA修飾(如m5C、m3C、m7G、m2G、m22G、m1G和m1A)分布在人類精子的RNA中,這些修飾在弱精子癥(AZS)和畸精子癥(TZS)組中的水平顯著高于正常精子癥(NZS)組,特別是在TZS組中m5C和m6A的水平更高。在精子發生過程中,m6A作為一個重要的調控因子,參與哺乳動物精原細胞的有絲分裂、減數分裂和精子形成。Mettl3介導的m6A調控精原干細胞(SSCs)的增殖和分化,并影響減數分裂的啟動。在雄性生殖細胞中敲除METTL3或METTL14會導致睪丸組織中SSCs快速耗竭甚至完全缺失。人類精子中METTL3上調導致m6A水平增加,進而增強精子運動能力,這是弱精子癥的一個風險因素。此外,小鼠支持細胞特異性敲除Wtap會損害SSCs的自我更新和增殖能力,最終導致不育,通過干擾Wtap介導的m6A修飾基因的可變剪切。此外,ALKBH5介導的小鼠精原細胞和圓形精子細胞核中的m6A參與正確剪切和較長3'UTR mRNAs生成,這是精子發生的晚期減數分裂和單倍體階段所必需的。敲除FTO會導致GC-1精原細胞系的染色體不穩定和G2/M階段轉換抑制。在小鼠中,Ythdc2在雄性或雌性生殖細胞中敲除導致異常的配子減數分裂,導致不育和睪丸及卵巢體積減小。同時,小鼠減數分裂細胞中條件性敲除Ythdc2導致轉錄組嚴重失調,包括編碼微管網絡蛋白的轉錄本,并導致減數分裂細胞和精原細胞在晚期減數分裂階段的端粒聚集和凋亡。成年雄性小鼠Ythdc1缺陷導致缺乏任何生殖細胞,包括有絲分裂精原細胞,并表現出僅支持細胞的表型。在小鼠精原細胞中敲除Ythdf2通過m6A/mRNA降解通路下調基質金屬蛋白酶表達,并影響細胞粘附和精原細胞增殖。此外,敲除m5C甲基轉移酶NSun2對精原干細胞和支持細胞沒有影響,但抑制了生殖細胞進入減數分裂的減數分裂階段。
在卵子發生過程中,METTL3介導的m6A通過促進母源mRNA翻譯效率對小鼠卵母細胞成熟是必需的。在卵母細胞的生殖泡(GV)階段敲低Mettl3嚴重抑制卵母細胞的減數分裂成熟。同時,Yao等人(2023年)證明METTL3催化的m6A沉積促進了GV期卵母細胞中m6A修飾RNA降解。然而,Mu等人(2021年)報告稱METTL3靶向Itsn2進行m6A修飾,隨后增強其在GV階段的穩定性,以促進卵母細胞發育過程中減數分裂的恢復。此外,母源YTHDF2負責以m6A依賴方式指導適當的母源轉錄本劑量,從而決定哺乳動物卵母細胞質量和雌性生育能力。卵母細胞中Ythdc1缺陷導致m6A依賴的可變剪切缺陷,導致卵母細胞成熟停滯和雌性不孕。在卵母細胞中特異性敲除KIAA1429導致GV期卵母細胞中m6A修飾RNA的異常代謝,導致GV卵母細胞無法進行生殖泡破裂(GVBD)和隨后失去恢復減數分裂能力。此外,卵巢中Nsun5缺失導致m5C在mRNA外顯子和3'UTR區域的時間依賴性下降,影響減數分裂阻滯缺陷2樣2(MAD2L2)的mRNA穩定性、生長分化因子9(GDF9)的翻譯效率、以及Brd8外顯子區域的異常可變剪切,導致卵泡發育和卵巢功能障礙。有趣的是,NSUN2在人類和小鼠MI/MII期卵母細胞的細胞質中表達,可能促進NSUN2蛋白與母源mRNAs互作,并催化m5C形成。卵母細胞中m5C修飾轉錄本的逐漸增加和沉積可能在早期胚胎發生中起作用。
早期胚胎發育
RNA甲基化修飾在胚胎發育中發揮重要作用。在體外,小鼠GV期卵母細胞中METTL3缺失會阻礙受精后胚胎發育中的母系到合子轉變(MZT)和合子基因組激活,可能是通過破壞母源mRNA降解。小鼠胚胎4細胞階段的轉錄因子mRNA上,如Cdx2、Nanog、Sox2和Pou5f1的m6A修飾,可能參與調控合子基因激活(ZGA)過程。m6A reader蛋白YTHDF2在母源上是必需的,對于卵母細胞的能力和早期MZT過程,具有清除m6A修飾的母源mRNA作用。由METTL3依賴的m6A甲基化調控的HnRNPA2/B1在著床前胚胎發育期間在核和細胞質中表達,其功能缺陷會延緩4細胞階段后的胚胎發育,并通過對胚泡中多能性的調控影響內細胞團(ICM)的形成。斑馬魚胚胎發生中的m5C reader蛋白YBX1招募Pabpc1a來維持m5C修飾的母源mRNA穩定性,促進有序的MZT過程。
對于小鼠胚胎干細胞(mESC),Wang等人報告稱m6A甲基化對于維持mESC在其基礎狀態至關重要,Mettl3或Mettl14缺失會導致mESC失去自我更新能力,這是由于HuR-microRNA和m6A介導的RNA穩定性通路功能障礙。Zc3h13靶向核中的WTAP、Virilizer和Hakai的成分復合體上,催化m6A形成,然后促進mESC自我更新。Batista等人(2014年)證明小鼠和人類ESC中Mettl3缺失降低了m6A修飾水平,延長分化時Nanog表達,導致促進mESC自我更新和抑制mESC分化。此外,Mettl3介導的m6A甲基化維持多能性因子保真和及時下調,調控小鼠原始多能性解決過程中適當的譜系啟動和分化。Mettl14介導的m6A調控mRNA表達和可變剪切,并進一步轉換為原始多能性到啟動多能性和外胚層分化的小鼠胚胎。更重要的是,METTL14缺失在E6.5和E7.5(胚胎日)導致嚴重的生長遲緩和異常形態。
免疫系統發育
免疫細胞起源于造血干細胞(HSCs)分化,其命運對整個免疫系統至關重要。越來越多的證據支持RNA甲基化從多個角度調控HSCs。斑馬魚胚胎中Mettl3缺失抑制了最早的HSPCs生成,通過破壞YTHDF2介導的動脈內皮基因 notch1a 和 rhoca 的m6A依賴性mRNA衰變。與斑馬魚中的功能一致,Mettl3-m6A-YTHDF2-Notch軸通路在小鼠HSPCs生成和明確的造血中也顯示出不可或缺和保守的功能。小鼠中階段特異性的Mettl3缺失導致HSCs積累,并因未能通過METTL3介導的m6A甲基化上調MYC表達而阻止HSC分化。Cheng等人(2019b)還證明m6A通過調控MYC mRNA穩定性維持HSC對稱。同時METTL14在正常髓系造血過程中表達下調,并通過正向調控MYB和MYC mRNA穩定性和翻譯,基于m6A方式促進HSPCs向髓系細胞分化。Ythdf2缺失通過促進與干細胞自我更新相關的轉錄因子m6A介導的mRNA穩定性,促進HSPCs和人類臍帶血(hUCB)HSCs擴增。Mapperley等人(2021年)還報告稱,造血特異性Ythdf2缺失導致m6A修飾和炎癥反應相關轉錄本上調,并激活促炎通路,導致淋巴潛能喪失,隨后髓系偏向和HSC擴增。并且老化的Ythdf2缺失HSCs導致多系造血重建失敗。
RNA甲基化通過調控免疫相關基因的轉錄本代謝參與先天免疫。在巨噬細胞中,SOCS1作為SOCS家族蛋白之一,參與巨噬細胞激活的負反饋回路,通過促進目標信號蛋白的多泛素化和蛋白酶體降解,以防止壓倒性的全身炎癥,其在巨噬細胞中對感染的響應依賴于METTL14-m6A-YTHDF1軸。METTL3缺失導致m6A介導的mRNA穩定性和Irakm高表達,最終抑制TLR(Toll樣受體)信號介導的巨噬細胞激活。樹突狀細胞(DCs)作為連接先天和適應性免疫反應的專業抗原呈遞細胞(APCs),對啟動適應性免疫反應、消除入侵病原體和維持免疫穩態至關重要。Mettl3催化的mRNA m6A甲基化增強了CD40、CD80和TLR4信號接頭Tirap翻譯,并促進DC激活和TLR4/NF-κB信號誘導的細胞因子產生。此外,NK細胞中的Ythdf2對IL-15/STAT5信號介導的NK細胞存活、增殖和效應功能是必需的,促進NK細胞的抗腫瘤和抗病毒免疫活性。小鼠腫瘤模型中Mettl3缺失下調m6A甲基化基因SHP-2表達,可能導致NK細胞對IL-15刺激應答降低,并抑制NK細胞在腫瘤微環境中的浸潤和功能。
除了先天免疫,RNA甲基化還參與調控適應性免疫反應。Mettl3介導SOCS家族蛋白SOCS1、SOCS3和CISH的m6A形成及其隨后的降解,降低了SOCS家族活性,從而促進IL-7介導的STAT5激活和naïve T細胞的穩態增殖和分化。在Tregs中敲除Mettl3/m6A增加了Socs mRNA表達,從而抑制IL-2-STAT5信號通路,維持Tregs抑制功能。Th17細胞敲除METTL3可以促進SOCS3 mRNA穩定性,從而抑制IL-17A和CCR5表達,破壞Th17細胞分化和浸潤。METTL3介導的m6A穩定Tcf7轉錄本,允許正常產生TCF-1蛋白及其調控的T濾泡輔助(Tfh)細胞調控因子,促進了Tfh細胞分化、增殖和功能成熟。T細胞特異性敲除ALKBH5增強了CD4+ T細胞中m6A修飾水平,并下調Cxcl2和Ifng的mRNA穩定性和蛋白表達,導致CD4+ T細胞功能和中性粒細胞招募在自身免疫期間受到抑制。
與m6A相比,關于其他RNA甲基化修飾在免疫細胞中的功能機制的研究相對較少。在高同型半胱氨酸血癥(HHcy)誘導的大鼠慢性炎癥疾病模型中,NSun2通過催化m5C形成及其在T淋巴細胞中促進翻譯來介導IL-17A表達上調。Yang等人(2023年)還發現NSun2特別與Th17細胞轉錄因子RoRγt結合,催化其靶標上的RNA m5C形成,包括Il17a和Il17f,從而增強其mRNA穩定性。小鼠CD4+ T細胞中Nsun2缺失特別抑制了Th17細胞分化,并緩解Th17細胞誘導的結腸炎發病機制。在系統性紅斑狼瘡(SLE)患者的CD4+ T細胞中,Nsun2表達和m5C修飾水平下調,高甲基化m5C轉錄本主要參與mRNA剪切、穩定和翻譯的細胞因子相關信號通路,而低甲基化m5C轉錄本主要參與翻譯延伸。
總的來說,RNA甲基化修飾廣泛參與生物體的發育過程,并在配子發生、胚胎發生以及胚胎后神經和免疫系統發育等多個功能通路中發揮關鍵作用。目前,m6A在發育研究中的關注度比其他修飾更多。隨著檢測技術的進步和各種RNA甲基化調控因子的鑒定,其他甲基化修飾在發育中的功能分析也可能變得有價值。
癌癥
目前,已有數百項研究證明RNA甲基化通過直接作用或其調控元件參與包括癌癥在內的多種疾病發生和發展的調控。以下僅總結一些最新的(過去五年)和尖端的關于腫瘤發生中RNA甲基化修飾的研究。越來越多的證據表明m6A失調驅動異常的轉錄和翻譯程序,并隨后促進疾病或腫瘤的發生和進展,如白血病、肝細胞癌(HCC)、肺癌(LC)、結直腸癌(CRC)、乳腺癌、膀胱癌(BC)、胰腺癌(PC)、胃癌(GC)、膠質母細胞瘤。m6A在癌細胞代謝中發揮重要作用,包括通過調控代謝相關通路,如mTOR、PTEN、MAPK、NF-κB、Wnt信號通路等,或轉錄因子,如HIF-1、FOXM1、cMyc、YAP。m6A還參與重塑各種腫瘤免疫,通過調控免疫細胞的生存或功能,包括B細胞、CD8+ T細胞、CD4+ T細胞、PD-1+ T細胞、Treg細胞、NK細胞、DC細胞、巨噬細胞、中性粒細胞、嗜酸性粒細胞和CD4+記憶激活T細胞的浸潤,以及免疫相關細胞因子的表達,如FN-γ、CXCL9和CXCL10。總體而言,m6A影響腫瘤發生和轉移、代謝、免疫逃逸,在診斷和治療方面具有潛在價值。
m5C調控因子,如NSUN2的甲基轉移酶和YBX1的reader蛋白,在腫瘤組織中高表達。m5Cs在腫瘤組織中也經常出現高甲基化,并在致癌通路中富集。NSUN2和YBX1在UCB中靶向HDGF基因3'UTR的m5C,調控HDGF mRNA穩定性并促進UCB發病機制。丙酮酸激酶肌肉同工酶M2(PKM2),作為一種限速的糖酵解酶,參與腫瘤代謝和生長,其mRNA的3'UTR含有m5C位點。ALYREF直接識別PKM2 mRNA并以其m5C依賴性方式促進其穩定性,從而促進糖酵解和膀胱癌的腫瘤發生。類似的研究還表明,NSUN2介導的食管鱗狀細胞癌(ESCC)中的m5C高甲基化通過增強LIN28B依賴的GRB2 mRNA穩定性,激活致癌的PI3K/AKT和ERK/MAPK信號,促進ESCC的起始和進展。NSUN2通過以m5C依賴方式上調TEAD1增強下咽鱗狀細胞癌(HPSCC)的增殖和侵襲。在HCC中,NSUN2介導的m5C修飾在HCC中明顯高于相鄰非癌組織。m5C通過抑制Ras通路活性并增加HCC細胞對索拉非尼的敏感性來調控HCC進展,并且m5C修飾的lncRNA H19招募G3BP1致癌蛋白促進HCC發生和發展。此外,蛋白質翻譯后修飾通過修飾RNA甲基化reader蛋白參與調控m5C靶標,并影響腫瘤發生。SIAH1通過泛素化和降解YBX1間接促進m5C修飾RNA不穩定性,抑制上皮卵巢癌細胞的增殖、侵襲、遷移和藥物抗性。
幾項研究表明m7G tRNA修飾影響癌癥進展。METTL1/WDR4敲除破壞m7G tRNA解碼密碼子形成,降低mRNA翻譯效率并抑制肺癌、HCC、BC和鼻咽癌(NPC)進展。METTL1介導的HeLa細胞中mRNA內部m7G也增強其靶標mRNA的翻譯效率,而不依賴其對全局翻譯和tRNA甲基化的影響。METTL1催化的人類臍靜脈內皮細胞中VEGFA mRNA上的m7G組裝增加了VEGFA翻譯,并促進缺血后血管生成。這些研究表明內部m7G可能參與癌癥進展。
總體而言,RNA甲基化修飾在腫瘤發生過程中發揮著關鍵作用,但不同修飾是否在腫瘤發生中協同或拮抗作用值得進一步研究。此外,盡管許多由RNA甲基化修飾調控的靶標和通路具有腫瘤診斷和治療的潛力,但實際應用于臨床設置很少,需要進一步深入研究以促進臨床應用。
結論與展望
本文總結了包括m6A、m5C和m7G在內的三種甲基化表觀轉錄組的調控元件、分布特征、檢測技術以及生物學功能。由于RNA甲基化修飾在調控多種生理功能中的參與,主要概述了幾個熱點話題,包括配子發生、早期胚胎發生、免疫系統發育和疾病。盡管m6A和m5C RNA修飾的調控元件已經被發現并廣泛研究,但關于其他RNA甲基化修飾的信息相對較少,特別是其erasers和readers需要確定。隨著對其他RNA甲基化修飾動態性質的調控元件和機制的深入研究,對其功能機制的更清晰理解將有助于建立整體RNA表觀遺傳修飾調控網絡。
盡管已經開發了各種RNA甲基化修飾的測序技術,但它們中的大多數只能很好地捕獲和分析高豐度而不是低豐度轉錄本中的修飾信息,而后者將是一個有意義的突破點。此外,越來越多的研究表明RNA甲基化修飾參與多種生物過程和腫瘤發生。然而,幾乎所有的研究都是在群體細胞水平上進行的,這可能會忽視或扭曲單個細胞中的真實信息,限制對精確調控機制的理解,這對于指導疾病的精確靶向治療可能至關重要。因此,開發高通量單細胞RNA甲基化技術應該是該領域的創新點和推動力。此外,幾項研究也表明多種RNA甲基化修飾可能共同調控某些生物過程。因此,探索不同RNA修飾之間的相互調控關系可能是未來的一個熱點話題,這對于構建整體RNA表觀遺傳修飾調控網絡是必要的。目前能夠同時捕獲多種修飾的測序技術仍然相對較少,修飾類型的覆蓋范圍和靈敏度仍需改進。因此,開發新技術以同時檢測多種RNA表觀遺傳修飾是理解生物系統中整體作用模式的必要條件。
從文章的疾病部分來看,RNA表觀遺傳修飾及其調控因子在各種腫瘤的增殖、侵襲和遷移中發揮重要作用。此外,多個RNA甲基化修飾基因或其通路已被報道作為診斷或治療的潛在靶標,但其目前的臨床應用仍然非常有限。因此,需要加強特定RNA甲基化修飾抑制劑的研究,這可能是實現RNA甲基化修飾臨床轉化應用的關鍵點,盡管已有一些抑制劑的報道,如FTO抑制劑、Meclofenamic酸、FB23/FB23-2、MA2、Entacapone、DAC51、R-2HG、CS1/CS2、METTL3抑制劑(包括Compound 2/Compound 7)、STM2457、YTHDF2抑制劑(包括DC-Y13-27)和IGF2BP1抑制劑(包括BTYNB)。此外,幾項研究表明RNA甲基化修飾可以用于靶向編輯。在細胞水平上,表達與截短的METTL3甲基轉移酶結構域融合的核定位dCas13,與修飾的METTL3-METTL14甲基轉移酶復合體和特定導向RNA融合的細胞質定位,有能力在mRNA中將特定位點的腺苷修飾為m6A。Liu等人(2019b年)還設計了一個m6A動態編輯系統,將CRISPR-Cas9與單鏈m6A甲基轉移酶METTL3:METTL14融合以在特定位點編程m6A形成,同時將CRISPR-Cas9與ALKBH5或FTO融合以實現RNA的位點特異性去甲基化。然而,這些技術都是基于細胞內編輯相關蛋白的表達,使得直接治療如人類腫瘤等疾病變得困難,而其他RNA甲基化的RNA編輯技術大多未知。此外,考慮到RNA甲基化修飾對mRNA代謝和翻譯有顯著影響,研究體外RNA甲基化靶向編輯技術對于增強mRNA藥物的效力具有重要意義。
總之,對RNA甲基化修飾的調控蛋白組分、測序技術、功能機制、抑制劑和靶向編輯技術的深入研究將提供關于RNA甲基化修飾在生物發育和疾病發生中功能角色的廣闊視野,對于疾病診斷和治療也具有寶貴的視角。

mRNA的分布特征和調控元件
m6A
m6A是研究最廣泛的RNA甲基化修飾類型,幾乎存在于所有類型的RNA中,包括染色質相關新生pre-mRNA(chromatin-associated nascent pre-mRNA,caRNA)、成熟mRNA和非編碼RNA(ncRNA)。約25%哺乳動物細胞mRNA含有m6A,每個轉錄本平均含有三個m6A殘基。利用LC-MS/MS技術鑒定出人類mRNA中m6A/A占比約0.4%–1.79%。m6A主要位于內部mRNA中,特別是在靠近終止密碼子和mRNA的3′UTRs區域。m6A的保守motif序列是RRACH(R=A/G,H=A/C/U)。m6A的分布特征表明m6A可能廣泛參與mRNA代謝,如可變剪切、翻譯等,從而在生理和病理過程中發揮重要作用。m6A甲基化形成由甲基轉移酶(“writers”)催化,主要由METTL3、METTL14和WTAP組成,以及其他蛋白亞基,包括ZC3H13/Hakai/Virilizer、KIAA1429(VIRMA)、RBM15/15B。METTL16也是METTL同源家族蛋白之一,催化MAT2A mRNA和U6 snRNA上的m6A形成。同時m6A甲基基團能夠被去甲基化酶(“erasers”)去除,主要包括FTO和ALKBH5家族成員。m6A修飾的RNA堿基位點被特定的結合蛋白(“readers”)識別以執行多樣的生物學功能。迄今為止已鑒定的m6A readers包括YTH結構域蛋白(YTHDC1-2、YTHDF1-3)、核異質核糖核蛋白(HNRNPC、HNRNPA2B1)、類胰島素生長因子2 mRNA結合蛋白(IGF2BP1-3)、真核起始因子3(eIF3)(表1)。
m5C
m5C是另一種常見且豐富的RNA修飾,存在于各種RNA中,包括mRNA、tRNA、rRNA和vtRNA。在人類和小鼠的mRNA中,m5C位于翻譯起始位點(TSS)的下游區域,通過LC-MS/MS檢測人類mRNA中m5C/C占比約為0.02%–0.09%。
與m6A類似,m5C修飾也由其“writers”和“erasers”動態調控。已經鑒定的幾個m5C甲基轉移酶(writers),包括NOL1/NOP2/SUN結構域家族成員(NSUN1-7)、DNA甲基轉移酶同源物(DNMT2)和特異性tRNA甲基轉移酶家族成員(TRDMT4A和TRDMT4B),其中NSUN2和NSUN6能夠催化mRNA上m5C形成。Tet家族蛋白(TET1和TET2)不僅催化DNA上5mC到5-羥甲基胞嘧啶(5hmC)的形成,還介導mRNA中m5C氧化。目前,有兩種主要類型的mRNA m5C readers蛋白,其具有特殊的RNA結合域,以決定m5C修飾RNA分子的不同命運,包括RNA和出口因子結合蛋白2(ALYREF)和Y-box結合蛋白(YBX1和YBX2)(表1)。
m7G
m7G也是一種普遍存在的RNA甲基化修飾,被發現位于真核生物的18S rRNA和tRNA變環以及microRNA(miRNA)中。此外,大多數真核mRNA在N7-鳥嘌呤的5′帽端含有m7G修飾。隨著靈敏度更高的檢測和定位技術發展,研究人員最近發現m7G修飾存在于mRNA內部區域。在人類和小鼠細胞系的去帽poly(A)+ mRNA中,m7G/G占比約為0.02%–0.05%,占相同細胞中m6A/A的5%–10%(使用LC-MS/MS)。Zhang等人(2019b)報告稱,m7G峰值主要積聚區域位于3′UTR,次要區域在5′UTR內部mRNA中。另一項報告也發現,人類和小鼠mRNA內部的m7G修飾富集在5′UTR,特別是在翻譯起始位點附近的AG富集區域。
與m6A和m5C相比,關于m7G調控因子的研究才剛剛開始。報道的m7G甲基轉移酶包括Trm8p/Trm82p復合體和酵母中的Bud23/Trm112,以及哺乳動物中相應的同源物METTL1/WDR4和WBSCR22/TRMT112,其中METTL1不僅介導tRNA上的m7G修飾,還催化mRNA內部m7G修飾。此外,RNMT和RAM復合體參與催化哺乳動物N7-鳥嘌呤5′帽端的m7G修飾的形成。最新研究報告稱,QKI(QKI15、QKI16和QKI17)是mRNA內部m7G修飾的第一個reader蛋白,它在應激條件下與G3BP1互作,抑制m7G修飾的mRNA形成應激顆粒,同時調控Hippo信號通路中關鍵基因的穩定性和翻譯效率(表1)。
檢測技術
基于Bulk RNA甲基化檢測技術
基于免疫沉淀方法
抗體和免疫沉淀的RNA甲基化檢測策略,是一種簡單、穩定且低成本的方法,傳統上被廣泛用于各種生物的表觀轉錄組特征圖譜繪制。典型的技術分為兩類:基于RNA甲基化抗體的(包括m6A/m5C/m7G-MeRIP-seq、m6A/m7G-miCLIP-seq、PA-m6A-seq和m6A-LAIC-seq)和基于甲基轉移酶抗體的(m5C-miCLIP-Seq和AZA-IPseq)。
(1) MeRIP-seq
大多數用于RNA甲基化修飾的高通量測序技術依賴于特定甲基化抗體(如m6A、m5C和m7G)。甲基化RNA免疫沉淀測序(MeRIP-seq),如m6A-MeRIP-Seq(m6A-seq)(圖1A)、m5C-MeRIP-Seq(圖2A)和m7G-MeRIP-Seq(圖3A)是常用的方法,用于鑒定mRNA中的RNA甲基化peaks。然而,MeRIP-seq存在一些缺點,如相對較低的檢測分辨率(約100-150 nt)和對低豐度RNA上的RNA甲基化位點不敏感。Molinie等人(2016年)改進的m6A-MeRIP-seq開發了m6A-LAIC-seq(m6A水平和異構體特征序列),通過調整抗體使用、涉及各種內標調控和同時進行上清液(m6A陰性部分)的NGS測序,計算m6A陽性和m6A陰性部分的RNA表達,以在全轉錄組范圍內定量m6A的化學計量學(表2)。
(2) miCLIP-seq
通過將MeRIP技術與光交聯反應結合,研究人員發明了UV誘導的抗體-RNA交聯方法來檢測轉錄組甲基化修飾,如PA-m6A-Seq(光交聯輔助m6A測序)(圖1C)、m6A-CLIP(m6A交聯免疫沉淀)(和m6A/m7G-miCLIP(m6A/m7G甲基化單堿基分辨率交聯免疫沉淀)(圖1B和3B)。m6A-CLIP和m6A/m7G-miCLIP均基于UV交聯RNA與m6A或m7G抗體在結合位點形成共價鍵,導致逆轉錄過程中的C-T位點轉換或截斷,通過此方法可以準確鑒定m6A位點并獲得單堿基分辨率甲基化圖譜(表2)。
(3) PA-m6A-seq
PA-m6A-seq(光交聯輔助m6A測序)方法依賴于4-硫尿苷(4SU,光敏感的核苷酸類似物)在細胞培養期間并入poly(A) RNA中,抗m6A免疫沉淀和UV交聯,隨后進行靶向RNA洗脫和文庫構建(圖1C)。與MeRIP-Seq或m6A-seq相比,該方法實現哺乳動物接近單堿基分辨率全轉錄組m6A圖譜(表2)。
(4) m5C-miCLIP-seq
甲基轉移酶可以催化體內特定核酸堿基位點的RNA甲基化形成。m5C甲基轉移酶NSUN2包含釋放(半胱氨酸271)和催化(半胱氨酸321)位點。m5C-miCLIP(m5C甲基化單堿基分辨率交聯和免疫沉淀)利用這一特性,通過結合細胞中外源表達的NSUN2-C271A(NSUN2上的突變釋放位點)與UV交聯免疫沉淀,其中突變蛋白NSUN2-C271A和m5C修飾位點在UV交聯下強烈結合形成共價鍵,這在RT-PCR過程中引起截斷或突變(圖2B)。因此,m5C-miCLIP也能夠以單堿基分辨率檢測m5C修飾位點(表2)。
(5) AZA-IP-seq
AZA-IP-seq(5-氮胞嘧啶介導的RNA免疫沉淀測序)是另一種基于甲基轉移酶抗體的m5C檢測方法。簡要來說,5-氮胞嘧啶(5-azaC),作為DNA甲基轉移酶抑制劑之一,可以隨機并入DNA和新生RNA中,并且也有能力與甲基轉移酶(外源和內源)結合形成共價鍵。結合5-azaC處理和特定甲基轉移酶抗體(如NSUN2)的免疫沉淀,可以以單堿基分辨率檢測m5C修飾位點(圖2A,表2)。

表1:mRNA甲基化修飾調控因子綜述
基于化學反應方法
(1) RNA-BisSeq
RNA亞硫酸鹽測序(RNA-BisSeq)是定量分析mRNA m5C甲基組的經典方法之一。它依賴于用亞硫酸鹽預處理RNA,促使未修飾的C發生化學脫氨反應并轉化為U,而甲基化的胞嘧啶(m5C)保持為C。經過RT、cDNA合成和PCR過程后,U堿基轉化為T,從而可以區分m5C和C。通過生物信息學分析,可以通過分析未轉化的胞嘧啶來鑒定m5C修飾位點,同時,通過計算未轉化胞嘧啶的覆蓋率百分比來估計m5C甲基化水平(圖2D)。總的來說,RNA-BisSeq不需要在細胞中表達外源基因或化學試劑,能夠準確捕獲細胞和組織中原始的m5C修飾狀態。RNA-BisSeq被廣泛用于探索各種RNA中m5C的表達特征,并預測其潛在功能,包括哺乳動物、斑馬魚、擬南芥和水稻。RNA-BisSeq中m5C檢測的準確性取決于亞硫酸鹽處理過程中C到U的轉化效率,這受到反應條件(如溫度、反應時間)和RNA狀態(如RNA質量、RNA二級結構等)的影響(表2)。
(2)m6A-SEAL-seq
FTO輔助的m6A選擇性化學標記測序(m6A-SEAL-seq)是一種利用FTO作為催化劑將m6A轉化為hm6A(N6-羥甲基腺苷)的化學標記方法。不穩定的hm6A將通過二硫蘇糖醇(DTT)介導的硫醇加成化學反應轉化為更穩定的dm6A(N6-二硫代肌醇甲腺苷)。然后,dm6A通過甲硫磺酸鹽(MTSEA)響應組裝生物素標簽,隨后進行鏈霉親和純化和測序(圖1D)。m6A-SEAL分辨率約為200 nt(表2)。
(3) m6A-label-seq
這種技術基于甲硫氨酸類似物Se-烯丙基硒代同型半胱氨酸作為人類和小鼠細胞的培養營養物質。這種類似物可以驅動甲基供體SAM被烯丙基團標記,通過細胞自身代謝形成Allyl-SAM或Allyl-SeAM。因此,細胞RNA能夠在假定m6A生成腺苷位點被代謝性地修飾為N6-烯丙基腺苷(a6A)。基于碘化誘導的a6A環化和在cDNA逆轉錄過程中對側位點錯配,實現全轉錄組范圍內單堿基分辨率檢測。m6A-label-seq的建立為理解m6A在分子水平上的生理作用提供了強有力的工具,并且可以應用于所有m6A motif。烯丙基團標記的效率和時間窗口對于準確鑒定m6A位點至關重要(表2)。
(4) m6A-SAC-seq
m6A選擇性烯丙基化學標記和測序(m6A-SAC-seq)是單堿基分辨率繪制全轉錄組m6A圖譜方法之一。這種方法的本質是使用Dim1/KsgA家族的二甲基轉移酶酶(MjDim1)在m6A上添加烯丙基SAM化學基團形成烯丙基6m6A,隨后在I2處理后發生環化。環化的烯丙基6m6A在逆轉錄過程中將被read為突變。根據突變reads,可以定量和分析轉錄組中m6A沉積位點(圖1F)。m6A-SAC-seq能夠覆蓋幾乎所有經典的m6A motif,并已應用于檢測HeLa、HEK293、HepG2以及造血干細胞(HSC)和單核細胞中的m6A水平。m6A-SAC-seq的初始樣本量約為30ng的poly(A)或rRNA耗盡RNA(表2)。
(5) GLORI
類似于RNA m5C的RNA-BisSeq,乙二醛和亞硝酸鹽介導的未甲基化腺苷的脫氨(GLORI)也是一種無偏倚、絕對基于化學反應的m6A定量方法。該程序包含三個連續步驟:①使用乙二醛形成可逆結構保護G(N1, N2-二羥基鳥嘌呤加合物)以避免亞硝酸鹽誘導的G脫氨;②未甲基化的A通過亞硝酸鹽催化的脫氨反應轉化為I;③通過堿性或加熱條件處理實現G的脫保護(圖1G)。GLORI的主要優勢是實現RNA中m6A定量分析,但GLORI成本高于m6A MeRIP-seq,且GLORI無法區分m6A和其他一些A修飾,如m6Am和m1A,盡管技術發明者聲稱已開發出分析流程來消除由m6Am和m1A引起的假陽性(表2)。
(6) eTAM-seq
進化的TadA輔助N6-甲基腺苷測序(eTAM-seq)是一種基于酶促脫氨反應的單堿基分辨率m6A測序方法,用于全轉錄組范圍內定量檢測m6A位點。簡要來說,使用高活性的tRNA腺苷脫氨酶TadA8.20進行脫氨反應,全局未甲基化的A轉化為I,只能與C配對并在隨后的逆轉錄、文庫構建和測序過程中被讀為G。修飾的m6A保持不變,在測序過程中仍然被讀為A。因此,通過eTAM-seq,A被讀為G,m6A被讀為A。eTAM-seq能夠在極少量RNA中(低至10個細胞的RNA)進行m6A的定量檢測,其初始RNA需求遠低于現有的m6A定量分析方法(圖1H)。
(7) TAWO-seq
TET輔助的過鎢酸鹽氧化測序(TAWO-seq)也是一種 RNA m5C單堿基分辨率測序方法,主要包含三個連續程序,包括由β-葡萄糖轉移酶(βGT)標記保護的原始hm5C,由TET酶氧化的原始m5C轉化為hm5C,以及由過鎢酸鹽介導的新生成hm5C的選擇性氧化為三羥基胸腺嘧啶(thT)(圖2E)。這項技術的最大優勢是與RNA-BisSeq相比能夠區分m5C和hm5C。
(8) m7G-seq
m7G上的正電荷對NaBH4介導的還原特別敏感。m7G-seq采用NaBH4介導的還原,在m7G位置上產生一個堿性位點,然后這些位點被生物素標記,隨后進行生物素下拉實驗。在逆轉錄過程中,RNA中的生物素標記m7G位點會導致錯配(主要是T以及其他堿基),從而實現基于這些突變的m7G甲基組的單堿基分辨率(圖3C,表2)。
基于酶切反應技術
MAZTER-seq和m6A-REF-seq(m6A敏感的RNA內切核酸酶促進的測序)是同時報道不依賴抗體的方法,用于定量m6A的化學計量分析。這兩種方法都依賴于RNA內切核酸酶MazF對ACA motif上的m6A識別,能夠在全轉錄組范圍內以單堿基分辨率檢測m6A修飾位點及其豐度。MazF在mRNA上更傾向于識別A-CA motif。由于RNA上m6A的motif是RRACH(R=A/G,H=A/C/U),大多數經過MazF酶處理后的讀段將在5'端含有ACA,因此內部的(m6A)CA基序被認定為甲基化位點(圖1I和J)。然而,這兩種方法都受限于內切核酸酶對m6A CA序列的選擇性,這使得不包含m6A CA序列的序列無法被識別(表2)。
基于RNA編輯的技術
DART-seq(脫氨基作用鄰近RNA修飾靶標測序)是一種不依賴抗體的方法,通過在哺乳動物細胞中表達外源性的APOBEC1-YTH融合蛋白來檢測全局m6A修飾位點。其中,YTH(m6A結合域)識別m6A,而連接的APOBEC1(胞嘧啶脫氨酶)直接將胞嘧啶殘基上的C編輯為U。這些編輯位點在后續的數據分析中被識別為m6A修飾區域(圖1K)。由于YTH結構域與m6A的2'-OH之間的氫鍵鍵合是關鍵結構,DART-seq中的YTH結構域無法識別m6Am。盡管DART-seq能夠從低量RNA(約10 ng總RNA)中繪制m6A位點,但需要將APOBEC1-YTH短暫轉染入哺乳動物細胞要求限制了其應用,并且可能破壞了生理狀態(表2)。

圖1:mRNA甲基化測序技術的發展。過去十年m6A測序技術取得快速發展,在單堿基分辨率(約八種類型)和單細胞水平(約三種類型)上取得了突破:包括基于m6A抗體的(A)m6A-seq/MeRIP-seq、(B)miCLIP和(C)PA-m6A-seq;基于化學反應的(D)m6A-SEAL-seq、(E)m6A-label-seq、(F)m6A-SPAC-seq和(G)GLORI、(H)eTAM-seq。

圖2:mRNA m5C甲基化測序技術。基于抗體m5C檢測方法,包括基于甲基轉移酶或其融合標簽抗體的技術(A)AZA-seq和(B)m5C miCLIP-seq,以及基于m5C抗體的方法(C)m5C MeRIP-seq。基于化學反應的技術是(D)RNA-BisSeq和(E)TAWO-seq。


表2:RNA甲基化檢測技術綜述
基于單細胞RNA甲基化檢測技術與單細胞組學圖譜相比,傳統的群體細胞測序方法使用的樣本包含成千上萬個細胞,因此只能反映群體中的平均甲基化水平。特別是,細胞表達的異質性在很大程度上被掩蓋,無法準確反映組織/器官的真實生理或病理特征。目前已經建立單細胞水平的測序技術,用于繪制轉錄組、染色質開放可及性、DNA甲基化修飾等圖譜。報道的單細胞轉錄組甲基化圖譜技術包括scDART-seq和scm6A-seq。
(1) scDART-seq
scDART-seq是在引入10X Genomics單細胞測序后從DART-seq發展而來,是首個單細胞水平的m6A檢測方法。通過應用scDART-seq,在成千上萬個單細胞中進行m6A圖譜分析,發現m6A在單細胞水平上表現出高度異質性,并且可以根據RNA甲基化特征區分細胞亞群,與基因表達水平無關。這些發現揭示以前在bulk-cell m6A分析中被忽視的m6A基本特征,并為理解m6A在不同細胞中的功能提供新見解(圖1L)。但由于scDART-seq基于外源基因表達,因此很難應用于組織樣本,也無法呈現細胞的原始狀態(表2)。
(2) scm6A-seq
通過結合RNA多重標記和MeRIP-seq/m6A-IP,scm6A-seq能夠捕獲全轉錄組范圍的m6A圖譜,并能夠在不表達任何外源基因的情況下比較單細胞中的m6A水平。它已被用于區分有核仁包圍(SN)和無核仁包圍(NSN)的卵母細胞,以單細胞分辨率繪制小鼠卵母細胞發育和合子基因組激活期間的m6A調控機制(圖1M,表2)。
(3) picoMeRIP-seq
picoMeRIP-seq也是一種基于m6A抗體的低輸入RNA/細胞或單細胞啟動的m6A圖譜方法。與scm6A-seq相比,picoMeRIP-seq不標記單細胞中的RNA,后續文庫構建直接使用商業的SMART-Seq stranded kit(TaKaRa)。在這種方法中,通過系統優化關鍵步驟提高了m6A/A富集比率,包括增加洗滌劑(SDS)和鹽(NaCl)濃度,使用低結合管和商業m6A抗體(Millipore)等(圖1N)。picoMeRIP-seq已用于在100 pg poly(A) RNA、單個斑馬魚合子、單個小鼠卵母細胞和植入前胚胎、小鼠胚胎干細胞(1,000、100和10個細胞)的全轉錄組水平上繪制m6A(表2)。
綜上所述,過去十年中RNA甲基化測序技術的快速發展使我們能夠更清晰地了解RNA甲基化修飾的分布特征和功能機制。盡管每種技術都有其自身的優勢和劣勢,但它們可以從多個維度進行補償或校正,以獲得更準確的RNA甲基化位點信息。此外,在單堿基精度和單細胞水平上取得了技術突破,這可以更精細地捕獲細胞間RNA甲基化的異質性,并建立單細胞水平的RNA甲基化調控網絡。
生物學功能
RNA過程和代謝
作為轉錄后修飾,RNA甲基化參與RNA代謝的整個過程,如pre-mRNA剪切、mRNA出核、mRNA降解或穩定性以及mRNA翻譯。
pre-mRNA剪切
pre-mRNA剪切作為基因表達轉錄后調控的第一階段,是去除pre-mRNA中內含子、有序連接外顯子以最終生成成熟mRNA的過程。pre-mRNA可變剪切是這一過程中的關鍵步驟,它可以從一個基因生成多個轉錄本,為遺傳多樣性和復雜性做出貢獻。m6A去甲基化酶(FTO和ALKBH5)和甲基轉移酶復合體(WTAP、METTL3和METTL14)定位于核斑點中,提示m6A在RNA剪切中的潛在作用。FTO優先結合內含子區域pre-mRNA,靠近可變剪切(AS)外顯子和聚腺苷酸位點,并調控可變剪切和3′UTR表達。
m6A reader蛋白hnRNPG結合到共轉錄新生的m6A修飾pre-mRNA,并通過對RNA聚合酶II的互作及其在hnRNPG調控外顯子周圍的占位影響來調控可變剪切。此外,m6A分布在圍繞5′-和3′-剪切位點的外顯子區域,并與SRSF1和SRSF2的結合簇空間重疊。在3T3-L1細胞中敲除FTO增強了m6A水平,并促進了SRSF2蛋白的RNA結合能力,該蛋白調控脂肪生成調控因子RUNX1T1的可變剪切和隨后的前脂肪細胞分化。同時,有報道稱m6A參與依賴其閱讀蛋白YTHDC1的pre-mRNA剪切,促進pre-mRNA剪切因子SRSF3(SRp20)而阻止SRSF10(SRp38)進入目標mRNA的結合區域。小鼠卵母細胞中的Ythdc1與pre-mRNA 3′端處理因子(CPSF6、SRSF3和SRSF7)互作,并以m6A依賴方式廣泛參與可變聚腺苷酸化和改變3′UTR長度。果蠅中YTH家族蛋白的同源物YT521-B介導依賴于m6A的pre-mRNA可變剪切,并調控果蠅的神經功能和性別決定。Louloupi等人報告稱,剪切位點上的m6A沉積促進快速剪切,而內含子中高m6A水平與慢可變剪切相關。有趣的是,m6A開關調控HNRNPC結合活性,其中m6A主導RNA和reader蛋白互作的RNA結構依賴性可及性,促進外顯子保守并影響目標mRNA的可變剪切。總的來說,m6A對pre-mRNA成熟過程發揮重要作用,但m5C或m7G是否也參與這一過程尚不清楚。
mRNA出核
mRNA出核是基因表達過程中的關鍵步驟,mRNA通過這一步驟被轉運到細胞質中進行翻譯。大多數mRNA出核依賴于轉錄出核復合體(TREX)和核異二聚體出核受體(NXF1-P15)通路,其中TREX復合體成員被沉積在mRNA上并將其交給NXF1。
YTHDC1通過剪切因子SRSF3和出核接頭NXF1促進含m6A的mRNA出核。研究發現多個TREX亞基(ALYREF、UAP56、THOC5、CHTOP)與m6A甲基轉移酶復合體(WTAP、METTL3、METTL14、KIAA1429)互作,調控轉錄本出核。Mettl3在細胞核中顯著增加了時鐘基因Per2和Arntl的mRNA積累,而細胞中ALKBH5缺失加速了mRNA的RNA出核。同時,HeLa細胞中YTHDC1缺失導致m6A修飾的mRNA核積聚,而在細胞質中缺失。
除了m6A,m5C也在mRNA出核中發揮關鍵作用。ALYREF不僅是m5C reader蛋白,也是調控核質穿梭的TREX亞基之一。在HeLa細胞中,ALYREF促進含m5C的mRNA出核。3T3-L1細胞中NSUN2的缺乏導致ALYREF-m5C軸介導的CDKN1A mRNA出核減少,導致細胞周期加速和促進脂肪形成。
mRNA降解和穩定性
m6A修飾參與調控mRNA代謝。在野生型mESCs中,Mettl3和Mettl14組成的甲基轉移酶復合體在標靶轉錄本上催化m6A形成,隨后阻止與mRNA穩定性相關蛋白HuR的結合,并增強microRNA靶點,導致目標轉錄本不穩定。YTHDF2是一個經典的m6A reader蛋白,它通過多種通路促進含有m6A的靶轉錄本降解。首先,Wang等人(2014a)分析了YTHDF2蛋白結構,發現YTHDF2的羧基末端域(C-YTHDF2)選擇性地識別含m6A mRNA,而氨基末端域(N-YTHDF2)負責將YTHDF2-m6A-mRNA復合體定位到更專門的mRNA降解機器(如P體等)。其次,哺乳動物細胞中的YTHDF2招募CCR4-NOT脫腺苷酸酶復合體,加速含m6A RNA的脫腺苷酸化和降解。此外,YTHDF2還與HRSP12互作,招募RNase P/MRP復合體(內切核糖核蛋白酶復合體),以切割含m6A的RNA。YTHDF2介導的m6A甲基化mRNA的降解在各種發育和疾病過程中發揮關鍵作用,如維持造血干細胞功能、在卵母細胞成熟和胚胎發生過程中母源mRNA降解、癌癥進展等。
與YTHDF2作用不同,另一個m6A reader蛋白IGF2BPs參與維持穩定性和儲存,并在正常和應激條件下影響目標m6A甲基化mRNA基因表達。IGF2BPs介導的m6A修飾mRNA的穩定性參與腫瘤形成。
m5C修飾在mRNA穩定性中也表現出類似的作用。兩項平行研究報告稱,m5C reader蛋白YBX1通過招募RNA穩定性相關蛋白(HuR或PABPC1a)影響目標mRNA穩定性,并因此參與膀胱尿路上皮癌(UCB)的腫瘤形成和轉移,以及斑馬魚胚胎發育。在小鼠Th17細胞中NSUN2缺失以m5C依賴方式導致Il17a和Il17f mRNAs的半衰期和數量減少。
翻譯
RNA甲基化已被證明可以促進或抑制翻譯過程。在細胞質中,YTHDF1富集在40S核糖體的蛋白質亞基中,并與翻譯啟動復合體的組成部分eIF3互作,從而促進m6A依賴的mRNA翻譯。
YTHDF3也與YTHDF1協同促進蛋白質合成。另一項平行研究也報告稱,YTHDF3與YTHDF1合作,通過在翻譯過程中順序招募翻譯效應物(40S和60S核糖體亞基)來促進m6A修飾目標mRNA的翻譯效率。總體而言,YTHDF1和YTHDF3通過與YTHDF1/YTHDF3鏈接,在轉錄本m6A修飾的3'端和40S和60S亞基的翻譯效應物的5'端之間形成loop,調控翻譯啟動。最近的報告還說明了幾條分子通路參與YTHDF1或YTHDF3介導的m6A修飾轉錄本的翻譯過程。Zou等人(2023年)報告稱,YTHDF1與核糖體蛋白結合以促進其目標mRNA翻譯,但FMRP通過阻礙YTHDF1與核糖體蛋白的結合來抑制神經翻譯。然而在神經刺激下,FMRP被磷酸化并釋放YTHDF1,以提高m6A甲基化mRNA翻譯效率,從而促進神經去極化。同時,Chen等人(2023年)已經證明YTHDF1和YTHDF3(不是YTHDF2)攜帶高水平的營養感應O-GlcNAc修飾,O-GlcNAcylation通過抑制它們與mRNA翻譯相關蛋白互作,抑制YTHDF1和YTHDF3的翻譯促進功能,導致m6A甲基化mRNA翻譯抑制。Chen等人(2023年)還建議不同的細胞在YTHDF1/3上表現出不同的O-GlcNAc修飾水平,這可能是先前研究對YTHDF1/3是否促進m6A RNA翻譯功能得出不同結論的原因之一。此外,當m6A位于5'UTR時,它可以通過被43S復合體組分eIF3識別,在細胞應激下促進帽的單獨翻譯。另一個reader蛋白YTHDC2也以m6A依賴方式增強其靶標翻譯效率。盡管如此,Choi等人(2016年)證明,轉錄本中m6A修飾密碼子通過破壞轉錄本上tRNA的選擇導致翻譯延伸動態更慢和翻譯效率更低。此外,Lin等人(2016年)發現METTL3,而不依賴其m6A催化活性,通過招募eIF3到翻譯啟動復合體,增強包括重要的癌基因如EGFR和TAZ在內的目標mRNA翻譯,導致人類肺癌細胞的生長、存活和侵襲得到促進。
m5C廣泛分布在rRNA和tRNA變區和反密碼loop上,通過調控tRNA穩定性和密碼子識別、翻譯保真度和準確性或全局蛋白質合成等參與翻譯調控。mRNA上的m5C也參與調控翻譯效率,在3T3-L1細胞中,NSUN2以m5C依賴的方式促進CDKN1A mRNA的翻譯效率。在大鼠的T淋巴細胞中,NSun2介導的m5C修飾在高同型半胱氨酸血癥誘導下促進IL-17A mRNA的翻譯。此外,NSUN6特異性m5C位點富集在3'UTR中的CTCCA motif上,與翻譯終止保真相關。然而,Tang等人(2015年)報告稱NSun2通過在p27 mRNA的5'UTR上的胞嘧啶C64上甲基化,抑制p27翻譯,表明mRNA上m5C位點可能決定其對翻譯效率的調控效應。
真核mRNA的5'帽上m7G已被證明參與翻譯調控。最近的研究還表明,mRNA內部的m7G修飾在mRNA翻譯通路中起作用。METTL1組裝的內部m7G修飾能夠促進m7G修飾轉錄本翻譯效率,而不依賴于其對全局翻譯和tRNA甲基化的影響。內部m7G在人類mRNA沿的表現顯示在翻譯起始位點保守富集,而在H2O2或熱休克處理下在CDS和3'UTR區域顯著積累,促進mRNA翻譯效率。此外,METTL1介導的m7G甲基化增強VEGFA mRNA翻譯,促進人臍靜脈內皮細胞(HUVECs)的血管生成。
綜上所述,RNA甲基化修飾在包括pre-RNA處理、mRNA代謝和翻譯在內的整個mRNA表達過程中發揮重要作用,凸顯其生物學意義。Li等人(2017c)證明METTL3/METTL14介導的m6A和NSUN2介導的m5C甲基化在p21 3'UTR中協同增強p21翻譯,在氧化應激誘導的細胞衰老中導致p21表達升高,表明多種RNA甲基化修飾可能協同調控同一生物學事件。然而,仍然需要揭示這些修飾單獨或協同調控mRNA表達過程的更多調控機制,這將有助于描繪多種RNA甲基化的調控網絡。
哺乳動物發育
配子發生
一系列最新研究表明,RNA甲基化表觀轉錄組在精子發生和卵子發生中扮演著至關重要的角色。Guo等人(2022年)通過LC-MS/MS分析發現,多種RNA修飾(如m5C、m3C、m7G、m2G、m22G、m1G和m1A)分布在人類精子的RNA中,這些修飾在弱精子癥(AZS)和畸精子癥(TZS)組中的水平顯著高于正常精子癥(NZS)組,特別是在TZS組中m5C和m6A的水平更高。在精子發生過程中,m6A作為一個重要的調控因子,參與哺乳動物精原細胞的有絲分裂、減數分裂和精子形成。Mettl3介導的m6A調控精原干細胞(SSCs)的增殖和分化,并影響減數分裂的啟動。在雄性生殖細胞中敲除METTL3或METTL14會導致睪丸組織中SSCs快速耗竭甚至完全缺失。人類精子中METTL3上調導致m6A水平增加,進而增強精子運動能力,這是弱精子癥的一個風險因素。此外,小鼠支持細胞特異性敲除Wtap會損害SSCs的自我更新和增殖能力,最終導致不育,通過干擾Wtap介導的m6A修飾基因的可變剪切。此外,ALKBH5介導的小鼠精原細胞和圓形精子細胞核中的m6A參與正確剪切和較長3'UTR mRNAs生成,這是精子發生的晚期減數分裂和單倍體階段所必需的。敲除FTO會導致GC-1精原細胞系的染色體不穩定和G2/M階段轉換抑制。在小鼠中,Ythdc2在雄性或雌性生殖細胞中敲除導致異常的配子減數分裂,導致不育和睪丸及卵巢體積減小。同時,小鼠減數分裂細胞中條件性敲除Ythdc2導致轉錄組嚴重失調,包括編碼微管網絡蛋白的轉錄本,并導致減數分裂細胞和精原細胞在晚期減數分裂階段的端粒聚集和凋亡。成年雄性小鼠Ythdc1缺陷導致缺乏任何生殖細胞,包括有絲分裂精原細胞,并表現出僅支持細胞的表型。在小鼠精原細胞中敲除Ythdf2通過m6A/mRNA降解通路下調基質金屬蛋白酶表達,并影響細胞粘附和精原細胞增殖。此外,敲除m5C甲基轉移酶NSun2對精原干細胞和支持細胞沒有影響,但抑制了生殖細胞進入減數分裂的減數分裂階段。
在卵子發生過程中,METTL3介導的m6A通過促進母源mRNA翻譯效率對小鼠卵母細胞成熟是必需的。在卵母細胞的生殖泡(GV)階段敲低Mettl3嚴重抑制卵母細胞的減數分裂成熟。同時,Yao等人(2023年)證明METTL3催化的m6A沉積促進了GV期卵母細胞中m6A修飾RNA降解。然而,Mu等人(2021年)報告稱METTL3靶向Itsn2進行m6A修飾,隨后增強其在GV階段的穩定性,以促進卵母細胞發育過程中減數分裂的恢復。此外,母源YTHDF2負責以m6A依賴方式指導適當的母源轉錄本劑量,從而決定哺乳動物卵母細胞質量和雌性生育能力。卵母細胞中Ythdc1缺陷導致m6A依賴的可變剪切缺陷,導致卵母細胞成熟停滯和雌性不孕。在卵母細胞中特異性敲除KIAA1429導致GV期卵母細胞中m6A修飾RNA的異常代謝,導致GV卵母細胞無法進行生殖泡破裂(GVBD)和隨后失去恢復減數分裂能力。此外,卵巢中Nsun5缺失導致m5C在mRNA外顯子和3'UTR區域的時間依賴性下降,影響減數分裂阻滯缺陷2樣2(MAD2L2)的mRNA穩定性、生長分化因子9(GDF9)的翻譯效率、以及Brd8外顯子區域的異常可變剪切,導致卵泡發育和卵巢功能障礙。有趣的是,NSUN2在人類和小鼠MI/MII期卵母細胞的細胞質中表達,可能促進NSUN2蛋白與母源mRNAs互作,并催化m5C形成。卵母細胞中m5C修飾轉錄本的逐漸增加和沉積可能在早期胚胎發生中起作用。
早期胚胎發育
RNA甲基化修飾在胚胎發育中發揮重要作用。在體外,小鼠GV期卵母細胞中METTL3缺失會阻礙受精后胚胎發育中的母系到合子轉變(MZT)和合子基因組激活,可能是通過破壞母源mRNA降解。小鼠胚胎4細胞階段的轉錄因子mRNA上,如Cdx2、Nanog、Sox2和Pou5f1的m6A修飾,可能參與調控合子基因激活(ZGA)過程。m6A reader蛋白YTHDF2在母源上是必需的,對于卵母細胞的能力和早期MZT過程,具有清除m6A修飾的母源mRNA作用。由METTL3依賴的m6A甲基化調控的HnRNPA2/B1在著床前胚胎發育期間在核和細胞質中表達,其功能缺陷會延緩4細胞階段后的胚胎發育,并通過對胚泡中多能性的調控影響內細胞團(ICM)的形成。斑馬魚胚胎發生中的m5C reader蛋白YBX1招募Pabpc1a來維持m5C修飾的母源mRNA穩定性,促進有序的MZT過程。
對于小鼠胚胎干細胞(mESC),Wang等人報告稱m6A甲基化對于維持mESC在其基礎狀態至關重要,Mettl3或Mettl14缺失會導致mESC失去自我更新能力,這是由于HuR-microRNA和m6A介導的RNA穩定性通路功能障礙。Zc3h13靶向核中的WTAP、Virilizer和Hakai的成分復合體上,催化m6A形成,然后促進mESC自我更新。Batista等人(2014年)證明小鼠和人類ESC中Mettl3缺失降低了m6A修飾水平,延長分化時Nanog表達,導致促進mESC自我更新和抑制mESC分化。此外,Mettl3介導的m6A甲基化維持多能性因子保真和及時下調,調控小鼠原始多能性解決過程中適當的譜系啟動和分化。Mettl14介導的m6A調控mRNA表達和可變剪切,并進一步轉換為原始多能性到啟動多能性和外胚層分化的小鼠胚胎。更重要的是,METTL14缺失在E6.5和E7.5(胚胎日)導致嚴重的生長遲緩和異常形態。
免疫系統發育
免疫細胞起源于造血干細胞(HSCs)分化,其命運對整個免疫系統至關重要。越來越多的證據支持RNA甲基化從多個角度調控HSCs。斑馬魚胚胎中Mettl3缺失抑制了最早的HSPCs生成,通過破壞YTHDF2介導的動脈內皮基因 notch1a 和 rhoca 的m6A依賴性mRNA衰變。與斑馬魚中的功能一致,Mettl3-m6A-YTHDF2-Notch軸通路在小鼠HSPCs生成和明確的造血中也顯示出不可或缺和保守的功能。小鼠中階段特異性的Mettl3缺失導致HSCs積累,并因未能通過METTL3介導的m6A甲基化上調MYC表達而阻止HSC分化。Cheng等人(2019b)還證明m6A通過調控MYC mRNA穩定性維持HSC對稱。同時METTL14在正常髓系造血過程中表達下調,并通過正向調控MYB和MYC mRNA穩定性和翻譯,基于m6A方式促進HSPCs向髓系細胞分化。Ythdf2缺失通過促進與干細胞自我更新相關的轉錄因子m6A介導的mRNA穩定性,促進HSPCs和人類臍帶血(hUCB)HSCs擴增。Mapperley等人(2021年)還報告稱,造血特異性Ythdf2缺失導致m6A修飾和炎癥反應相關轉錄本上調,并激活促炎通路,導致淋巴潛能喪失,隨后髓系偏向和HSC擴增。并且老化的Ythdf2缺失HSCs導致多系造血重建失敗。
RNA甲基化通過調控免疫相關基因的轉錄本代謝參與先天免疫。在巨噬細胞中,SOCS1作為SOCS家族蛋白之一,參與巨噬細胞激活的負反饋回路,通過促進目標信號蛋白的多泛素化和蛋白酶體降解,以防止壓倒性的全身炎癥,其在巨噬細胞中對感染的響應依賴于METTL14-m6A-YTHDF1軸。METTL3缺失導致m6A介導的mRNA穩定性和Irakm高表達,最終抑制TLR(Toll樣受體)信號介導的巨噬細胞激活。樹突狀細胞(DCs)作為連接先天和適應性免疫反應的專業抗原呈遞細胞(APCs),對啟動適應性免疫反應、消除入侵病原體和維持免疫穩態至關重要。Mettl3催化的mRNA m6A甲基化增強了CD40、CD80和TLR4信號接頭Tirap翻譯,并促進DC激活和TLR4/NF-κB信號誘導的細胞因子產生。此外,NK細胞中的Ythdf2對IL-15/STAT5信號介導的NK細胞存活、增殖和效應功能是必需的,促進NK細胞的抗腫瘤和抗病毒免疫活性。小鼠腫瘤模型中Mettl3缺失下調m6A甲基化基因SHP-2表達,可能導致NK細胞對IL-15刺激應答降低,并抑制NK細胞在腫瘤微環境中的浸潤和功能。
除了先天免疫,RNA甲基化還參與調控適應性免疫反應。Mettl3介導SOCS家族蛋白SOCS1、SOCS3和CISH的m6A形成及其隨后的降解,降低了SOCS家族活性,從而促進IL-7介導的STAT5激活和naïve T細胞的穩態增殖和分化。在Tregs中敲除Mettl3/m6A增加了Socs mRNA表達,從而抑制IL-2-STAT5信號通路,維持Tregs抑制功能。Th17細胞敲除METTL3可以促進SOCS3 mRNA穩定性,從而抑制IL-17A和CCR5表達,破壞Th17細胞分化和浸潤。METTL3介導的m6A穩定Tcf7轉錄本,允許正常產生TCF-1蛋白及其調控的T濾泡輔助(Tfh)細胞調控因子,促進了Tfh細胞分化、增殖和功能成熟。T細胞特異性敲除ALKBH5增強了CD4+ T細胞中m6A修飾水平,并下調Cxcl2和Ifng的mRNA穩定性和蛋白表達,導致CD4+ T細胞功能和中性粒細胞招募在自身免疫期間受到抑制。
與m6A相比,關于其他RNA甲基化修飾在免疫細胞中的功能機制的研究相對較少。在高同型半胱氨酸血癥(HHcy)誘導的大鼠慢性炎癥疾病模型中,NSun2通過催化m5C形成及其在T淋巴細胞中促進翻譯來介導IL-17A表達上調。Yang等人(2023年)還發現NSun2特別與Th17細胞轉錄因子RoRγt結合,催化其靶標上的RNA m5C形成,包括Il17a和Il17f,從而增強其mRNA穩定性。小鼠CD4+ T細胞中Nsun2缺失特別抑制了Th17細胞分化,并緩解Th17細胞誘導的結腸炎發病機制。在系統性紅斑狼瘡(SLE)患者的CD4+ T細胞中,Nsun2表達和m5C修飾水平下調,高甲基化m5C轉錄本主要參與mRNA剪切、穩定和翻譯的細胞因子相關信號通路,而低甲基化m5C轉錄本主要參與翻譯延伸。
總的來說,RNA甲基化修飾廣泛參與生物體的發育過程,并在配子發生、胚胎發生以及胚胎后神經和免疫系統發育等多個功能通路中發揮關鍵作用。目前,m6A在發育研究中的關注度比其他修飾更多。隨著檢測技術的進步和各種RNA甲基化調控因子的鑒定,其他甲基化修飾在發育中的功能分析也可能變得有價值。
癌癥
目前,已有數百項研究證明RNA甲基化通過直接作用或其調控元件參與包括癌癥在內的多種疾病發生和發展的調控。以下僅總結一些最新的(過去五年)和尖端的關于腫瘤發生中RNA甲基化修飾的研究。越來越多的證據表明m6A失調驅動異常的轉錄和翻譯程序,并隨后促進疾病或腫瘤的發生和進展,如白血病、肝細胞癌(HCC)、肺癌(LC)、結直腸癌(CRC)、乳腺癌、膀胱癌(BC)、胰腺癌(PC)、胃癌(GC)、膠質母細胞瘤。m6A在癌細胞代謝中發揮重要作用,包括通過調控代謝相關通路,如mTOR、PTEN、MAPK、NF-κB、Wnt信號通路等,或轉錄因子,如HIF-1、FOXM1、cMyc、YAP。m6A還參與重塑各種腫瘤免疫,通過調控免疫細胞的生存或功能,包括B細胞、CD8+ T細胞、CD4+ T細胞、PD-1+ T細胞、Treg細胞、NK細胞、DC細胞、巨噬細胞、中性粒細胞、嗜酸性粒細胞和CD4+記憶激活T細胞的浸潤,以及免疫相關細胞因子的表達,如FN-γ、CXCL9和CXCL10。總體而言,m6A影響腫瘤發生和轉移、代謝、免疫逃逸,在診斷和治療方面具有潛在價值。
m5C調控因子,如NSUN2的甲基轉移酶和YBX1的reader蛋白,在腫瘤組織中高表達。m5Cs在腫瘤組織中也經常出現高甲基化,并在致癌通路中富集。NSUN2和YBX1在UCB中靶向HDGF基因3'UTR的m5C,調控HDGF mRNA穩定性并促進UCB發病機制。丙酮酸激酶肌肉同工酶M2(PKM2),作為一種限速的糖酵解酶,參與腫瘤代謝和生長,其mRNA的3'UTR含有m5C位點。ALYREF直接識別PKM2 mRNA并以其m5C依賴性方式促進其穩定性,從而促進糖酵解和膀胱癌的腫瘤發生。類似的研究還表明,NSUN2介導的食管鱗狀細胞癌(ESCC)中的m5C高甲基化通過增強LIN28B依賴的GRB2 mRNA穩定性,激活致癌的PI3K/AKT和ERK/MAPK信號,促進ESCC的起始和進展。NSUN2通過以m5C依賴方式上調TEAD1增強下咽鱗狀細胞癌(HPSCC)的增殖和侵襲。在HCC中,NSUN2介導的m5C修飾在HCC中明顯高于相鄰非癌組織。m5C通過抑制Ras通路活性并增加HCC細胞對索拉非尼的敏感性來調控HCC進展,并且m5C修飾的lncRNA H19招募G3BP1致癌蛋白促進HCC發生和發展。此外,蛋白質翻譯后修飾通過修飾RNA甲基化reader蛋白參與調控m5C靶標,并影響腫瘤發生。SIAH1通過泛素化和降解YBX1間接促進m5C修飾RNA不穩定性,抑制上皮卵巢癌細胞的增殖、侵襲、遷移和藥物抗性。
幾項研究表明m7G tRNA修飾影響癌癥進展。METTL1/WDR4敲除破壞m7G tRNA解碼密碼子形成,降低mRNA翻譯效率并抑制肺癌、HCC、BC和鼻咽癌(NPC)進展。METTL1介導的HeLa細胞中mRNA內部m7G也增強其靶標mRNA的翻譯效率,而不依賴其對全局翻譯和tRNA甲基化的影響。METTL1催化的人類臍靜脈內皮細胞中VEGFA mRNA上的m7G組裝增加了VEGFA翻譯,并促進缺血后血管生成。這些研究表明內部m7G可能參與癌癥進展。
總體而言,RNA甲基化修飾在腫瘤發生過程中發揮著關鍵作用,但不同修飾是否在腫瘤發生中協同或拮抗作用值得進一步研究。此外,盡管許多由RNA甲基化修飾調控的靶標和通路具有腫瘤診斷和治療的潛力,但實際應用于臨床設置很少,需要進一步深入研究以促進臨床應用。
結論與展望
本文總結了包括m6A、m5C和m7G在內的三種甲基化表觀轉錄組的調控元件、分布特征、檢測技術以及生物學功能。由于RNA甲基化修飾在調控多種生理功能中的參與,主要概述了幾個熱點話題,包括配子發生、早期胚胎發生、免疫系統發育和疾病。盡管m6A和m5C RNA修飾的調控元件已經被發現并廣泛研究,但關于其他RNA甲基化修飾的信息相對較少,特別是其erasers和readers需要確定。隨著對其他RNA甲基化修飾動態性質的調控元件和機制的深入研究,對其功能機制的更清晰理解將有助于建立整體RNA表觀遺傳修飾調控網絡。
盡管已經開發了各種RNA甲基化修飾的測序技術,但它們中的大多數只能很好地捕獲和分析高豐度而不是低豐度轉錄本中的修飾信息,而后者將是一個有意義的突破點。此外,越來越多的研究表明RNA甲基化修飾參與多種生物過程和腫瘤發生。然而,幾乎所有的研究都是在群體細胞水平上進行的,這可能會忽視或扭曲單個細胞中的真實信息,限制對精確調控機制的理解,這對于指導疾病的精確靶向治療可能至關重要。因此,開發高通量單細胞RNA甲基化技術應該是該領域的創新點和推動力。此外,幾項研究也表明多種RNA甲基化修飾可能共同調控某些生物過程。因此,探索不同RNA修飾之間的相互調控關系可能是未來的一個熱點話題,這對于構建整體RNA表觀遺傳修飾調控網絡是必要的。目前能夠同時捕獲多種修飾的測序技術仍然相對較少,修飾類型的覆蓋范圍和靈敏度仍需改進。因此,開發新技術以同時檢測多種RNA表觀遺傳修飾是理解生物系統中整體作用模式的必要條件。
從文章的疾病部分來看,RNA表觀遺傳修飾及其調控因子在各種腫瘤的增殖、侵襲和遷移中發揮重要作用。此外,多個RNA甲基化修飾基因或其通路已被報道作為診斷或治療的潛在靶標,但其目前的臨床應用仍然非常有限。因此,需要加強特定RNA甲基化修飾抑制劑的研究,這可能是實現RNA甲基化修飾臨床轉化應用的關鍵點,盡管已有一些抑制劑的報道,如FTO抑制劑、Meclofenamic酸、FB23/FB23-2、MA2、Entacapone、DAC51、R-2HG、CS1/CS2、METTL3抑制劑(包括Compound 2/Compound 7)、STM2457、YTHDF2抑制劑(包括DC-Y13-27)和IGF2BP1抑制劑(包括BTYNB)。此外,幾項研究表明RNA甲基化修飾可以用于靶向編輯。在細胞水平上,表達與截短的METTL3甲基轉移酶結構域融合的核定位dCas13,與修飾的METTL3-METTL14甲基轉移酶復合體和特定導向RNA融合的細胞質定位,有能力在mRNA中將特定位點的腺苷修飾為m6A。Liu等人(2019b年)還設計了一個m6A動態編輯系統,將CRISPR-Cas9與單鏈m6A甲基轉移酶METTL3:METTL14融合以在特定位點編程m6A形成,同時將CRISPR-Cas9與ALKBH5或FTO融合以實現RNA的位點特異性去甲基化。然而,這些技術都是基于細胞內編輯相關蛋白的表達,使得直接治療如人類腫瘤等疾病變得困難,而其他RNA甲基化的RNA編輯技術大多未知。此外,考慮到RNA甲基化修飾對mRNA代謝和翻譯有顯著影響,研究體外RNA甲基化靶向編輯技術對于增強mRNA藥物的效力具有重要意義。
總之,對RNA甲基化修飾的調控蛋白組分、測序技術、功能機制、抑制劑和靶向編輯技術的深入研究將提供關于RNA甲基化修飾在生物發育和疾病發生中功能角色的廣闊視野,對于疾病診斷和治療也具有寶貴的視角。
標簽:
RNA甲基化
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





