16種最新細胞因子檢測技術介紹及對比
文章來源:生物屋,作者:屋中人
[細胞因子概述]
根據其作用,細胞因子也可分為促炎性或抗炎性,促炎細胞因子包括IL-1、IL-6、IL-8、IL-11、IL-12、TNF-α、IFN-γ和 TGF-β等,促進炎癥反應并傾向于刺激免疫活性細胞。相反,抗炎細胞因子,如 IL-4、IL-6、IL-10、IL-11、IL-13、IL-1受體拮抗劑 (IL-1RA)和 TGF-β,可抑制炎癥并抑制免疫細胞。一些細胞因子(例如 IL-6、IL-11、TGF-β)具有促炎和抗炎特性。
單一細胞因子可能由不同細胞分泌,并且根據具體情況具有促炎或抗炎活性,從而產生多種免疫反應。促炎細胞因子和抗炎細胞因子之間動態且不斷變化的平衡通過介導和調節炎癥在宿主免疫系統中發揮著重要作用,促炎性細胞因子有助于自身免疫性炎癥的引發和傳播,而抗炎性細胞因子則有助于炎癥的消退和自身免疫性疾病急性期的恢復。
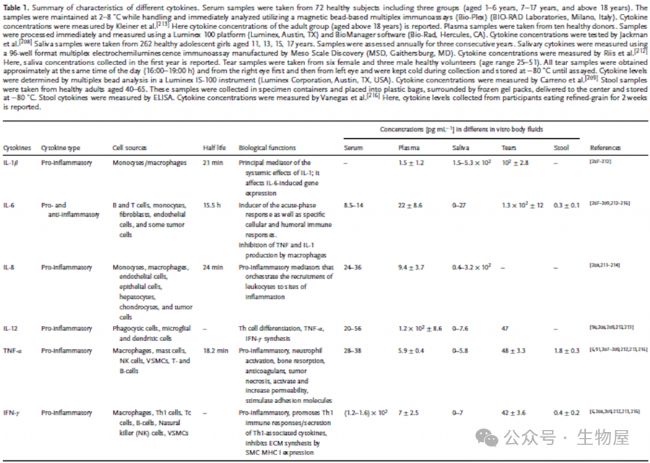
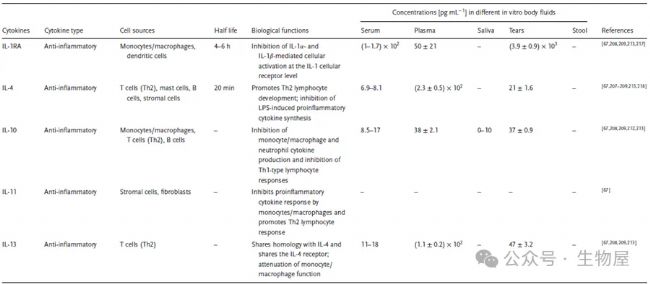
考慮到先天免疫和適應性免疫,促炎和抗炎細胞因子對免疫細胞分化、炎癥、血管生成、腫瘤發生、神經生物學、病毒發病機制、動脈粥樣硬化、癌癥和衰老都具有重要的生物學和臨床意義。
表 2說明了與各種細胞因子相互作用相關的不同典型疾病,這支持了細胞因子作為多種自身免疫和炎癥疾病的生物標志物的模型。
[影響生物體液中細胞因子定量的因素]
血樣處理對細胞因子穩定性的影響
已知大多數細胞因子在體內的半衰期很短(表 1),并且在樣品收集和制備過程中會快速降解,如果不采用適當的血液處理程序,這會導致假陰性信號。
血清和血漿源自全血,并在采血后進行不同的處理方式。血清是凝固血液的可溶部分,是血液凝固后獲得。在凝塊形成過程中,血細胞可能會被激活,細胞因子可能會從血小板釋放到血清中(例如 IL-1、IL-6 和 IL-8)。
血漿是抗凝血液的可溶部分,在從全血中分離血漿之前,白細胞可以在體外分泌細胞因子并改變血漿中細胞因子的水平。為了獲得血漿,在去除血細胞之前可以使用各種抗凝劑,例如乙二胺四乙酸(EDTA)和肝素鋰/鈉,從而抑制凝血和補體系統的激活。
研究表明,使用各種抗凝劑、內毒素管污染和血液處理(離心)延遲會對血漿或血清中的細胞因子濃度產生重大影響,并可能導致細胞因子測量值錯誤地增加或減少。例如,肝素(全血處理中的抗凝劑)可以誘導單核細胞釋放細胞因子;肝素鋰和檸檬酸鈉被證明會影響 IL-6 和 TNF-α的水平,這可能歸因于抗凝劑誘導的血細胞釋放細胞因子,特別是在肝素血漿中,但在 EDTA 血漿中則不然。
Friebe和Volk報道了血液樣本中TNF-α 、IL-6和IL-8的穩定性,發現肝素血漿和血清中TNF-α和IL-8的水平增加,但它們在EDTA血漿中的濃度穩定。相比之下,所有血型的 IL-6 水平在 8 小時內保持穩定。與血漿中的細胞因子水平相比,血清中較高的細胞因子水平表明凝血過程促進了細胞因子的釋放,這一結果與之前的研究結果一致。使用 EDTA 采集血漿似乎能帶來最一致的結果,并且更接近于血清中獲得的數據。總之,EDTA 血漿似乎最適合細胞因子測量,主要是出于穩定性原因。
此外,盡管血液采集和到達實驗室進行測試之間總是存在時間間隔,但通常建議快速制備樣品。
樣品儲存對細胞因子穩定性的影響
為了獲得可靠的結果,許多研究檢查了儲存對血液中細胞因子水平的影響。
Cohen等評估了樣品儲存對血漿中 IL-6、IL-10、IFN-γ和 IL-2 測量的影響,全血在室溫下儲存會導致細胞因子水平降低,但全血在 4°C 下儲存會導致細胞因子穩定性。
Vincent等最近評估了血清冷凍前儲存時間對細胞因子穩定性的影響,并將結果與從系統性紅斑狼瘡 (SLE) 患者獲得的血漿樣本進行了比較。在這項研究中,患者的血清和血漿樣本在冷凍前預先在 4°C 下儲存 0-30 天的預定時間,幾乎所有分析的細胞因子(12 種中的 11 種)在冷凍前在 4°C 下保存長達 30 天時都是穩定的,只有單一分析物趨化因子(C-C 基序)配體 19 (CCL19) 從 4 °C 儲存的第4天起顯示出顯著的信號衰減。與血漿相比,大多數分析物在未分離的血清中的細胞因子水平更穩定,但 IL-37 除外,它在血漿中似乎稍微更穩定,本研究建議未分離的血清樣品在 4 °C 下最多可保存 3 天。
Valaperti 等研究表明許多細胞因子在室溫下采集樣品后可以在短時間內保持穩定,建議快速處理和冷凍新鮮采集的全血樣本,以避免假陽性結果。
Panicker 等研究了在采集宮頸粘液時速凍和冷藏的效果,TNF-α、IFN-γ和 IL-1β在冷藏樣品之間存在顯著差異,顯示每種細胞因子的水平較高,這一發現表明在收集后立即冷藏粘液樣本可以更好地保存宮頸粘液中的細胞因子。
凍融對細胞因子穩定性的影響
Simpson等總結了樣品在不同溫度下儲存或暴露于重復凍融循環時 33 種細胞因子的穩定性,由于通常使用預先解凍的樣品,因此凍融穩定性評估是細胞因子測量的一個重要考慮因素。
經過多次凍融循環后,細胞因子的水平可以穩定、增加或減少,并且每種細胞因子的水平都不同。一般來說,大多數細胞因子在最多3次凍融循環中保持穩定。
Jae 等評估了反復冷凍和解凍對不同細胞因子的血漿和血清濃度的影響,在反復凍融循環期間,血漿和血清中的 IFN-γ和 IL-8水平保持穩定。然而,某些細胞因子的濃度隨著每個連續的凍融循環而變化,在三個循環后變得顯著。
Henno 等研究了冷凍和解凍對 EDTA 和檸檬酸鹽血漿中細胞因子穩定性的影響,并報道血漿冷凍和解凍最多3次后細胞因子水平沒有顯著變化。然而,冷凍和解凍6次后,EDTA血漿中的 IL-1β水平出現輕微但具有生物學意義的下降,而 CCL5 水平則有所上升,這表明樣品處理最多進行3次凍融循環,以便進行準確的細胞因子分析。
一般來說,為了保持細胞因子水平穩定以進行準確測量,樣品應進行最小程度的凍融。
可溶性細胞因子受體對細胞因子檢測的拮抗和激動作用
可溶性細胞因子受體或細胞因子結合蛋白(例如 IL-18 binding protein,IL-18BP)由膜結合受體的蛋白水解裂解或由細胞釋放,并出現在生物體液或組織培養上清液中的選擇性剪接 mRNA 的翻譯產生,這些受體作為競爭性抑制劑,在體外對其各自的細胞因子具有拮抗作用。
有許多例子說明大多數可溶性細胞因子受體可以干擾細胞表面受體并與細胞表面受體競爭游離細胞因子的結合,因此細胞因子受體阻止細胞因子結合其特定的膜受體并產生信號,從而抑制細胞因子活性。
可溶性細胞因子受體的拮抗作用可能在免疫反應的下調和某些細胞因子“過度活躍”的抑制中發揮重要作用。例如,Levine 報道可溶性 IL-1 受體可以通過優先結合 IL-1β 來減弱過度的 IL-1 生物活性。
盡管大多數可溶性細胞因子受體具有作為細胞因子的競爭性抑制劑的能力,但一些受體可能在體內增強其自身細胞因子的活性或具有與作為載體蛋白的附加作用一致的特性。
這種類型的可溶性受體通過與細胞因子的信號轉導亞基相互作用來增強而不是抑制細胞因子的活性,從而產生信號(即可溶性 IL-6 受體 (sIL-6R) 和糖蛋白 130 (gp130))。與可溶性 IL-1 受體對 IL-1 信號的拮抗作用相反,Levine 報道了 sIL-6R 對 IL-6 信號放大的激動作用。因此,細胞因子與其可溶性受體的結合可以提高細胞因子的分子穩定性,從而導致活性降低。這一假設與生物活性 TNF三聚體與可溶性 TNF 受體的結合減緩其分解為無活性單體的觀點一致,從而導致長期孵育后生物活性增加。
可溶性細胞因子受體的這些拮抗和激動作用可能會影響細胞因子的檢測。一項研究表明,在某些情況下,例如炎癥性疾病,生物體液中可溶性細胞因子受體的存在可能會干擾免疫測定,例如基于微珠的多重免疫測定和 ELISA。
幾種細胞因子,特別是IL-1β、TNF-α和IL-6,可能與可溶性受體結合,形成免疫測定無法識別的結合形式。例如,在癌癥患者中,競爭性免疫測定通常可檢測到 TNF-α,但 ELISA 測定在癌癥患者血漿中未檢測到TNF-α,這與生物測定數據一致。Engelberts等研究了這些效應,并表明與 p55 TNF 受體結合的TNF-α不能被夾心 ELISA 測定很好地識別。
此外,就 IL-6 而言,血漿中含有幾種結合形式的IL-6,分子量范圍為50-150 至 400-500 kDa,與某些抗血清反應較差,并且由IL-6與可溶形式的IL-6 受體形成復合物,這引發了關于血漿中 IL-6 實際濃度的爭議。大多數免疫測定發現正常血漿中IL-6的濃度無法檢測到或范圍在10-75 ng/L之間,在膿毒癥中水平上升至1-2 µg/L,或者在腦膜炎球菌疾病中甚至是200 µg/L。
然而,May等報道大多數檢測僅識別低分子量的 IL-6,使用識別高分子質量形式的單克隆抗體檢測,在正常血漿中的 IL-6 濃度為 1-10 µg/L,并且在骨髓移植后患者的血清樣本中,濃度為 5-10 mg/L。
因此,有必要確切地知道測定法正在測量細胞因子或細胞因子復合物的哪些成分,并且最好應考慮可溶性受體的水平。
[細胞因子檢測技術]
Revvity HTRF技術
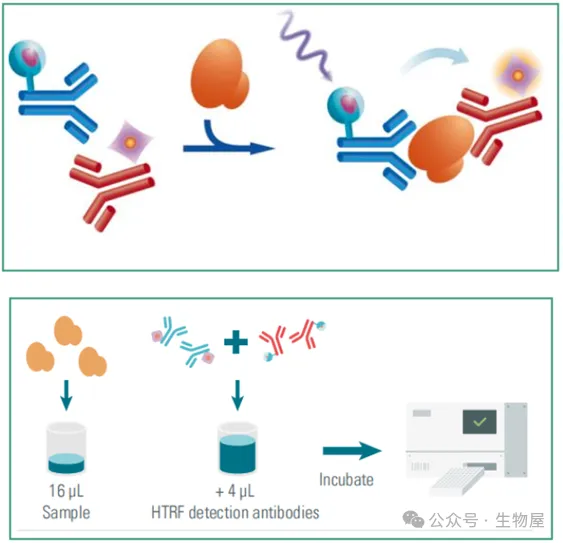
均相時間分辨熒光(Homogeneous Time-Resolved Fluorescence, HTRF)技術采用夾心分析法檢測,使用兩種不同的特異性抗體,一種用Eu(供體)標記,另一種用d2(受體)標記。當標記的抗體與同一抗原結合時,供體用光源(激光或閃光燈)激發,觸發向受體的熒光共振能量轉移(FRET),進而在特定波長(665nm)發出熒光。這兩種抗體與樣本中存在的T細胞因子結合,從而產生FRET。信號強度與形成的抗原-抗體復合物的數量成正比,因此也與檢測的細胞因子濃度成正比。
實驗僅需在空板中加入16μl檢測樣本,然后加入4μl檢測抗體孵育2小時后即可使用酶標儀進行讀數。
HTRF技術檢測細胞因子試劑盒體系中使用相同的buffer和低樣本的需求,所以,實驗允許從同一上清液中平行地定量多種細胞因子,可同時檢測3個以上的細胞因子。僅需將樣本加入孔板內,依次加入不同檢測試劑即可實現不同細胞因子的檢測。
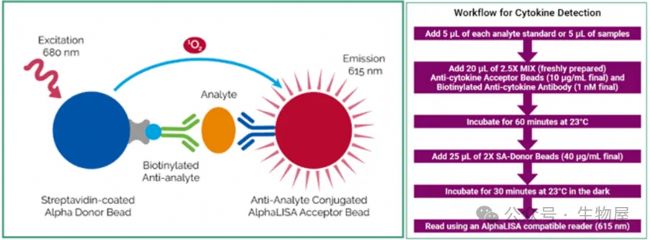
Revvity AlphaLISA技術
AlphaLISA技術同樣采用夾心法檢測細胞因子,一個抗體被生物素化并與鏈霉親和素包被的供體微珠結合,受體微珠則直接與另一個抗體結合。細胞因子存在的情況下,抗體與細胞因子結合使供體和受體微珠靠近,供體微珠的激發使得單線態氧擴散至受體微珠,從而發射615nm波長的光信號,AlphaLISA的檢測信號與樣本中存在的細胞因子的數量成正比。
AlphaLISA技術是均相體系、操作方便、無洗滌步驟、2h完成檢測;節省樣本,樣本需求低至5μl;體系穩定,批次間重復性高;靈敏度高,實驗窗口大,線性范圍寬;高通量,兼容96/384/1536孔板。
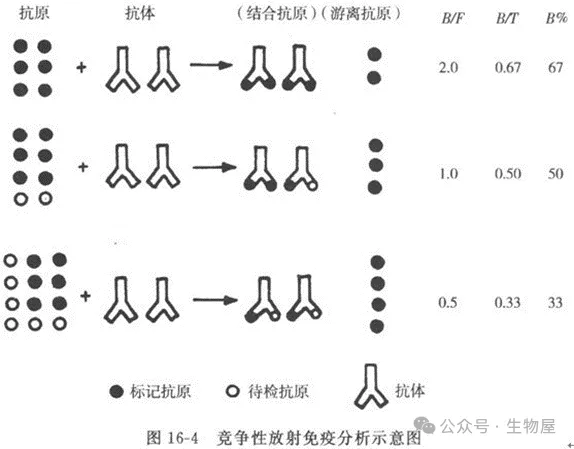
放射免疫分析法 (RIA)
放射免疫分析法對生物樣品中的細胞因子定量具有較高的敏感性和準確性,就像其他免疫測定法,RIA法需要先標記的細胞因子特異性抗體和/或標記的細胞因子或其受體與放射性同位素(主要是 I125) ,然后再進行檢測。
RIA的一個特殊優勢是它對細胞因子的生物活性區域具有特異性,而不是對免疫活性區域的特異性,免疫活性區域可能很少或不參與細胞因子活性的表達。
但是,涉及使用放射性同位素的測定法大部分已被非放射性測定法所取代,因為考慮到輻射照射、勞動密集耗時的程序和昂貴的設備要求。
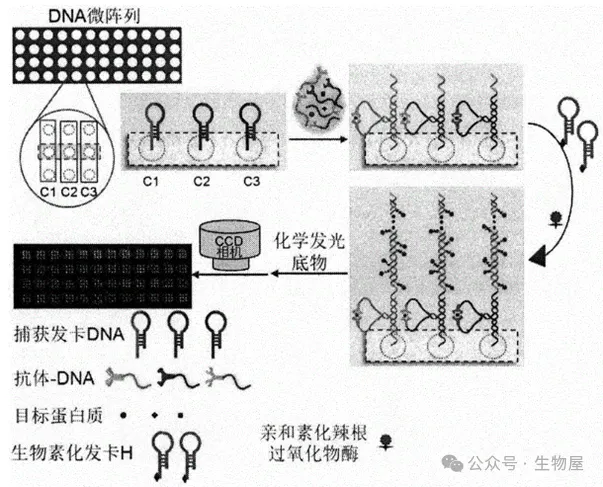
DNA微陣列
DNA芯片或微陣列的廣泛應用允許在mRNA水平上同時分析來自不同組織或細胞的數千個基因的表達,該技術可用于確定表達細胞因子的基因在響應外部信號、細胞應激和各種病理條件時的上調。
微陣列是一種基于微雜交的檢測方法,通過構建DNA微陣列,利用抗體-DNA與目標蛋白質的夾心免疫反應,產生鄰位效應促使DNA雜交,進一步打開DNA微陣列上的捕獲發卡DNA并引發雜交鏈反應,通過生物素-親和素反應,使得大量辣根過氧化物酶(HRP)在DNA微陣列上結合,產生化學發光信號放大,實現多種蛋白質的同時、高靈敏圖像檢測。
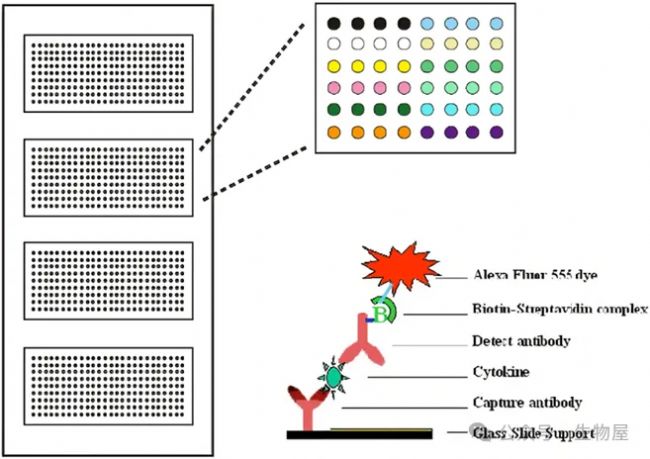
抗體芯片
抗體芯片是一種可靠而穩健的方法,用于從復雜蛋白質組中提取多重數據,具有高靈敏度、高特異性和高通量。第一個抗體芯片是由Chang于1983年開發的,在1cm2面積的玻璃蓋玻片上發現了10×10和20×20網格中的抗體。
當前抗體芯片多用三明治夾心或直接標記,使用化學發光或者熒光進行檢測。三明治夾心抗體芯片使用抗體對,必須驗證和檢查與陣列中所有其他抗原/抗體的交叉反應性。
出于這個原因,芯片一般涵蓋10-80個分析指標,通過組合多個陣列,可以檢測和定量人體樣品中多達1000種分泌的人類蛋白質,如細胞因子、趨化因子、脂肪因子、生長因子、蛋白酶、可溶性受體和其他蛋白質。此外,小鼠、大鼠、牛、羊等不同種屬的芯片,也正在開發中。
單分子技術
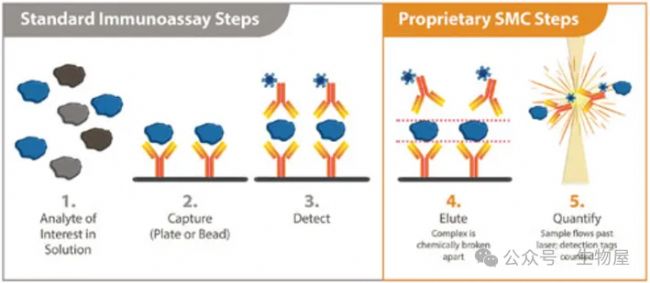
單分子計數(Single Molecule Counting, SMC)技術最初由Singulex公司開發,將基于磁珠的免疫測定與單分子計數檢測相結合。
經典的 96 孔板中,基于磁珠的免疫測定法用于形成夾心復合物(捕獲抗體-抗原-熒光標記的檢測抗體包被的磁珠)。然后,破壞夾心復合物,并使用專有的數字SMC技術分析洗脫的熒光標記檢測抗體,使用激光共聚焦顯微鏡數字計數器對單分子熒光信號(“閃光”)進行計數。
SMC 檢測試劑盒可檢測人體樣品中的細胞因子,靈敏度為sub-pg/mL。
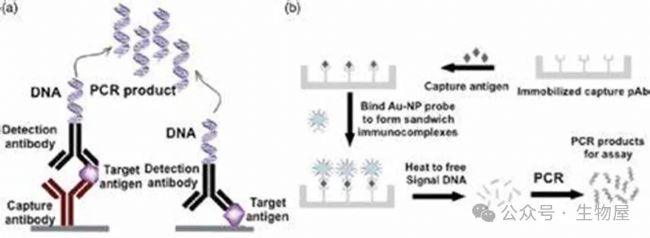
免疫PCR技術
免疫PCR最初描述于1992年,結合免疫測定的高特異性和聚合酶鏈反應(PCR)的高靈敏度。與傳統ELISA中底物和產物之間的線性關系相比,免疫PCR可實現信號指數級放大,靈敏度比普通ELISA高1000倍。
夾心形式的免疫PCR,與夾心ELISA相同,在捕獲抗體包被的96孔板中進行。與 ELISA 測定中用于檢測的酶抗體偶聯物不同,免疫 PCR利用與 DNA 共價偶聯并通過定量 PCR 檢測的檢測抗體。
雖然免疫PCR的優點是顯而易見的(例如,超靈敏、良好的重現性和普遍性),但其主要局限性是背景高且需要大量的洗滌步驟。
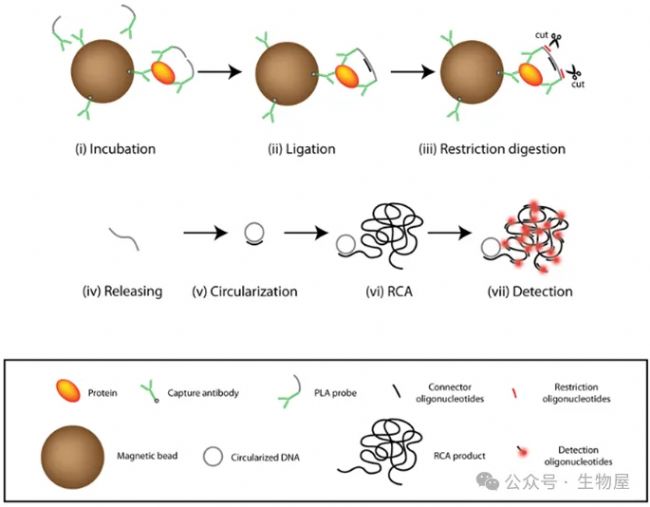
者鄰近連接技術
者鄰近連接測定(Proximity ligation assay, PLA)最初由Fredriksson等開發,使用對血小板衍生生長因子(PDGF)具有親和力的DNA適配體來量化PGDF。
同源二聚體PDGF-BB可以容納兩個適配體分子,每個分子都具有引物結合的延伸和額外的延伸,在雜交到共同的連接器寡核苷酸時進行連接。
PCR產物的實時檢測可檢測到低至10-20 pmol濃度的細胞因子/蛋白。
免疫磁減量檢測
2006年首次描述了磁減量生物分析技術,目前的免疫磁減量(Immunomagnetic reduction, IMR)測定,將捕獲抗體固定在磁性納米顆粒,這種納米顆粒均勻分散在溶液中,并通過施加外部多個磁場(即易受磁場影響)而振蕩。加入分析樣品后,由于抗體捕獲分析物分子,納米顆粒變得更重,導致納米粒子對磁場的響應降低,降低程度對應于樣品中存在的目標分子的量,能夠檢測pg/mL濃度的細胞因子/蛋白。
IMR測定的主要優點是它是一種簡單的技術,不需要洗滌步驟即可去除未結合的試劑,具有高度的靈敏度和定量性。例如,淀粉樣蛋白-β1-42和α-突觸核蛋白的濃度范圍分別為1-50000 pg/mL和0.3 fg/mL-300 pg/mL。
與夾心免疫測定不同,IMR測定僅使用一種抗體(“捕獲”抗體),測定特異性通過納米顆粒的振蕩運動來確保,其中微弱的非特異性抗原-抗體相互作用由于施加磁場在納米顆粒上引起的離心力而被破壞。
IMR測定目前旨在識別疾病的早期階段,例如神經退行性疾病、癌癥和病毒感染。
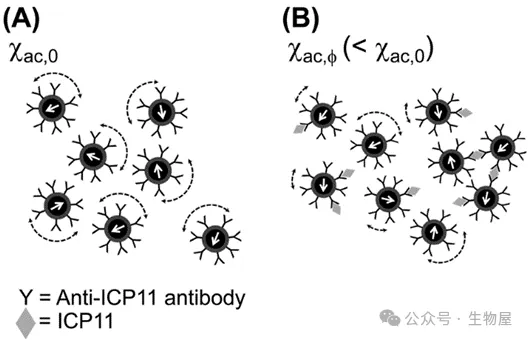
圖1. 免疫磁減量(IMR)檢測原理
每個磁性納米粒,具有針對目標蛋白的抗體的生物功能,在與ICP11結合之前,在施加的交流電(AC)磁場下振蕩。χac,0:磁性納米粒的原始多頻交流磁化率。(B)當這些磁性納米粒與靶蛋白結合時,它們變得更大,有些甚至形成簇狀,這降低了試劑的交流磁化率。χac,φ:磁性納米粒與靶蛋白結合后的磁化率。微流體技術
Usuba 等制造了一個具有微流體結構的光子芯片(Photonic lab-on-a-chip, PhLoC),用于快速檢測 IL-2。
PhLoC包括光學元件、測量室、空氣旁路和其他用于引入和沖洗溶液的流道,流道僅能夠將溶液引入測量室并改善抗體在測量室表面上的固定,淋巴細胞分泌的 IL-2 可在 15 min內測量,濃度范圍為 50-1000 pg/mL。
在芯片實驗室設備中,微流控技術為實現更快速、更高效的體外檢測提供了有效的解決方案,因為1)微流控通道具有較大的表面積與體積比,加速了抗原抗體反應;2)微流控技術平臺最大限度地減少了昂貴試劑和珍貴樣品的消耗;3)可以通過將多個傳感器集成到通道中來實現多重分析。
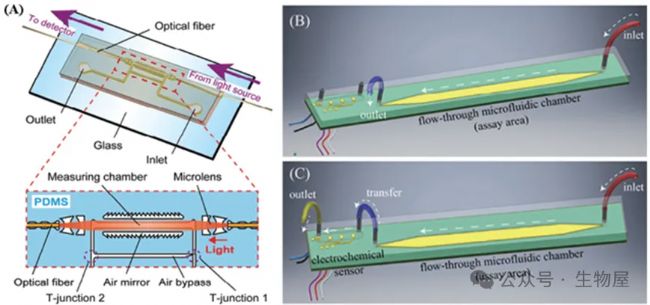
圖2. 不同類型的微流控法檢測細胞因子原理圖
具有集成光學和微流體組件的 PhLoC 示意圖;B) 測定初始階段單位細胞流體排列的 3D 圖形表示;C) 測定第二階段期間單元電池流體布置的 3D 圖形表示,詳細說明了 Proxim 手持式儀器的測定區域和電化學傳感器測試盒之間的流體端口和連接。質譜細胞術
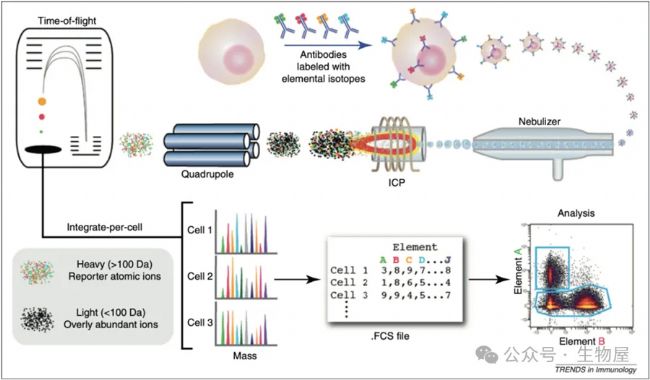
質譜細胞術是將流式細胞術和元素質譜技術兩個實驗平臺相結合的一種新技術,已經越來越多地用于快速分析單個細胞,這種分析使得能夠在單個細胞分辨率下測量超過40個細胞參數,顯著促進了生物活性分子對細胞群體的高維、定量分析,從而增強了細胞學評估復雜細胞系統和過程的能力。
質譜細胞術利用了稀土金屬同位素作為與抗體結合的標記,而不是熒光物質。由于具有離散讀數的特性,質譜細胞術中同位素作為報告物質的使用增加了每個細胞可測量的參數數量。此外,該平臺具有數量上的準確性,其靈敏度在四個數量級上是線性的。因此,高維質譜細胞術能夠以單細胞粒度同時、高靈敏度地測量來自先天和適應性免疫細胞亞群的多種細胞因子。
Baxter等開發了一種全面的質譜細胞術分析方法,用于單次分析外周全血中的免疫表型和細胞因子產生,這種單細胞蛋白質組學方法使得能夠同時評估多種免疫細胞類型,并在患者特異性的“病原性”外周血液環境中檢測到各種細胞因子的變化。通過質譜細胞術分析外周血,還可以確定特定患者異常調節的細胞亞群及其異常的細胞因子產生,這使得治療方案的個性化成為可能。因此,可以在體外測試特定的治療選擇,以評估其免疫調節的有效性。
該技術也存在一些限制,包括對每個探針需求嚴格的金屬同位素(沒有前向或側向散射的等效物)以及破壞性(沒有排序細胞恢復的可能性),當前質譜細胞儀的配置也具有有限的細胞透過率,因此需要更多的輸入細胞數量。
基于熒光的細胞因子生物傳感器
熒光生物傳感器是一種基于與靶分子相互作用導致熒光特性發生變化的檢測方法,它廣泛用于分析傳感和光學成像。
當靶分子被其受體識別時,熒光信號(如熒光強度、發射波長和熒光壽命)可以通過不同機制(電子轉移(eT)、電荷轉移(CT)或能量轉移(ET)過程)以猝滅、增強或熒光最大值移位的形式被觀察到。
由于其高靈敏度、快速響應時間、技術簡易性、多種染料選擇用于多重檢測以及能夠以廉價的方式實現現場和實時檢測等特點,熒光免疫分析已成為定性和定量檢測細胞因子的最廣泛應用方法之一。
Rahimian等報道了一種微囊化熒光免疫分析,用于檢測經最少處理的血液中的IFN- 和TNF- ,檢測限為分別為14.8×10-12M和14.4×10-12 M。白細胞分泌的細胞因子擴散到微囊的核心,并被核心中的修飾抗體的珠子捕獲,目標分子通過與二級熒光標記抗體染色來檢測。封裝的微珠的熒光強度與其在血液中的濃度相關,這種封裝的免疫分析代表了在血液等高度復雜環境中保持感測元件操作的一種有前途的策略。
為了通過在細胞膜上應用捕獲技術來檢測單個細胞的細胞因子分泌,提出了細胞表面ELISA(OnELISA)的配置。這已經用于鑒定和篩選高細胞因子分泌細胞,利用商業可獲得的標記有dragon green 熒光的磁珠,OnELISA是一種夾心免疫傳感器,能夠在單細胞水平(0.1 pg/mL)檢測IL-6。這些細胞表面生物傳感器為識別和篩選高細胞因子分泌提供了有前途的方法,用于再生醫學應用。
在細胞內細胞因子檢測方面,熒光生物傳感器已被應用。例如,一種基于石墨烯量子點(GQDs)的簡單而敏感的“開關式”納米傳感器已經被開發用于檢測IFN- 的細胞內存在,具有2 pg/mL的靈敏度。聚集GQDs的自熄滅會關閉熒光,而由于靶分子IFN- 的存在引起的GQDs的解聚會導致與IFN- 濃度成正比的熒光恢復。這些熒光納米傳感器已成功用于活PBMC和BV2細胞中的細胞內IFN- 的檢測作為基本模型,并且可以作為針對一系列細胞內細胞因子的通用開啟傳感探針。
利用聚集誘導發光劑的性質,報道了一種用于測量由活細胞分泌的細胞內IFN- 的熒光適配體傳感器,其在體外條件下的低檢測限為2 pg/mL。這種適配體傳感器由顯示強紅色發射的熒光素(TPEN3)和具有高親和力的IFN- 的寡核苷酸組成,探針能夠在低濃度下定位細胞內IFN- ,并且成功用于實時成像,表現出優良的細胞透過性和生物相容性以及低毒性。
熒光基生物傳感器具有靈敏度高、響應速度快、非破壞性和實時檢測等優點。然而,使用基于熒光的光學生物傳感器的主要缺點是背景干擾和樣品標記需要熒光試劑,這增加了操作的時間和成本。
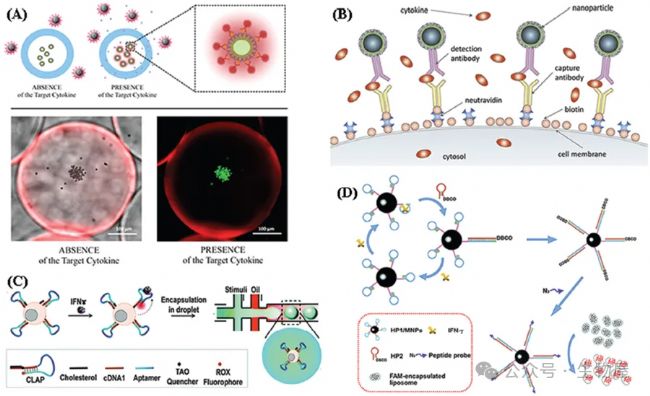
圖3. 基于熒光的細胞因子生物傳感器
微膠囊感測的示意圖;B)磁性熒光納米顆粒被細胞生物素化表面上的抗體捕獲的試驗;C)用于在單細胞水平上測量細胞因子分泌的T細胞表面寡核苷酸傳感器的示意圖;D)利用由CHA激活的三種靶標響應性脂質體的熒光法檢測IFN- 的示意圖。基于SPR的細胞因子生物傳感器
表面等離子共振(Surface Plasmon Resonance, SPR)廣泛應用于臨床分析中,因其提供了一種無標記且實時的方式來測量生物分子間的相互作用。
在SPR系統中,分析物被生物分子識別元素捕獲在SPR生物傳感器的金屬表面上,改變了金屬表面的折射率,折射率的變化可以通過不同的光學手段(如強度調制、角度調制、波長調制、相位調制,甚至偏振調制)進行精確測量。
作為一個優點,可以通過測量共振谷的光譜偏移來連續監測分析物的濃度,而無需額外的標記。由于其高靈敏度和能夠實時進行無標記測量,基于SPR的生物傳感器已成功應用于疾病診斷中的細胞因子測量。
Wu等報道了一種用于實時監測人CD4+ T細胞捕獲和它們動態產生IFN- 的無標記SPR生物傳感器,從而能夠以高靈敏度(85.5%)和特異性(97.7%)診斷結核病(TB)的臨床樣本。CD4 + T細胞被抗CD4抗體捕獲,含有TB特異蛋白的培養基被注入以刺激捕獲的CD4 + T細胞釋放IFN- 。當添加TB特異蛋白時,SPR信號實時監測,允許對CD4 +細胞分泌的IFN- 蛋白進行定量。
Liu等制備了一種局部表面等離子共振(LSPR)免疫分析用于檢測刺激的巨噬細胞分泌的細胞因子(IL-6和TNF- ),利用電子束光刻和海藻糖聚合物直接在硅襯底上載入抗體。這種夾心免疫分析可通過暗場顯微鏡進行可視化,利用銀增強金納米粒子次級抗體的表面等離子共振,成功地展示了在單個芯片上對IL-6和TNF- 的多重測量,具有很高的特異性和靈敏度(TNF- 為5 pg/mL,IL-6為50 pg/mL),這種直接制備用于細胞因子檢測的捕獲抗體圖案的方法對于生物傳感應用具有潛在價值。
Chen等開發了一種無標記、多陣列局部表面等離子共振(LSPR)光學生物傳感器芯片,用于大規模并行高通量檢測多種細胞因子(IL-2、IL-4、IL-6、IL-10、IFN- 、TNF- )。該器件采用易于實現的一步微流體圖案化和金納米棒(AuNRs)的抗體偶聯來制備,納米棒微陣列制備是通過一步微流體圖案化技術完成的,該技術利用了納米棒與基底表面之間的靜電吸引相互作用。隨后,這些納米棒微陣列被集成在一個具有8個并行微流體檢測通道的微流體芯片中,包括用于試劑加載和清洗的入口和出口端口。特定抗體通過硫化交聯劑和EDC/NHC化學反應與圖案化的AuNR微陣列結合。目前的芯片設計集成了480個AuNR微陣列傳感器點,制備的LSPR微陣列芯片然后在暗場顯微鏡和掃描電子顯微鏡(SEM)下成像,這種LSPR生物傳感技術允許從1μL血清樣品中對濃度為5-20 pg/mL的細胞因子進行高靈敏度的定量測量。
Zhu等報道了細胞捕獲和基于LSPR技術的金帽納米柱結構環氧乙烯共聚物(COP)薄膜的簡單協同集成,用于IL-6的檢測,靈敏度為190.2 nm/RIU,檢測限為10 ng/mL。在這項研究中,新鮮培養的IL-6過表達Jurkat細胞被用于評估這種基于LSPR的生物傳感器的靈敏度和能力,培養的細胞直接被厚的COP細胞捕獲芯片捕獲,并開始釋放IL-6,IL-6將立即與納米柱狀LSPR檢測薄膜表面的抗體結合而無需刺激。制備的裝置顯示了實時監測細胞因子的潛力,這將允許我們識別受測單個細胞的生存能力和生物變異。
雖然SPR在蛋白質檢測方面有著廣泛的應用,但SPR傳感器普遍面臨的一個常見挑戰是傳感器上產生的非特異性結合事件產生的信號問題,這是一個需要通過應用防污策略進行更多研究的問題。

圖4. 基于表面等離子共振的細胞因子生物傳感器
CD4+ T細胞捕獲和IFN-γ釋放的實時監測的示意圖。B)用于多重細胞因子檢測的直接蛋白圖案的示意圖C)LSPR微陣列芯片的示意圖D)集成的局部表面等離子共振(LSPR)細胞因子檢測的示意圖。基于SERS的細胞因子傳感器
表面增強拉曼光譜(Surface Enhanced Raman Spectroscopy, SERS)已成為一種強大的振動光譜技術,通過放大由局部表面等離子體激發產生的電磁場,可以對低濃度分析物進行高靈敏度的檢測。
基于SERS的生物傳感器作為一種流行且有前景的方法,由于其高靈敏度、高特異性和多通道非破壞性檢測能力等優點,已被廣泛用于細胞因子的快速和定量測量。
Lai等利用磁珠pull-down法結合SERS進行了TNF- 的快速敏感檢測,穩定、單分散且高靈敏的SERS標記由純化的包埋在二氧化硅中的小金納米顆粒團聚體制備而成,二氧化硅的包埋提高了SERS標記的穩定性,使信號重復性好,并為后續的生物偶聯提供了堅固的表面,具有高特異性、選擇性和對TNF- 濃度的靈敏度可達1 pg/mL。通過識別膠體混合物中多達三種不同拉曼報告物的特征拉曼峰和條形碼信號,顯示了這些SERS標記作為靈敏報告物在多通道生物分析應用中的巨大潛力。
Kaminska等開發了一種基于硅藻生物硅質為免疫基質、以DTNB(即5,5'-二硫代二硝基苯酸)為拉曼報告物的SERS免疫分析方法,用于血漿中IL-8的檢測。這些帶有DTNB標記的免疫性金納米顆粒可以與生物硅質材料上固定的IL-8抗原和抗體形成夾心結構,建立的SERS免疫分析法具有較低的檢測限(6.2 pg/mL),為臨床環境中細胞因子的超靈敏和高特異性檢測提供了寶貴的平臺。
為了對多種細胞因子進行敏感和同時檢測,Li等開發了由金核、拉曼報告細胞和銀殼組成的SERS納米標記,用于敏感和多通道識別從淋巴瘤細胞分泌的細胞因子(IFN- 、TNF- 和IL-10),該SERS免疫分析法顯示出較高的靈敏度(4.5 pg/mL)和良好的特異性。更重要的是,與許多傳統方法相比,這種夾心免疫分析策略的響應速度更快,因為它具有多通道功能,而其檢測限和準確性與標準的ELISA法相當。
在另一項與動脈粥樣硬化(AS)相關的疾病診斷工作中,報道了一種基于紙張的SERS分析法,用于敏感的雙重細胞因子(IL-10和MCP-1)檢測,該SERS生物傳感器結合了一種利用聚丙烯(PP)基底和聚四氟乙烯(PTFE)涂層制成的聚合物膜的納米多孔網絡膜作為基底,以及SERS納米標記作為信號檢測探針以及夾心設計,它表現出對人血清中細胞因子目標的靈敏和特異性識別和定量測量的優秀感測特性。在這項工作中,增加的表面積提供了高載量的捕獲抗體,從而增強了靈敏度。由于夾心設計中的兩層金納米顆粒的獨特特點,產生了金納米顆粒之間的小間隙;這產生了“熱點”效應,可以增強SERS信號,從而實現了低檢測限(0.1 pg/mL)的高靈敏度檢測。因此,基于紙張的SERS分析平臺可以潛在地用于細胞因子的檢測,甚至作為商業單位,并且在復雜環境中進行多通道目標分析具有巨大潛力。
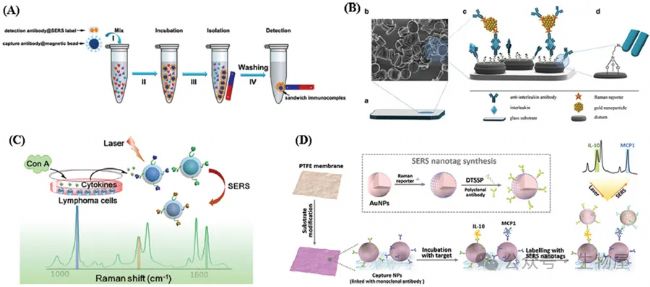
圖5. 基于表面增強拉曼光譜的細胞因子傳感器
用于檢測淋巴瘤分泌的細胞因子的多重SERS納米標記的示意圖;B)用于檢測淋巴瘤分泌的細胞因子的多重SERS納米標記;C)用于檢測淋巴瘤分泌的細胞因子的多重SERS納米標記;D)基于紙基底的 MCP-1 和 IL-10 雙重檢測的檢測方法工作流程圖。基于電化學的細胞因子生物傳感器
電化學轉換作為一種生物傳感技術非常受歡迎,與其他方法相比,電化學技術具有自身的優勢,如低成本,在安培計量中特別具有高靈敏度,并且便于設備微型化。電信號的輸出可以是阻抗、電流和電壓,許多電化學生物傳感器已經被開發用于細胞因子的檢測。
Filik等總結了近期針對TNF- 測定的多種電化學測定法的發展,展示了各種新穎的感應策略,用于改進免疫電化學傳感器以選擇性地檢測細胞因子。Sanchez-Tirado等報道了一種簡單而靈敏的安培計量免疫傳感測定法,利用植入電化學支架的出色性能,用于唾液中IFN- 的共價固定生物分子的檢測。圖6A顯示了這種電化學免疫傳感器的制備步驟以及安培計量檢測中涉及的反應。屏印碳電極(SPCE)通過循環伏安法將對氨基苯甲酸偶氮鹽接枝到電極表面(步驟1)以共價固定捕獲抗體(步驟2),剩余的自由活性位點用BSA阻斷(步驟3)。在捕獲IFN- 后,使用生物素-抗IFN和過氧化物酶標記的鏈霉親和素進行夾心型免疫分析(步驟4)。通過在氫醌(HQ)存在下向電極表面添加過氧化氫溶液(步驟5)進行安培計量測定,獲得了1.6 pg/mL的低檢測限,用于IFN- 的定量。這種電化學免疫傳感器所展示的分析性能,包括可丟棄性和使用袖珍式電化學儀器的可能性,使其具有吸引力,用于開發用于現場測量唾液中IFN- 的POC系統。另一項發展是基于氧化石墨烯(GO)薄膜修飾的電化學納米夾心裝置,用于IL-6的檢測。
為了通過電化學測定實現多種細胞因子的測量,Shen等制造了無標記的電化學生物傳感器,用于帕金森病小鼠模型中多種細胞因子的體內檢測。Wei等還開發了一種電化學免疫傳感器,用于同時檢測三種細胞因子IL-6、IL-1 和TNF- 。玻璃碳(GC)表面被功能化,將4-羧基苯和4-氨基苯磷酸膽堿(PPC)的混合層附著為感測界面,用于固定IL-6、IL-1 和TNF- 的捕獲單克隆抗體。捕獲IL-6、IL-1 和TNF- 后,引入載有氧化還原探針(尼羅藍(NB)、亞甲基藍(MB)或二茂鐵(Fc))和特定細胞因子的抗體的GO。通過監測信號報告物的電化學信號的變化實現對細胞因子的定量檢測。該系統成功地用于同時檢測,表現出良好的靈敏度、選擇性、穩定性和恢復性能。Sanchez-Tirado等人開發了一種雙壁碳納米管功能化的雙SPCE,用于血清和唾液中IL-1 和TNF- 的同時檢測。圖6B顯示了雙電化學免疫傳感器的制備方案。在每個雙SPCE表面滴加Mix&GO后,固定了IL-1 和TNF- 的抗體,然后通過BSA阻斷電極表面上剩余的活性自由位點。然后,通過將目標細胞因子和生物素化的檢測抗體組合來實現夾心型分析。進一步通過聚-HRP-Strept共軛實現過氧化氫作為HRP底物和HQ作為氧化還原介質的IL-1 和TNF- 的安培計量確定。
對于免疫傳感器,基于結構轉換的適配體的電化學生物傳感器也可以實現實時細胞因子的檢測。特別是,為了提高基于適配體的細胞因子生物傳感的靈敏度和穩健性,表面納米制造和比率測量是重要的。Liu等開發了一種基于外切酶介導的表面啟動酶聚合(SIEP)結合[Ru(NH3)6]3+用于IFN- 檢測的適配體基電化學免疫傳感器。首先,電極表面被金納米顆粒-石墨烯納米復合材料(Au-Gra)功能化。然后,在修飾的電極表面上固定了雜交的雙鏈DNA(dsDNA),然后通過己烷硫醇溶液(HT)阻斷了非特異性位點。添加IFN- 后,適配體從dsDNA中被釋放出來,并被RecJf外切酶選擇性地消化,使IFN- 釋放用于目標回收。然后,在循環過程中形成了大量的單鏈捕獲探針。隨后,在電極表面的單鏈捕獲探針上捕獲了大量的信號探針標記的Au@Fe3O4(SP-Au@Fe3O4)。最后,通過端尾脫氧核苷酸轉移酶(TdT)介導的級聯延伸,形成了長鏈ssDNA結構,以[Ru(NH3)6]3+的靜電吸附來產生電化學信號。該提議的適配體傳感器顯示了0.003 ng/mL的低檢測限,為IFN- 和其他細胞因子的可靠檢測提供了簡單、靈敏和強大的工具。此外,該傳感器具有臨床診斷、傳染病監測和現場測試的潛力。
Ni等開發了一種穩健的適配體傳感器,通過修飾亞甲基藍負載的石墨烯氧化物(GO/MB)和鐵素標記的適配體到GC電極上,實現了在血清中VEGF的雙電化學信號模式比率定量測定,具有更寬的線性范圍(10-5×102pg/mL)和更好的靈敏度(10 pg/mL)。
Liu等展示了基于大型納米結構表面的適配體基電化學生物傳感器對細胞分泌的細胞因子的更敏感分析,通過改進的運輸和增強的單位面積表面積。利用覆蓋有金的硅納米線(Si NWs)作為工作電極,實現了IFN- 的適配體基檢測,適配體分子被設計成形成發夾結構,而氧化還原報告物質甲基藍與電極表面距離較近,IFN- 的結合導致氧化還原標簽離電極進一步移動,改變了發夾的構象,并抑制了來自氧化還原報告物質的電子轉移,降低了電化學氧化還原信號。使用方波伏安法量化了IFN- 結合前后的法拉第電流的差異。
圖6D顯示了懸浮細胞和平面Au電極以及AuNWs電極上的細胞沉積和細胞因子IFN- 分泌的不同行為。一系列實驗表明,與標準平面電極相比,NW適配體傳感器對IFN- 的響應更快、更敏感,允許使用低檢測限(0.14 ng/mL)測量IFN- 。該NW適配體傳感器具有更大的表面積和更高的適配體包裝密度,并且受到直接白細胞沉積的影響較小。它在細胞因子檢測方面具有巨大潛力,并滿足了對疾病敏感診斷的重要需求。
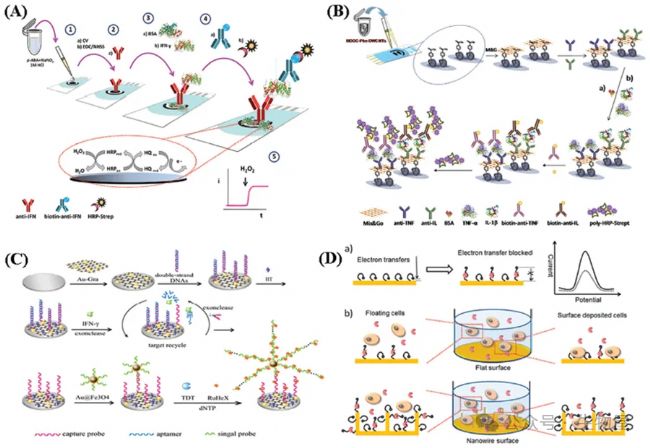
圖6. 基于電化學的細胞因子生物傳感器
用于測定IFN- 的電化學免疫傳感器制備步驟的示意圖;B)用于多重確定IL-1 和TNF- 的雙重電化學免疫傳感器制備步驟的示意圖;C)基于外切酶催化的靶分子回收和表面啟動酶聚合的逐步Aptasensor制備示意圖;D)基于Aptamer的IFN- 電化學傳感器。其他類型的細胞因子生物傳感器
CRISPR/Cas(聚集的規律間隔短回文重復序列/CRISPR相關蛋白)生物傳感是一種高靈敏度和選擇性的工具,可用于檢測不同的目標,包括細胞因子。除了Cas9和Cas12因子外,最近發現的Cas13a效應子的背景RNA裂解活性引起了更大的關注,以開發用于核酸檢測的新型生物傳感技術。CRISPR/Cas13a還使得開發具有高靈敏度的直接RNA測定方法成為可能,用于細胞因子檢測。
Chen等報告了一種CRISPR/Cas13a信號放大聯合免疫吸附測定法(CLISA),用于IL-6和VEGF的檢測,該測定法通過T7 RNA聚合酶轉錄和CRISPR/Cas13a的背景裂解活性使輸出信號進行了雙重放大,T7聚合酶可以識別啟動子序列進行轉錄,并產生許多單鏈RNA分子。CRISPR/Cas13a系統能夠準確識別轉錄的RNA分子,導致激活CRISPR/Cas13的跨切活性,系統中帶有熒光團和猝滅劑團的短單鏈RNA報告物可以通過跨切活性被切割,生成熒光信號。這種CRISPR/Cas13a生物傳感具有很高的靈敏度,并且對細胞因子測量的檢測限可達到飛秒摩爾水平,可以快速同時對大量樣本進行篩選,為生物傳感、醫學研究和分子診斷提供了潛在的超靈敏檢測方法。
基于顏色變化的比色傳感器因其固有的優勢(如簡單處理和視覺指示)而引起關注,可用于各種分析物的即時檢測。貴金屬納米顆粒的光學性質在其與分析物相互作用時會引起可見顏色變化,這是因為納米顆粒的分散和聚集。因此,貴金屬納米顆粒在比色傳感中具有生物分子檢測的潛力。金納米顆粒(AuNPs)是用于細胞因子檢測的比色分析中最受歡迎的貴金屬實體之一。例如,Zhang等報道了一種基于寡核苷酸的比色生物傳感器,利用AuNPs結合支鏈DNA擴增策略來定量VEGF,這是血管生成和血管通透性的重要細胞因子。使用這種比色生物傳感器,可以在一個小時內檢測到3.7飛摩爾的VEGF。Wu等提出了一種基于目標觸發的Aptazyme與AuNPs結合的VEGF測量的比色傳感器。如圖7B所示,這種測定法設計了一個包含VEGF適配體(黑色)、DNA酶(紫色)和短干擾序列(黃色)的Aptazyme。此外,設計了一個鏈接物,其中包含AuNPs的交聯序列和DNA酶的底物序列。在存在VEGF的情況下,VEGF與其適配體之間的識別引起Aptazyme的構象變化,從而激活DNA酶。由于AuNPs無法交聯,AuNPs溶液的顏色保持為紅色,在目標蛋白質缺失時,顏色會發生變化。基于顏色的變化,開發了一種簡單、快速和經濟有效的方法,用于VEGF的定量測定,檢測限低至0.1×10-9M。
基于微環共振器(MR)的傳感,基于準確測量接收層折射率的變化,用于目標和抗體修飾的微環之間的表面結合的實時檢測,已經在標簽自由和實時生物分子檢測中找到了許多應用。這種基于MR的傳感器的優點包括高機械穩定性、檢測靈敏度、可擴展到傳感器網絡的可擴展性以及由于硅片尺寸加工而降低的成本。因此,這種方法代表了一種有前途的平臺,用于細胞因子的實時檢測。硅光子微環諧振器,一類高Q光學微腔,由于實時反應監測能力、小尺寸上的高可擴展性、每個器件低成本和易于制造,最近顯示出在細胞因子的無標簽生物分析中具有潛力。例如,Kindt等報道了一個集成了酶信號增強方案的多重可擴展硅光子MR平臺,用于在未稀釋的腦脊液中同時定量IL-2、IL-6和IL-8,提供了1 pg/m或以下的檢測限,基于MR的傳感平臺在超低濃度下對多種細胞因子的多重檢測具有重要潛力。此外,硅光子MR平臺結合夾心免疫測定法可以實現多種細胞因子的實時監測,Luchansky和Bailey利用一個固有可擴展的硅光子MR分析平臺,在僅5min的測定中實現了來自原代人類T細胞群體分泌的四種細胞因子(IL-2、IL-4、IL-5和TNF- )的同時檢測。總之,基于MR的生物傳感器是一種有前景的平臺,可用于多種多重和實時體外診斷應用,并應進一步進行研究。
干涉反射成像傳感器(IRIS)是另一種用于細胞因子的無標記和實時檢測的潛在技術,在這種生物傳感過程中,傳導基于光譜反射率。隨著上層的整體厚度增加,由于生物質在分層基板表面的積累,上層表面與覆蓋有二氧化硅(Si-SiO2)界面層的硅基板之間的光學路徑差(OPD)也增加,導致光譜反射率發生可量化的變化。因此,這種功能性平臺允許對表面結合的生物分子進行準確、無標記和動態的監測。IRIS技術的實用性已經在細胞培養基中IL-6的實時測量中得到了證明,無標記的生物傳感器使得對IL-6的檢測信號提高了7倍以上,其檢測限接近2 ng/mL。因此,IRIS可用作體外免疫反應的分析平臺或用于監測疾病進展。
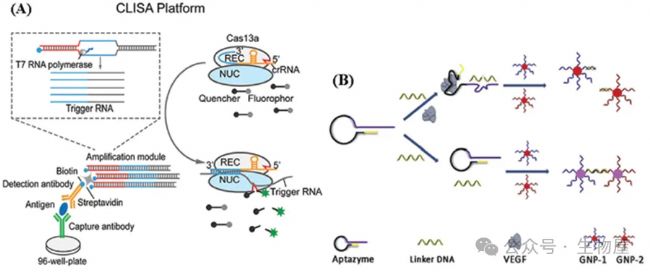
圖7. 其他類型的細胞因子生物傳感器
CRISPR/Cas13a信號放大系統的示意圖;B) 利用VEGF作為示例的蛋白質檢測的提出方法。


[細胞因子檢測技術的比較]
正如我們在前面的章節中所討論的,對臨床相關樣本中多種細胞因子進行定量分析在生物學和醫學中至關重要。ELISA可用于檢測單個細胞因子,而許多商業化的多重技術(基于Luminex或流式細胞術(FCM))也可用于檢測。大多數基于熒光珠技術的商業多重檢測試劑盒允許在小體積中對多種細胞因子進行分析,這些商業化的多重檢測試劑盒比單重檢測試劑盒(例如ELISA)具有更多優勢,包括:1)對樣本體積要求較小,2)減少檢測時間,3)對每個分析物的量化范圍更廣。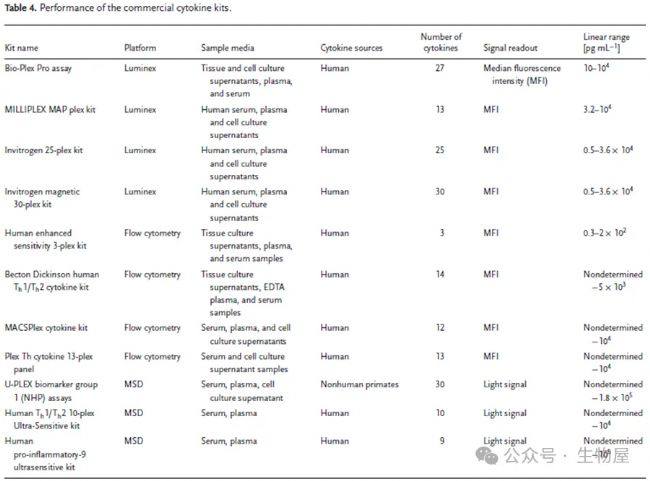
4種細胞因子檢測方法比較
| 檢測技術 | ELISA | CBA | Luminex | HTRF |
|---|---|---|---|---|
| 檢測指標 | 單指標檢測 | 多指標檢測 | 多指標檢測 | 單指標檢測 |
| 檢測對象 | 組織培養上清、血清、血漿等 | 組織培養上清、血清、血漿等 | 組織培養上清、血清、血漿等 | 細胞培養上清 |
| 樣品用量 | 100-200 ul | 15-50 ul | 25-50 ul | 10-20 ul |
| 實驗時間 | >24 h | 3.5 h | 3 h | 2 h |
| 樣本分析 | 酶標儀測OD值 根據標準曲線計算出樣本含量 | 流式細胞儀檢測 FolwJo軟件分析 | Luminex儀器檢測 Luminex xPONENT軟件分析 | 熒光酶標儀檢測 Graphpad四參數擬合 |
| 結果分析 | 絕對定量 | 相對定量 | 絕對定量 | 絕對定量 |
參考文獻
- https://www.xjishu.com/zhuanli/52/201810429351.html
- Binding of cells to matrixes of distinct antibodies coated on solid surface. J. Immunol. Methods 1983, 65, 217–223.
- Development and preliminary clinical validation of a high sensitivity assay for cardiac troponin using a capillary flow (single molecule) fluorescence detector. Clin. Chem. 2006, 52, 2157-2159.
- Immuno-PCR: Very sensitive antigen detection by means of specific antibody-DNA conjugates. Science 1992, 258, 120-122.
- Protein detection using proximity-dependent DNA ligation assays. Nat. Biotechnol. 2002, 20, 473–477.
- Magnetic susceptibility reduction method for magnetically labeled immunoassay. Appl. Phys. Lett. 2006, 88, 212512.
- Single-cell technologies for monitoring immune systems. Nat. Immunol. 2014, 15, 128-135.
- Concurrent detection of secreted products from human lymphocytes by microengraving: Cytokines and antigen-reactive antibodies. Clin. Immunol. 2008, 129, 10-18.
- Cytokines: From Clinical Significance to Quantification. Adv Sci. 2021, 8(15):e2004433. doi: 10.1002/advs.202004433.
- A Novel Detection Platform for Shrimp White Spot Syndrome Virus Using an ICP11- Dependent Immunomagnetic Reduction (IMR) Assay. Plos One. 2015.





